阿特拉津高灵敏酶联免疫吸附检测法的建立*
2018-06-08李晓丽王婷婷宁保安马新华欧国荣高志贤刘忠文
李晓丽,王婷婷,刘 凯,宁保安,马新华,刘 楠,欧国荣,高志贤,刘忠文
(军事科学院军事医学研究院环境医学与作业医学研究所,天津市环境与食品安全风险监控技术重点实验室天津300050)
阿特拉津,又名莠去津(atrazine,AT),化学名称为:2-氯-4-乙胺基-6-异丙胺基-l,3,5-三嗪,作为一种除草剂在世界范围内已广泛推广应用了40多年,环境中有着广泛的分布。经调查,我国某些地区的河流、水库、土壤中均发现有阿特拉津农药残留[1]。
阿特拉津残留的检测方法主要有气相色谱法、液相色谱法和传感器检测法等[2,3]。上述方法需要昂贵的仪器设备和专业的操作人员,不适宜现场的快速检测。酶联免疫吸附法(ELISA)是目前发展最为迅速且较为完善的检测方法,具有操作简单、灵敏度高、特异性强、检测费用低、用时少等特点,因此应用范围极为广泛。本实验室建立的检测克伦特罗的ELISA,灵敏度高、特异性好[4];闫莉等建立的双抗体夹心ELISA能够方便、准确、快速地检测组织中的3-硝基酪氨酸含量[5]。基于此,本研究拟建立检测阿特拉津的间接竞争ELISA。
1 材料与方法
1.1 主要试剂
牛血清白蛋白(bovine albumin,BSA)、卵清白蛋白(ovalbumin,OVA)、吐温-20、过氧化氢、尿素均为美国Sigma公司产品,辣根过氧化物酶标记的羊抗小鼠抗体购自北京中杉金桥生物公司;四甲基联苯胺(tetramethylbenzidine,TMB)购自天津华生生物技术有限公司。其他未作特别说明的试剂均为国产分析纯。
1.2 仪器及材料
酶联条(天津润泰科技有限公司);MultiskanMK3酶标仪(Thermo Labsystems公司);微量移液器(Eppendorf);ALC-210型 4万分之一电子天平(AcculAB);Alliance 2695型 HPLC仪(美国 Waters公司);电热恒温培养箱(天津市实验仪器厂);其它未作说明的仪器均为实验室常规国产仪器。
1.3 间接竞争 ELISA[6]
具体操作见参考文献6。简要修改如下:用包被缓冲液(pH9.6,0.05 mol/L的 CBS)将包被抗原稀释成适当浓度,加入96孔板,每孔100μl,37℃温育2 h。用 pH 7.4的 PBST洗涤液洗涤 3次,每次 3 min,每次洗涤后甩去孔中洗涤液,在吸水纸上拍干。每孔加入130μl封闭溶液,37℃温育1 h,用PBST洗涤3次,每次3min。用样品稀释液将竞争抗原稀释成一定浓度,每孔加入50μl一系列浓度的竞争抗原;用抗体稀释液将一抗稀释成一定浓度,每孔加入50μl适当浓度的一抗,37℃温育 1.5 h,用 PBST洗涤5次,每次3 min。每孔加入100μl新配制的辣根过氧化物酶标记的山羊抗小鼠 IgG,37℃温育45 min,用PBST洗涤6次,每次3 min。每孔加入新配制的底物液100μl,37℃温育10 min,然后每孔加入2mol/L的H2SO4溶液 50μl终止反应,在酶联免疫检测仪上读取A450nm和A630nm。
1.4 ELISA法条件优化[7]
1.4.1 包被抗原与一抗的最佳工作浓度筛选 采用棋盘滴定法来确定两者的最佳结合浓度。首先用一系列浓度的包被抗原包被96孔酶标板,再将一抗作一系列稀释,用间接ELISA测定两者的最佳结合浓度,操作步骤同1.3。
1.4.2 选择一抗稀释度为1∶16 000对包被抗原进行细化筛选实验 操作步骤同1.3所示。实验将包被抗原的浓度分别调整为 1,1.2,1.4,1.6,1.8,2.0,2.2μg/ml,纵向包被 96孔板,每孔加入包被抗原100μl,4℃过夜。用PBS按5倍的梯度稀释竞争抗原,浓度从 20μg/ml至 5×10-5μg/ml,共 9个梯度,在96孔板中每孔加入50μl。将一抗的浓度调整为1∶16 000,每孔加入 50μl。其他操作步骤不变,取A450nm值最接近于1、且IC50值最小的包被抗原浓度为最佳工作浓度。
1.4.3 不同有机溶剂对竞争结合反应的影响 用含不同浓度的不同有机溶剂来稀释农药标样,其中有机溶剂用0.1 mol/L的 PBS稀释,在已优化条件的基础上,进行间接竞争ELISA测定,考察不同浓度的不同有机溶剂对抗原抗体竞争结合反应的影响。最终选择影响最小的有机溶剂及其浓度作为最佳有机溶剂及浓度。
1.4.4 酶标二抗稀释度筛选 将酶标二抗即辣根过氧化物酶标记的羊抗小鼠IgG的浓度按1∶1 500,1∶2 000,1∶2 500,1∶3 000,1∶3 500,1∶4 000,1∶4 500,1∶5 000的稀释度等差稀释,然后进行间接竞争ELISA实验,绘制标准曲线,并计算各稀释度下阿特拉津检测的IC50值,选择IC50值较小、特异性吸附较小、且A450nm值在1附近的二抗浓度作为最佳酶标二抗稀释度。
1.5 检测阿特拉津间接竞争ELISA标准曲线的建立[8]
1.5.1 标准曲线的绘制 在线性范围内,用样品稀释液(PBS,含10%甲醇)将阿特拉津标样稀释成如下的一系列浓度:123.46 ng/ml,41.15 ng/ml,13.72 ng/ml,4.57 ng/ml,1.52ng/ml,0 ng/ml,共 6个梯度。用以上优化的最佳条件,按间接竞争ELISA进行阿特拉津检测,每个浓度重复测定5次,以阿特拉津浓度的对数值为横坐标,以各浓度对应的抑制率为纵坐标绘制工作曲线,并对工作曲线进行方程拟合,计算工作曲线的拟合度,建立阿特拉津检测的标准曲线,同时依据该标准曲线得出最低检出限及线性范围。
1.5.2 间接竞争ELISA特异性实验 按照以上优化的最优条件,以间接竞争ELISA测定阿特拉津的A450nm值。同时,按相同的稀释方法稀释阿特拉津的结构类似物及功能类似物扑草净,扑灭津,特丁通,三聚氰胺,毒死蜱,久效磷,对硫磷,六六六,并采用同一抗体进行间接竞争 ELISA,测定各类似物的A450nm值,绘制标准曲线,计算抑制率等于50%时所需抑制物的浓度IC50,计算交叉反应率,交叉反应率越低,方法的特异性越好。
1.5.3 样品添加回收率实验[9]白菜、番茄、胡萝卜、梨、甘蔗、瘦肉均购自某菜市场,自来水采自天津自来水厂,牛奶购自某超市。每种样品分别取四组,按常规前处理方法处理后,再按上述摸索优化的最佳条件进行间接竞争ELISA测定。其中,每块酶标板均设置标准曲线,且每个标样浓度重复测定5次,各样品的每个浓度也重复测定5次,计算与样品各浓度对应的抑制率,并与同一块酶标板的标准曲线对照,计算农药含量和样品添加回收率。将测得的添加回收率进行统计,计算回收率变异系数和回收率的变化范围,要求添加回收率落在相对稳定、狭窄的区间内。
1.5.4 ELISA与仪器方法的比对实验 在本实验ELISA检测的线性范围内,随机选取番茄和梨作为样本与高效液相色谱法(HPLC)进行比对实验。番茄和梨两种样品中阿特拉津标样的添加浓度为0 ng/ml,6 ng/ml,30 ng/ml,80 ng/ml。样品按常规方法进行前处理。
2 结果
2.1 包被抗原与一抗最佳工作浓度筛选
采用棋盘滴定法筛选包被抗原和一抗的最佳结合浓度。由表1可知:当包被原浓度为1.6μg/ml、一抗的浓度为1∶16 000时,对应的A450nm值为1.049,此时检测灵敏度较高。初步选定包被抗原的工作浓度为 1.6μg/ml,一抗的工作浓度为 1∶16 000。
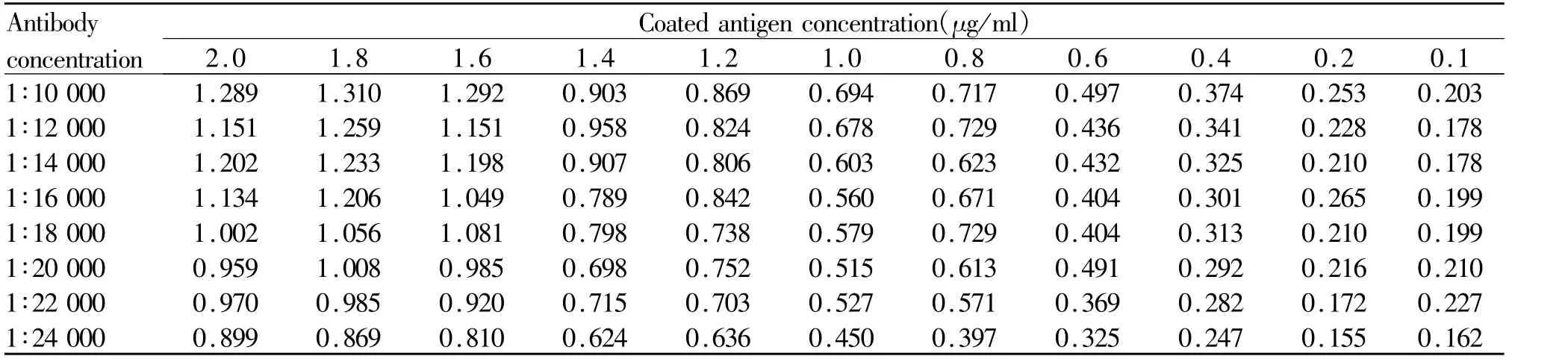
Tab.1 The selection of the optimum working concentration of coating antigen and antibody
2.2 选择一抗稀释度为1∶16 000对包被抗原进行细化筛选试验
为了进一步确定包被抗原的量,本实验围绕包被抗原的较适工作浓度(1μg/ml~2.2μg/ml),以前一实验筛选的一抗工作浓度(1∶16 000)进行间接竞争ELISA测定,其中阿特拉津小分子的使用浓度为20μg/ml~5×10-5μg/ml(按 5倍的梯度稀释),共 9个梯度。选择A450nm值在1附近且检测灵敏度较高时所对应的包被抗原浓度为最佳浓度(表2)。

Tab.2 The selection experimentof the optimum working concentration of coating antigen
由表2可知:当包被抗原的浓度为1.6μg/ml时,其 A450nm值在 1附近(1.086),且 IC50值最小(4.679),因此选择包被抗原浓度 1.6μg/ml。
2.3 不同有机溶剂对竞争结合反应的影响
由图1可知:各有机溶剂对ELISA竞争结合反应均有一定的影响,表现在A450nm值均有不同程度的降低。而且同一种有机溶剂的浓度越大,对竞争结合反应的抑制作用也越大。在所检测的几种有机溶剂中,对竞争结合反应影响最小的是甲醇,曲线相对平缓。当甲醇浓度为5%和10%时,对竞争结合反应的影响较小。
由图2可知:当甲醇浓度为10%时,其对应的IC50值和LOD值均最小,即灵敏度最高,因此本研究最终选择10%甲醇作为助溶剂。
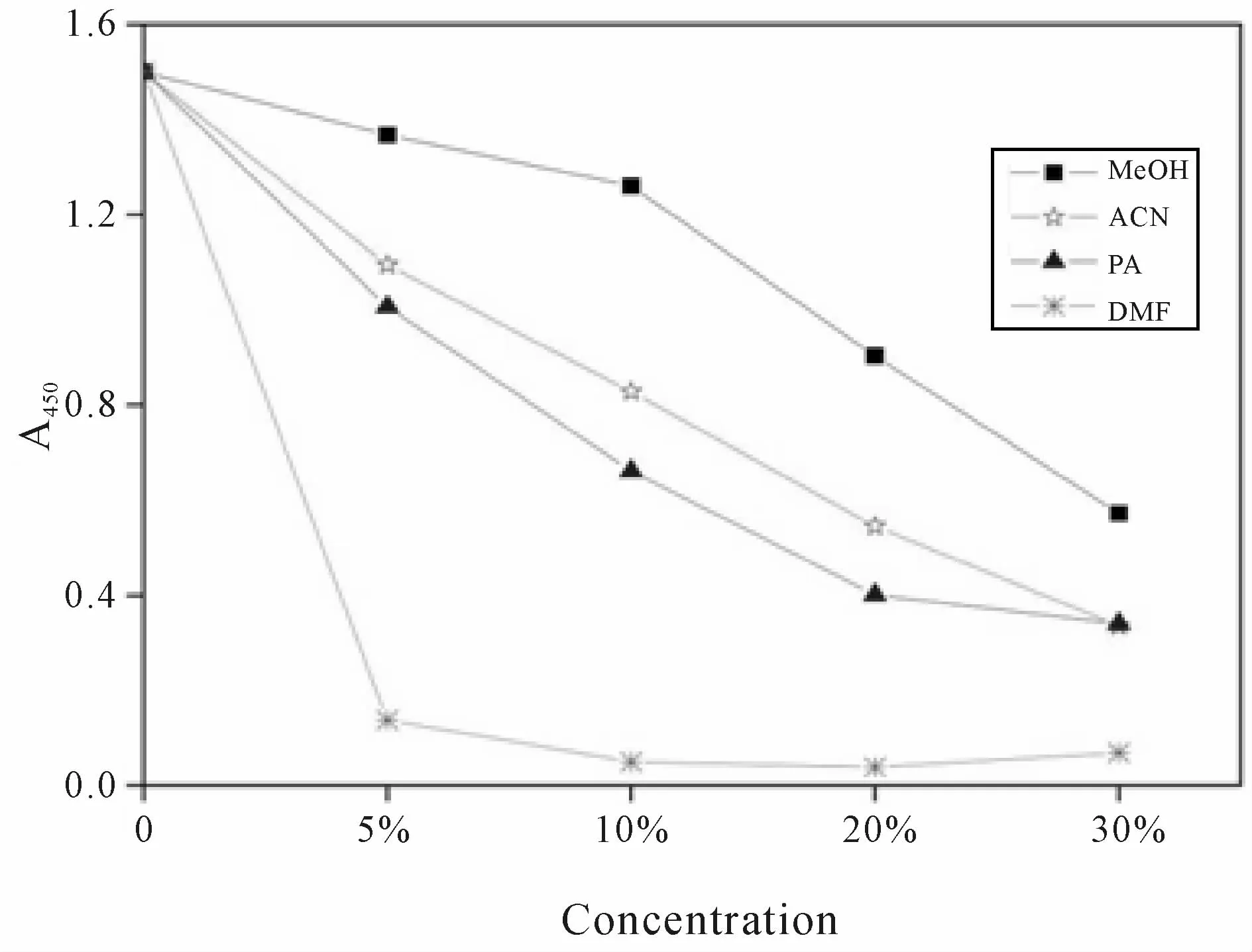
Fig.1 Effects of different solvents on competitive binding reaction MeOH:Methanol;ACN:Acetonitrile;PA:Acetone;DMF:N,N-dimethylformamide

Fig.2 The value of IC50 and LODwith differentmethanol concentrationLOD:Theminimum detection limit
2.4 酶标二抗稀释度的筛选
在本研究中,将酶标二抗的浓度按1∶1 500,1∶2 000,1∶2 500,1∶3 000,1∶3 500,1∶4 000,1∶4 500,1∶5 000的稀释度等差稀释后,在已优化条件的基础上进行间接竞争ELISA实验,结果如表3。

Tab.3 The selection experiment of the optimum concentration of goat anti-mouse IgG-HRP
由表3可知:当辣根过氧化物酶标记的羊抗小鼠IgG的稀释度为1∶4 000时,其检测灵敏度及线性关系是最好的,因此选择稀释度为1∶4 000作为酶标二抗的最佳稀释度。
2.5 标准曲线的绘制
本研究在线性范围内,将阿特拉津标样用样品稀释液(PBS,含 10%甲醇)稀释成一系列浓度(123.46 ng/ml,41.15 ng/ml,13.72 ng/ml,4.57 ng/ml,1.52 ng/ml,0 ng/ml),在已优化条件的基础上进行间接竞争ELISA检测,每个浓度重复测定5次,以阿特拉津浓度的对数值为横坐标,以各浓度对应的抑制率为纵坐标绘制工作曲线,结果如下。

Fig.3 Repeatability of standard curve for detecting AT
由图3可知:标准曲线的重复性很好,几乎重叠,表明方法的重复性很好。由5个重复的平均值所做的标准曲线呈“S”形,其头及尾部曲线趋于平坦,中央近似直线的部分是最理想的检测区域。对此检测区域进行拟合,拟合图见图4。

Fig.4 Standard curve for detecting AT
2.6 方法特异性实验
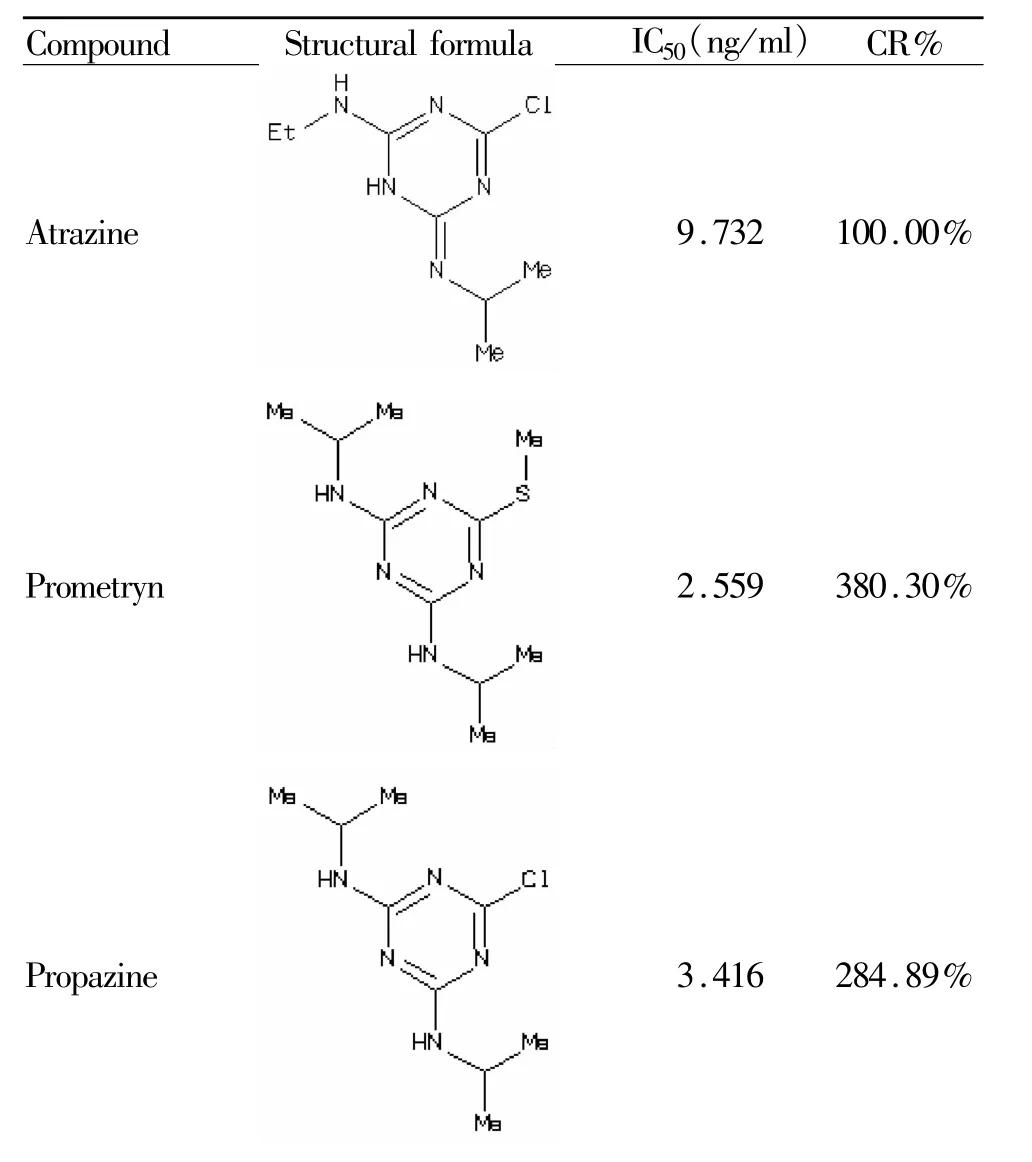
Tab.4The specificity of ELISA
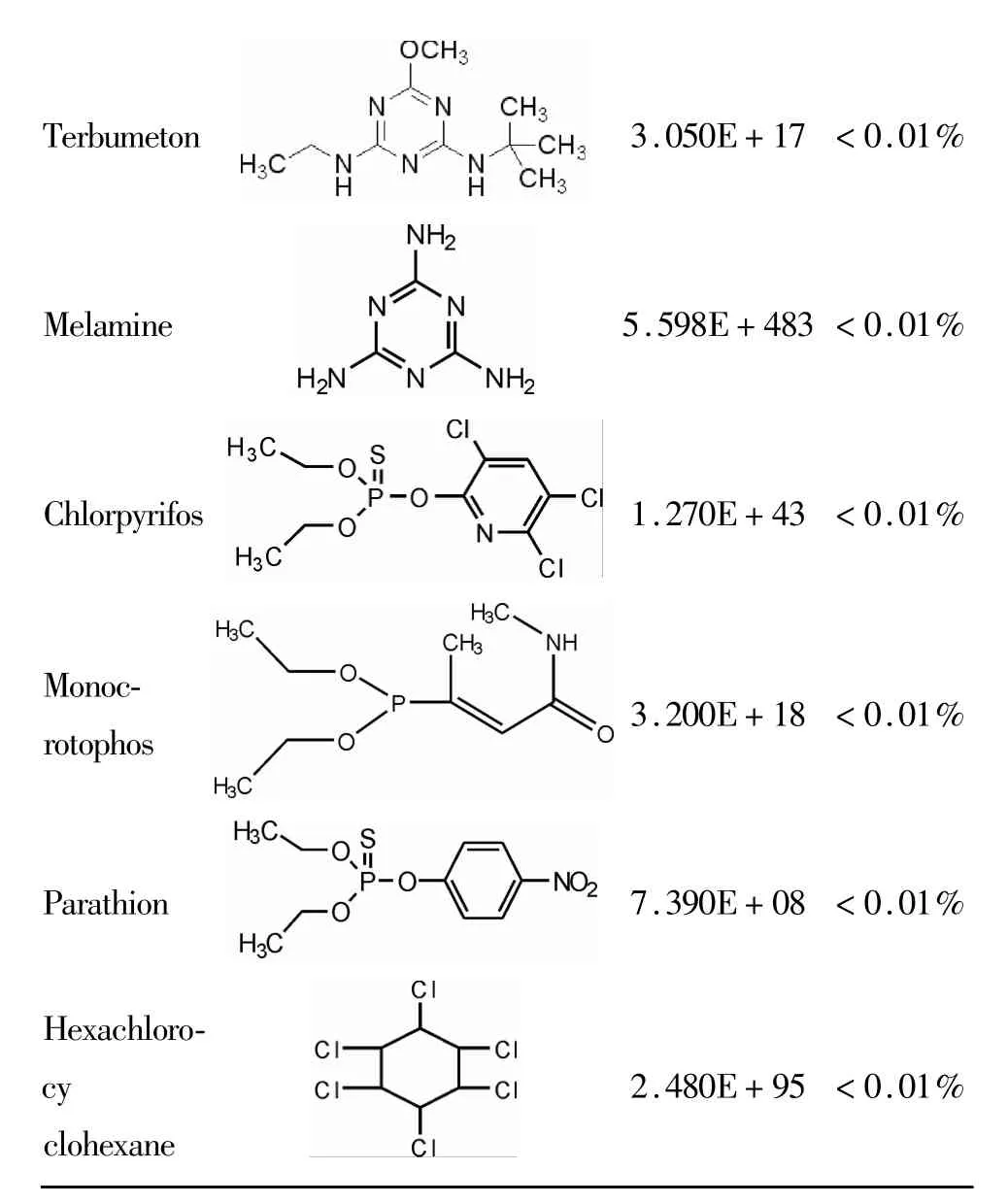
T e r b u m e t o n 3.0 5 0 E+1 7 <0.0 1%M e l a m i n e 5.5 9 8 E+4 8 3<0.0 1%C h l o r p y r i f o s 1.2 7 0 E+4 3 <0.0 1%M o n o c-r o t o p h o s 3.2 0 0 E+1 8 <0.0 1%P a r a t h i o n 7.3 9 0 E+0 8 <0.0 1%H e x a c h l o r o-c y c l o h e x a n e 2.4 8 0 E+9 5 <0.0 1%
2.7 样品回收率实验结果
从表6可以看出:当添加阿特拉津浓度为0 ng/ml和6 ng/ml时,ELISA检测梨中阿特拉津残留量分别为 1.356ng/ml和 7.826ng/ml,回收率为107.80%;番茄中阿特拉津残留量分别为1.552 ng/ml和6.969 ng/ml,回收率为 90.28%;而在此浓度范围内 HPLC均未检出。
另还可知:当阿特拉津添加浓度为30 ng/ml及80 ng/ml时,ELISA检测梨中阿特拉津残留的回收率分别为89.01%和91.87%,番茄中阿特拉津残留的回收率分别为88.16%和 89.00%;HPLC法检测梨中阿特拉津残留的回收率分别为 126.7%和88.48%,番茄中分别为 121.0%和 93.41%。
3 讨论
本研究建立的检测阿特拉津ELISA的标准曲线的重复性很好,曲线相关系数R2=0.9958,提示相关性较好,标准曲线最低检出限为1.972 ng/ml。从采用阿特拉津结构类似物进行的交叉反应结果可以看出,除扑草净和扑灭津外,其他类似物与阿特拉津的交叉反应率均远低于0.01%,说明该方法特异性较好。扑草净,扑灭津与阿特拉津的相似之处,是其化学结构中均有三嗪母环及环上的一个亚氨基(-NH-)和一个异丙氨基,交叉反应率高达285%~380%,提示抗阿特拉津抗体是针对三嗪母环及环上的亚氨基和异丙氨基的。
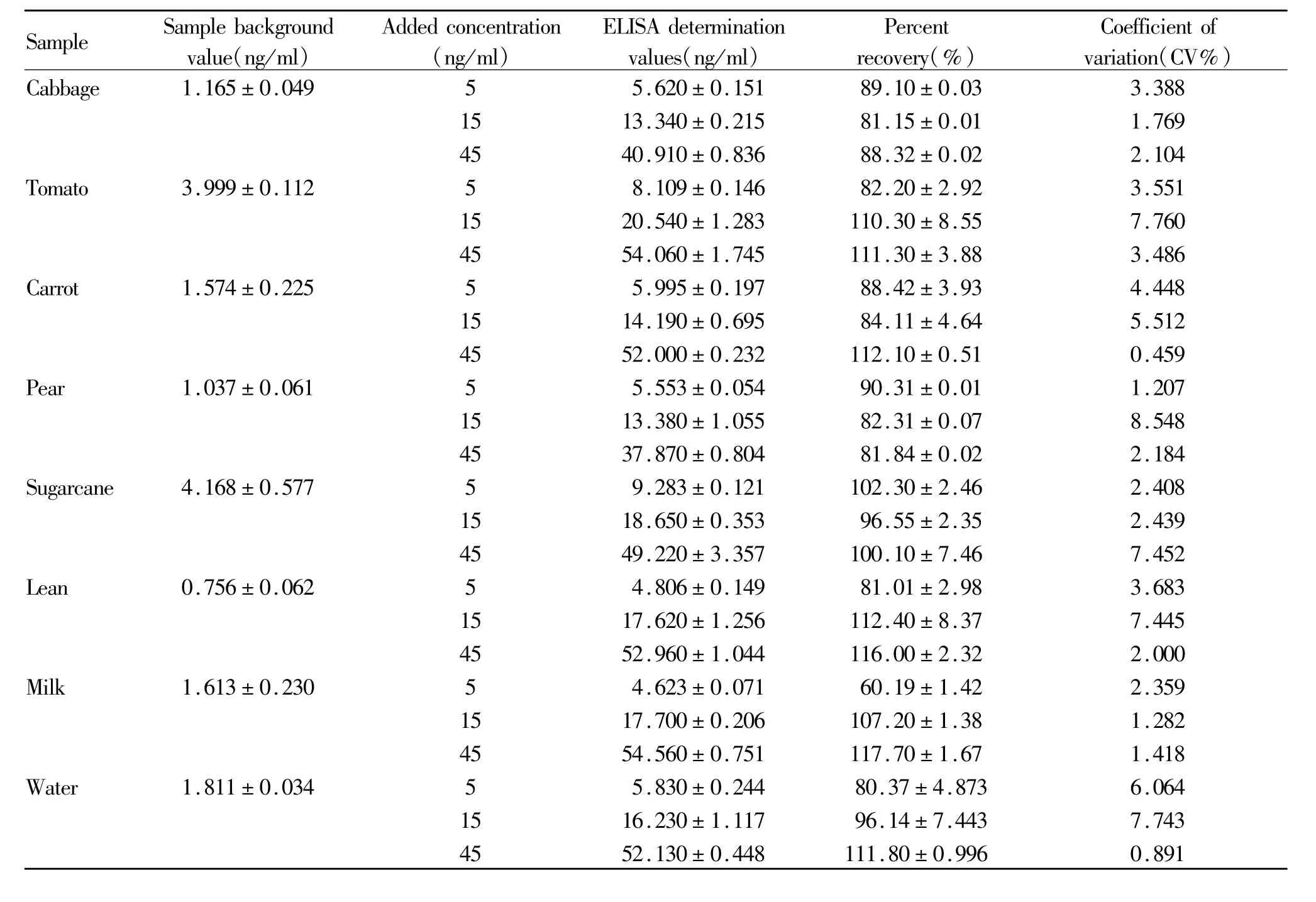
Tab.5 Recoveries of different samples(n=5)
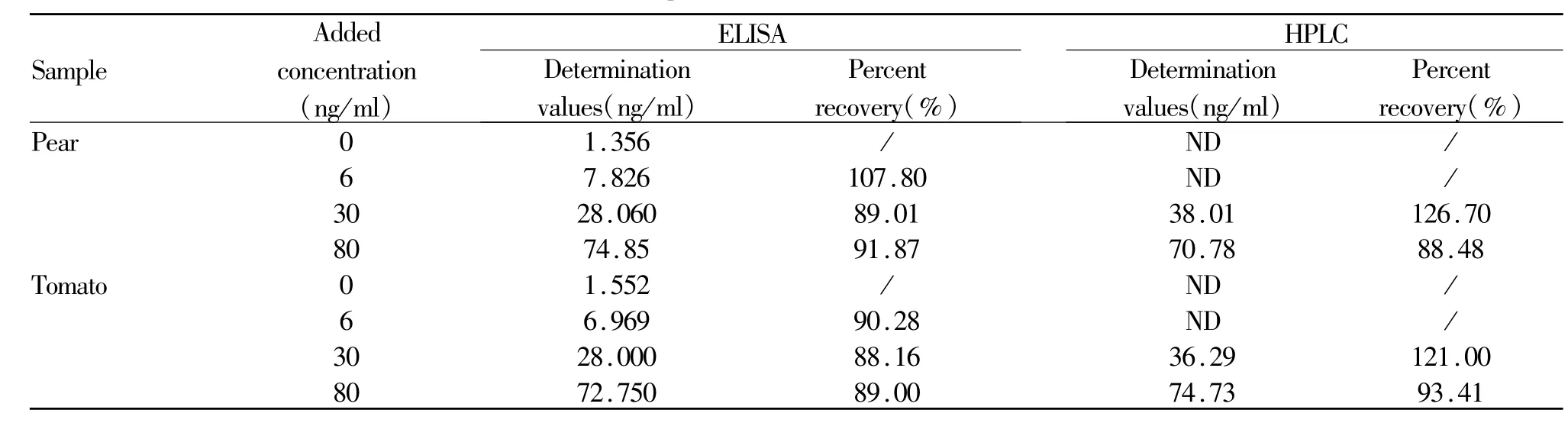
Tab.6 The comparition between ELISA and HPLC(n=5)
通过与HPLC对比试验,证实本文建立的阿特拉津ELISA检测与HPLC检测具有较好的可比性,说明此方法可代替大型仪器用于阿特拉津的检测。
[1] 叶常明,雷志芳,王杏君,等.除草剂阿特拉津的多介质环境行为[J].环境科学,2001,22(2):69-73.
[2] 施艳峰,李国文,邵应春,等.液液萃取-气相色谱-三重四极杆串联质谱联用检测水体中阿特拉津的方法研究[J].环境科学导刊,2014(3):73-75.
[3] Baranowska I,Barchanska H,Pacak E.Proceduresof trophic chain samples preparation for determination of triazines by HPLC andmetals by ICP-AESmethods[J].Environ Pollut,2006,143(2):206-211.
[4] 李晓丽,宁保安,刘 楠,等.克伦特罗单克隆抗体的纯化及其生物学特性的研究[J].中国应用生理学杂志,2014,30(5):413-416.
[5] 闫 莉,许言午,王晓梁,等.双抗体夹心法检测3-硝基酪氨酸方法的建立及应用[J].中国应用生理学杂志,2009,25(4):569-572.
[6] Baranowska I,Barchanska H,Abuknesha RA,etal.ELISA and HPLCmethods for atrazine and simazine determination in trophic chains samples[J].Ecotoxcol Environ Saf,2008,70(2):341-348.
[7] Pardieu E,Cheap H,Vedrine C,etal.Molecularly imprinted conducting polymer based electrochemical sensor for detection of atrazine[J].Anal Chim Acta,2009,649(2):236-245.
[8] ions in atrazine and metolachlor surface water concentrations in Ontario(Canada)using ELISA[J].Chemosphere,2011,82(8):1155-1160.
[9] Baranowska I,Barchanska H,Pyrsz A.Distribution of pesticides and heavy metals in trophic chain[J].Chemosphere,2005,60(11):1590-1599.
