黄芪注射液对阿霉素性心肌细胞凋亡、内质网应激与缝隙连接蛋白表达的影响*
2018-06-08贺智慧邵立群宣丽颖王春贵魏成喜
贺智慧,邵立群,宣丽颖,王春贵,魏成喜,王 羽△,赵 明△
(1.内蒙古民族大学医学院,通辽028000;2.内蒙古民族大学附属医院,通辽028000)
阿霉素(adriamycin,ADR)是一种广谱蒽环类抗肿瘤药物,由于ADR与心肌组织具有非常高的亲和力,具有严重的心脏毒性,可导致阿霉素性心肌病,其特点为心室扩大并伴有心肌重构及收缩功能降低[1]。阿霉素性心肌病因心肌病变导致心肌细胞凋亡及心肌纤维化等因素易诱发室性心律失常,引起患者心源性晕厥、猝死[2]。内质网(endoplasmic reticulum,ER)是一种亚细胞器,主要功能是合成蛋白质并使合成的蛋白质由一级结构变成具有生理功能的空间结构场所。当各种原因导致内质网稳态失衡时,出现误折叠蛋白在内质网内异常聚集并引起内质网应激性蛋白分泌增加,识别错误折叠蛋白,通过蛋白酶体将其降解,上述一系列反应过程即内质网应激反应(endoplasmic reticulum stress,ERS)[3]。文献报道内质网应激与心肌重构及心肌病密切相关[4],而阿霉素性心肌病主要病理学变化就是发生心肌细胞凋亡及纤维化等心肌重塑改变。黄芪是我国传统中药之一(系豆科植物蒙古黄芪或膜荚黄芪的干燥根),为常用补气药物,具有显著的益气强心作用。本团队在前期工作中发现黄芪注射液对阿霉素所致的心肌损伤具有保护作用[5],但具体机制尚未明确。本研究拟用Wistar大鼠作为研究对象,建立阿霉素性心肌病动物模型,予以黄芪注射液干预治疗,探讨其对阿霉素心肌病保护的机制,为黄芪注射液临床有效治疗阿霉素性心肌病提供理论依据。
1 材料与方法
1.1 动物药品与仪器
Wistar大鼠购自吉林大学基础医学院动物中心,许可证号:scxk(吉)2011-0004。阿霉素(深圳万东药业)。CX43及p-CX43抗体购于Wanleibio公司。黄芪注射液(成都地奥九泓制药厂),国药准字Z51021776,规格:10 ml/支。光学显微镜(Olympus)和H-600型电子显微镜(日立,日本)。
1.2 实验分组及扩张型心肌病大鼠模型制备
36只Wistar雄性大鼠,体重200~230 g,适应性喂养后随机分为3组(n=12):对照组、阿霉素心肌病组及黄芪注射液组,对照组腹腔注射0.9%Nacl(10ml/kg);阿霉素心肌病组腹腔注射阿霉素2 mg/kg。黄芪注射液组在每次注射同等剂量阿霉素同时,注射黄芪注射液10 g/kg。各组每周注射一次,共三周)。
1.3 心脏彩超检测
实验第7周末,用VIVID E9彩超机对3组大鼠行多普勒心脏超声检测心功能,以左室舒张末期内径(left ventricular end-diastolic diameter,LVEDD)、左室收缩末期内径(left ventricular end-systolic diameter,LVESD)及左室射血分数(left ventricular ejection fraction,LVEF)数值来确定阿霉素心肌病模型是否造模成功及黄芪注射液治疗效果。
1.4 病理取材及切片制作
心脏超声心动图检查后,立即处死大鼠,在无菌状态下剪开大鼠左肋,去除心包后暴露心脏,取出心脏。将左心室肌组织放入4%多聚甲醛溶液中固定,经乙醇脱水,石蜡包埋,切片,心肌切片脱蜡、二甲苯透明,行HE、masson染色,于光镜下观察病理变化。同时将中、下1/3心脏组织加于2.5%戊二醛溶液中固定,PBS溶液漂洗,1%锇酸固定,再次用PBS溶液漂洗,梯度乙醇脱水,Epon812环氧树脂浸透包埋,超薄切片成70 nm切片,醋酸铀柠檬酸铅染色,于透射电镜下观察拍片并存档。
1.5 TUNEL法检测大鼠心肌细胞凋亡
采用标准TUNEL实验步骤,检测各组大鼠心肌细胞凋亡情况。
1.6 免疫组化检测各组大鼠心肌细胞CX43及p-CX43表达
各组大鼠心肌组织用4%多聚甲醛溶液固定,脱水,石蜡包埋,切片后进行免疫组化染色。加入抗CX43及抗 p-CX43抗体,37℃作用 2 h,PBS洗涤 3次。加入辣根过氧化物酶标记的二抗,37℃作用1 h后,PBS洗涤 3次。加入 3,3’-二氨基联苯胺(DAB)显色,显色终止后,显微镜下观察染色后的组织,并采集图像分析。
1.7 Real-time PCR检测大鼠心肌细胞 Grp78、ATF-4及CHOPmRNA表达
引物信息:Grp78 Forward 5’-3’ CAGCCAACTGTAACAATCAA;Grp78 Reverse 5’-3’ CTGTCACTCGGAGAATACCA;ATF-4 Forward 5’-3’ CTG-TATGAGCCCAGAGTCCT;ATF-4 Reverse 5’-3’GCTGCTGTCTTGTTTTGCTC;CHOP Forward 5’-3’ATGTTGAAGATGAGCGGGTG;CHOP Reverse 5’-3’CCGTCTCCAAGGTGAAAGGC;β-actin Forward 5’-3’ GGAGATTACTGCCCTGGCTCCTAGC;β-actin Reverse 5’-3’ GGCCGGACTCATCGTACTCCTGCTT
经标准real-time PCR实验步骤,检测3组大鼠心肌细胞 Grp78、ATF-4及 CHOPmRNA表达,利用2-△△CT方法分析实验数据。
1.8 统计学方法
实验结果以均值 ±标准差()表示,采用SSPS 11.5统计分析软件进行数据分析,两组间均数比较采用 t检验。
2 结果
2.1 黄芪注射液对大鼠精神、饮食、活动、毛色及死亡数量的影响
对照组大鼠毛发光亮,体质量随时间增加。ADR组大鼠毛发灰暗,躁动不安,不喜饮食,心脏增大;黄芪注射液组大鼠毛发略灰暗。3组大鼠在饲养及实验过程中均未出现死亡。
2.2 黄芪注射液对大鼠心脏彩超的影响
如图1、表1所示,对照组大鼠心脏彩超未见明显异常。与对照组比较,ADR组大鼠 LVEDD、LVESD明显增大,LVEF明显减少(P均 <0.01),说明造模成功。黄芪注射液组大鼠LVEDD、LVESD较ADR组大鼠明显减小,LVEF明显增加(P均 <0.01)。
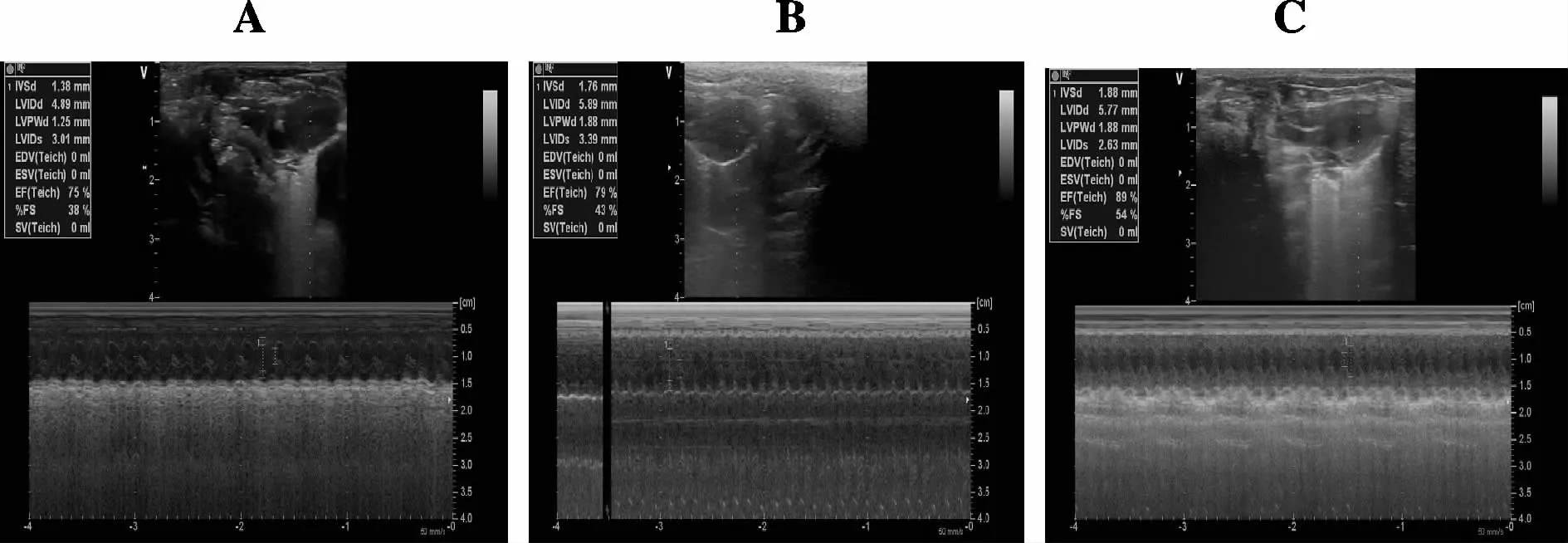
Fig.1 Heart color Doppler ultrasound images of each group
2.3 黄芪注射液对大鼠心肌结构的影响
HE染色显示:ADR组大鼠出现心肌纤维排列紊乱,心肌纤维间质水肿,大量淋巴细胞浸润。黄芪注射液组大鼠心肌紊乱及间质水肿明显轻于ADR组(图2)。Masson染色时,心肌纤维和红细胞呈红色,而胶原纤维呈蓝色。Masson染色显示,ADR组大鼠心肌纤维化严重;黄芪注射液组大鼠心肌纤维化轻于ADR组(图3)。电镜观察显示:ADR组大鼠心肌显示有肌纤维溶解破坏、线粒体极度肿胀、破坏,呈空泡样。黄芪注射液组心肌细胞超微结构损伤较ADR组明显减轻,线粒体空泡明显减少(图4)。
Tab.1 Ventricular structure in each group rats with dilated cardiomyopathy(,n=12)
LVEDD:Left ventricular end-diastolic diameter;LVESD:Left ventricular end-systolic diameter;LVEF:Left ventricular ejection fraction**P<0.01 vs control group; #P<0.05,##P<0.01 vs ADR group
Group LVEDD(mm) LVESD(mm) LVEF(%)Control 4.63±0.37 2.49±0.24 80.0±4.7 ADR 6.24±0.31**3.54±0.33**69.0±4.2**Astragalus 5.31±0.24## 2.97±0.41## 76.0±3.9#

Fig.2 The rat cardiomyocyte HE staining
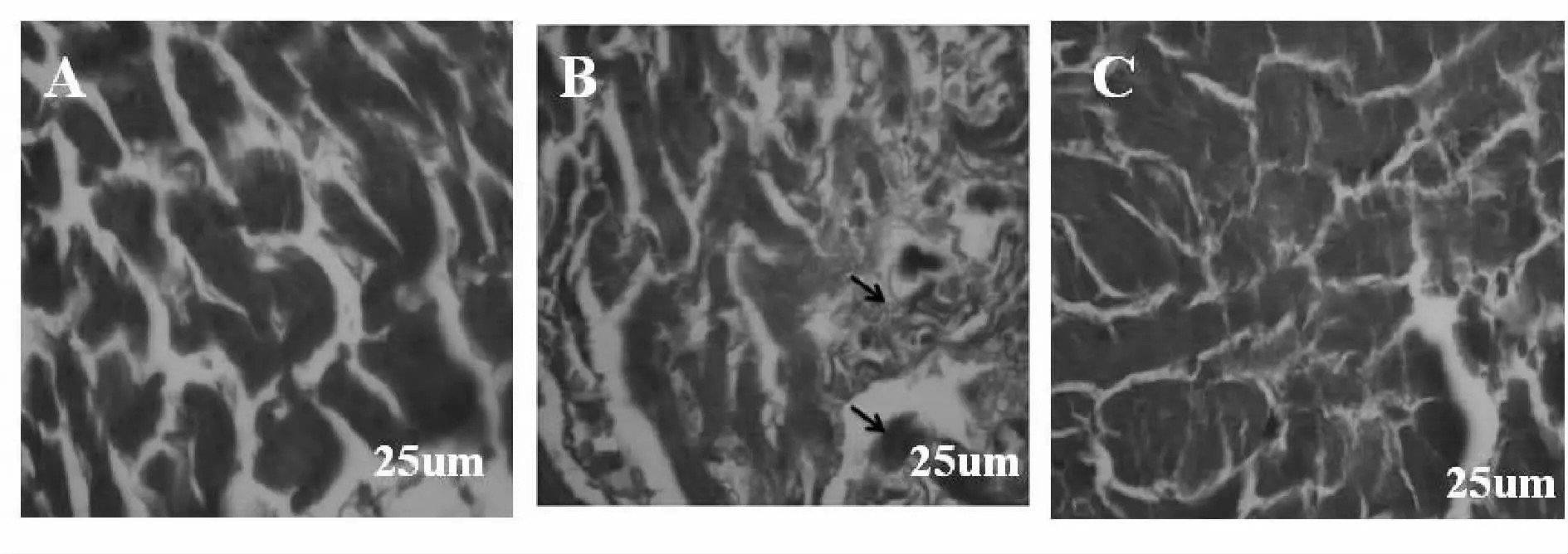
Fig.3 The rat cardiomyocyte Masson staining

Fig.4 Transmission electronic microscope image of rat cardiomyocyte
2.4 黄芪注射液对大鼠心肌细胞凋亡的影响
如图5所示:与对照组大鼠心肌细胞凋亡(4.12±0.98)%比较,ADR组大鼠心肌细胞凋亡(25.23±5.38)%明显增加(P<0.01);与 ADR组大鼠心肌细胞凋亡比较,黄芪注射液组大鼠心肌细胞凋亡(15.71±5.76)%明显减低(P<0.01)。

Fig.5 Apoptosis of rat cardiomyocyte of each group
2.5 黄芪注射液对大鼠心肌细胞CX43及p-CX43表达的影响
如图6所示:与对照组大鼠(21.1±1.07)%比较,ADR组大鼠心肌细胞 CX43表达(1.15±0.51)%明显减少,与ADR组大鼠比较,黄芪注射液组大鼠心肌细胞 CX43表达(10.37±0.78)%明显增加。与对照组大鼠心肌细胞 p-CX43表达(0.94±0.11)%比较,ADR组大鼠心肌细胞 p-CX43表达(9.77±0.69)%明显增加;与ADR组大鼠比较,黄芪注射液组大鼠心肌细胞 p-CX43表达(4.18±0.51)%明显减少。

Fig.6 CX43 and p-CX43 immunohistochemistry staining of rat cardiomyocyte in each group
2.6 黄芪注射液对大鼠心肌细胞Grp78、ATF-4及CHOPmRNA表达的影响
3组大鼠心肌细胞Grp78、ATF-4及CHOP的扩增曲线及溶解曲线如图7所示。
与对照组比较,ADR组大鼠心肌细胞Grp78,ATF-4和CHOPmRNA表达明显增多(P<0.01);与ADR组大鼠比较,黄芪注射液组大鼠心肌细胞Grp78,ATF-4和 CHOP mRNA表达明显减少(P<0.01,表 2)。
3 讨论
内质网稳态失衡时,内质网中蛋白质正确折叠功能异常,可导致误折叠蛋白质在内质网内异常聚集及内质网应激性蛋白分泌增加,识别错误折叠蛋白质,并通过蛋白酶体将其降解,上述一系列反应过程即内质网应激反应(endoplasmic reticulum stress,ERS)[6]。VMC小鼠及柯莎奇 B3(CVB3)病毒感染心肌细胞可引发ERS[7]。本课题组前期实验发现,阿霉素可引起心肌细胞发生内质网应激,通过内质网应激信号通路引发心肌细胞凋亡[8]。凋亡使工作心肌细胞绝对数量减少,导致心肌收缩力下降,从而发生心力衰竭[9]。同时,心肌细胞凋亡可导致心脏成纤维细胞增生、转化为肌成纤维细胞,增加细胞外基质沉积,导致心脏纤维化引发心肌重构[10]。

Tab.2 The mRNA expression of Grp78,ATF-4 and CHOP in rats’heartof each group

Fig.7 Amplification and solubility curve of Grp78,ATF-4,CHOP real-time PCR
中药材黄芪为豆科草本植物蒙古黄芪的根,具有补气固表、利水退肿功效[11],作为药物使用已有两千多年的历史。黄芪注射液是从黄芪中提取的有效成分,临床应用广泛,可用于治疗心气虚损、血脉瘀阻之病毒性心肌炎、心功能不全等疾病[5]。
本研究发现,阿霉素组大鼠心肌细胞内质网应激伴侣蛋白 Grp78(glucose-regulated protein 78)以及内质网应激凋亡信号通路因子ATF-4(activating transcription factor 4)、CHOP(C/EBP homologous protein)mRNA表达明显增多,并出现严重心肌细胞凋亡;而黄芪注射液组大鼠心肌细胞凋亡明显减少,同时伴有Grp78、ATF-4、CHOPmRNA表达减少。上述实验结果说明,阿霉素可引起心肌细胞内质网应激,并通过内质网凋亡信号通路Grp78→ATF-4→CHOP介导心肌细胞凋亡;黄芪注射液减少阿霉素大鼠心肌细胞凋亡机制是缓解心肌细胞内质网应激,并抑制内质网凋亡信号通路因子活化。同时,实验发现黄芪注射液能够增加阿霉素大鼠心肌细胞Cx43(connexin 43)表达,减少p-Cx43表达。文献报道:Cx43是构成缝隙连接通道(gap junction,GJ)的主要成分,Cx43磷酸化使GJ通道关闭,而Cx43去磷酸化则促使GJ通道开放[12]。GJ通道关闭使得心肌细胞间电传导出现障碍,是产生心律失常的重要原因。研究结果表明,黄芪注射液能增加Cx43表达,抑制p-Cx43表达,具有抗阿霉素心肌病所致的心律失常作用,其作用机制可能与抑制阿霉素诱导内质网应激而致心肌细胞凋亡及缝隙连接蛋白磷酸化有关。据此推测,未来黄芪注射液可能被广泛用于阿霉素心肌病的临床治疗。
[1] 王曦烨,单晓彤,王伊林,等.丹参多酚酸盐改善扩张性心肌病心肌功能的作用机制[J].高等学校化学学报,2016,37(5):844-851.
[2] 王伊林,崔晓雪,柴 花,等.丹参酮IIA磺酸钠对阿霉素心肌病大鼠心室肌闰盘保护作用[J].临床心血管病杂志,2016,32(8):843-847.
[3] 赵 明,单晓彤,赵亚红,等.阿霉素损伤心肌细胞miRNA378与 calumenin、GRP78、bax及 bcl-2相关性研究[J].临床心血管病杂志,2016,32(6):603-606.
[4] 刘崇斌,王伊林,柴 花,等.丹参多酚酸盐对阿霉素诱导的扩张型心肌病大鼠心功能的影响及机制研究[J].临床心血管病杂志,2016,32(2):134-138.
[5] 魏征人,陈智嘉,张春璐,等.黄芪注射液对阿霉素所致心肌病理改变和超微结构的影响[J].中国应用生理学杂志,2013,29(5):404-405.
[6] 赵 明,刘晓翠,崔晓雪,等.miRNA378*表达对柯萨奇B3病毒感染乳鼠心肌细胞凋亡、网腔钙结合蛋白、内质网应激伴侣蛋白表达的影响[J].中国应用生理学杂志,2017,33(4):304-307.
[7] 牛晓峰,赵雅君,陶谢鑫,等.黄芪总黄酮通过抑制内质网应激对小鼠病毒性心肌炎保护作用的实验研究[J].临床心血管病杂志,2015,31(2):129-132.
[8] 赵雅君,王伊林,陶谢鑫,等.阿霉素致心肌细胞凋亡时网腔钙结合蛋白的变化[J].临床心血管病杂志,2015,31(8):895-898.
[9] 王伊林,赵雅君,杨 洋,等.磷酸肌酸钠对慢病毒介导calumenin蛋白沉默阿霉素损伤心肌细胞内质网应激信号通路的作用[J].临床心血管病杂志,2015,31(10):1119-1122.
[10]YUMiao,He ZH,Xuan LY,et al.Effect of creatine phosphate sodium on miRNA378,miRNA378*and calumenin mRNA in adriamycin-injured cardiomyocytes[J].Chin JAppl Physiol,2016,32(6):514-518.
[11]景友玲,王艳蕾,王小君,等.黄芪对肠缺血/再灌注时脂质过氧化损伤的防护作用及其机制[J].中国应用生理学杂志,2009,25(2):242-243.
[12]梁 庆,李自成,邝素华,等.美托洛尔对心力衰竭大鼠心肌细胞磷酸化缝隙连接蛋白43表达及心肌细胞凋亡的影响[J].中国病理生理杂志,2013,29(8):1352-1357.
