右归丸对鼠膝骨性关节炎的治疗作用及W nt信号通路相关因子表达的影响*
2018-06-08颜春鲁李盛华安方玉刘永琦夏鹏飞马正民牛彦强柳鹏瑶
颜春鲁,李盛华,安方玉,刘永琦,夏鹏飞,马正民,牛彦强,柳鹏瑶
(1.甘肃中医药大学教学实验实训中心,2.微生物与免疫教研室,3.科研实验中心,4.中医临床学院,5.临床学院,6.甘肃省高校中藏药化学与质量研究省级重点实验室,兰州730000)
膝骨性关节炎(osteoarthritis of the knee,KOA)主要病理特征以膝关节软骨发生退变、软骨基质发生降解为主,继发滑膜炎症和骨质增生,引发关节疼痛、肿胀及功能障碍,严重影响患者的生存质量。预防和阻止膝关节软骨退变、降低软骨基质的降解是治疗KOA的关键之所在。一些研究表明,KOA的发病机制涉及到Wnt信号转导通路中的某些因子表达出现异常。Dickkopf同源物1(Dickkopf homolog 1,DKK1)、Wnt诱导分泌蛋白 1(Wnt induced secreted protein 1,WISP1)和低密度脂蛋白受体相关蛋白5(low density lipoprotein receptor related protein 5,LRP5)是 Wnt信号转导通路中的重要信号蛋白质[1-3]。发现膝骨性关节炎患者关节液中WISP1含量增加[2]。另外,WISP 1蛋白质过度表达可导致关节软骨的损伤[4]。姜旭等[5]研究也发现,在骨关节炎(osteoarthritis,OA)关节软骨中 WISP 1、Wnt和βcatenin基因mRNA及蛋白质水平明显增高。因此,调节Wnt/β-catenin信号通路及通路中相关蛋白质的表达可能是治疗KOA的新靶点,可为防治膝骨性关节炎提供新的思考。
右归丸出自《景岳全书》。方中附子、肉桂、鹿角胶培补肾中元阳,温里祛寒,为君药。熟地黄、山茱萸、枸杞子、山药滋阴益肾,养肝补脾,填精补髓,取“阴中求阳”之义,为臣药。再用菟丝子、杜仲补肝肾,强腰膝,配以当归养血和血,共补肝肾精血,为佐药。全方共凑具有温阳补肾、填精补髓之功效。研究发现[6,7],针刺、艾灸联合右归丸治疗膝关节骨性关节炎的有效率为90.2%,安络痛胶囊联合右归丸治疗阳虚寒凝型膝骨性关节炎疗效96.67%,但是右归丸治疗膝骨性关节炎的具体机制未明。本实验采用改良Hulth法复制膝骨关节炎大鼠模型,探讨Wnt/β-catenin信号通路在KOA发生、发展中的分子调控机理,明确其在退行性骨关节病变中的作用。进一步揭示右归丸对KOA的作用机制,为右归丸临床应用提供实验依据。
1 材料与方法
1.1 实验动物
SPF级 SD大鼠60只,体重(180±20)g,雌雄各半,由甘肃中医药大学科研实验中心提供。实验动物质量合格证编号:SYXK(甘)2015-0005。
1.2 药物与试剂
右归丸购自仲景宛西制药股份有限公司;硫酸氨基葡萄糖片购自新兴同仁药业有限公司;反转录试剂2×prime script RTmastermix和荧光定量SYBR PRemix EX TaqⅡ均购自宝生物;DKK1抗体、WISP1抗体、Wnt1抗体、LRP5抗体和β-catenin抗体均购自Abcam。
1.3 实验仪器
FA2004N型电子天平(上海精密科学仪器有限公司),ZY12306型微量加样器(ScienTiFic产品),DW-86L338型超低温冰箱(青岛海尔特种电器有限公司),Dynamic VELOCITY 18R台式高速冷冻离心机,ChemiDocTMXRS+型凝胶成像分析系统(美国Bio-Rad公司),PowerPac Basic型数显双稳定时电泳仪(美国 Bio-Rad公司),CFX96TM型 Real-time荧光定量PCR仪 (美国Bio-Rad),BioMate 3S型蛋白(核酸)浓度测定仪(Thermo),SK-1型快速混匀器(金坛市恒丰仪器厂)。
1.4 动物分组、造模及给药
60只SD大鼠雌雄各半,适应性饲养1周后,按体重随机分为6组(n=10):随机选取一组为假手术组,其余各组用改良Hulth法复制大鼠膝骨关节炎模型[8,9]。腹腔注射 10%水合氯醛(0.3ml/100 g)麻醉各组大鼠后,双侧膝关节手术区常规消毒,无菌条件下将双侧膝关节内侧纵向切开长约2 cm,逐层暴露关节腔,剔除膝前交叉韧带、内侧副韧带及内侧半月板,注意勿损伤关节软骨面。用洁净的5 ml注射器吸取生理盐水冲洗关节腔3~5次,行抽屉试验阳性后彻底止血,逐层缝合。将假手术组SD大鼠从膝关节内侧打开关节腔,不破坏韧带、半月板,保留关节软骨面。缝合伤口前均滴入少量的青霉素溶液,随后逐层缝合。术后连续3 d肌肉注射青霉素2×105U/d,各组大鼠均在相同条件下饲养,自由饮水、摄食。手术造模6周后,假手术组和模型组灌服蒸馏水;按人和动物的体表面积计算法计算药物用量。硫酸氨基葡萄糖组按0.17 g/kg灌服硫酸氨基葡萄糖。右归丸由熟地24 g、山药12 g、山茱萸9 g、枸杞子 9 g、鹿角胶12 g、菟丝子12 g、杜仲12 g、当归9 g、肉桂 6 g、制附子 6 g等组成,111 g×0.018×5~10 g/kg。常规水煎,制成浓度为生药1 g/ml的药液;右归丸高、中、低剂量组分别按(20 g/kg、10 g/kg、5 g/kg)灌服相应的药物,灌服体积为 2ml/200 g,干预8周。末次给药后无菌条件下分离膝关节,部分膝关节分装于含4%多聚甲醛的磨口瓶中,用于组织形态学观察;部分膝关节分装于冻存管中,于-80℃冰箱保存,用RT-PCR法和Western blot法检测关节软骨中mRNA和蛋白质的表达。
1.5 一般情况
观察大鼠的饮食、饮水、活动度、灵敏度、精神状态,膝关节的畸形、肿胀、活动情况,双下肢肢端血运及肌肉丰满程度。
1.6 关节软骨形态学变化的观察
膝关节软骨脱钙后,按照HE染色方法进行染色。光镜下观察膝关节软骨细胞的形态学变化并进行Mankin评分[10]。具体评分标准如下:0分,软骨结构光整如常,软骨细胞数量如常,基质染色正常,潮线比较完整;1分,软骨表面有不规则裂隙,软骨细胞数量弥漫性增多,基质染色减退,出现多重潮线;2分,软骨裂隙深达肌层,软骨细胞成簇生长,基质染色明显减退,软骨下血管浸入肌层;3分,软骨裂隙深达辐射层,软骨细胞数量明显减少,基质染色明显减退;4分,软骨裂隙深达钙化层,基质染色完全消失;5分,软骨层脱落。
1.7 DKK1、W ISP1、Wnt1、β-catenin和 LRP5 mRNA表达的测定
按Qiangen公司RNA提取试剂盒说明书提取软骨组织RNA,测其浓度和A260nm/A280nm比值后,42℃30min,85℃5min进行cDNA链的合成,95℃5min,95℃ 10 s,55℃ 20 s,75℃ 30 s,45个循环进行实时荧光定量PCR扩增反应。每样品重复3次,数据记录采用相对定量法,以 2-△△Ct表示样本中目的基因相对表达含量。其中 DKK1、WISP1、Wnt1、β-catenin、LRP5及β-actin等引物根据GenBank基因序列使用Oligo 6.0设计,由宝生物工程(大连)有限公司合成。引物序列如下:DKK1下游引物:5’-GAAGGTCTGGCTTGCAGGATA-3’,上游引物:5’-TCCATCGCATTTAGGCTGTTG-3’;WISP1下游引物:5’-CAGTCCTGATGGTGGGCAAC-3’,上 游 引 物:5’-ACACGGCCACTTGCAGAA-3’;Wnt1下游引物:5’-GCTGTGATGACGTGGGAAATA-3’,上游引物:5’-GAGGCATGGTTCACTGTTCA-3’;β-catenin下游引物:5’-GTCTGAGGACAAGCCACAGGACTAC-3’,上 游 引 物:5’-AATGTCCAGTCCGAGATCAGCA-3’;LRP5下游引物:5’-ACCATTGATTACGCCGACCAG-3’,上游引物:5’-ATCGCTATATTGAGTCAGGCCAAAG-3;β-actin下游引物:5’-TTGCTGATCCACATCTGCT-3’,上 游 引 物:GACAGGATGCAGAAGGAGAT。
1.8 DKK1、W ISP1、Wnt1、β-catenin和 LRP5蛋白质表达的测定
用RIPA裂解液提取软骨组织蛋白质,BCA法测定蛋白质含量,调整蛋白质浓度为30μg/10μl。每孔点样 15μl,作 SDS-PAGE、转膜、封闭、滴加抗DKK1、WISP1、Wnt1、β-catenin和 LRP5等一抗孵育,用山羊抗兔IgG二抗孵育。采用ECL Plus超敏发光液染色观察,将溶液 A和 B等体积混匀后,按约0.125ml/cm2膜面积进行染色,室温反应1min后置于Image Lab 3.0进行曝光,曝光条件为:单个曝光时间10 s,总曝光时间60 s。
1.9 数据的统计与处理
采用SPSS 17.0统计软件进行处理,实验数据用均数±标准差()表示,多组间比较采用单因素方差分析(One-Way-Anova)。
2 结果
2.1 动物一般情况观察
实验期间未出现动物死亡现象。实验期间假手术组大鼠饮食、饮水、活动如常,反应比较灵敏,精神状态良好;膝关节未出现畸形、肿胀,活动良好,双下肢端血运正常,肌肉未发生萎缩。模型组大鼠饮食、饮水、活动情况较模型组好、灵敏度及精神状态均明显变差,膝关节出现内翻畸形、肿胀,双下肢端血运变差,肌肉发生萎缩。右归丸各干预组及硫酸氨基葡萄糖组大鼠饮食、饮水、活动情况较模型组好,灵敏度及精神状态也有所好转,膝关节肿胀程度、肌肉萎缩程度均较模型组显著改善,肢端血运明显恢复。
2.2 右归丸对关节软骨形态结构的影响
HE染色结果显示,假手术组大鼠关节面完整、光滑,滑膜完整,软骨细胞排列整齐,呈水平排列;软骨周围细胞较小,扁平形,排列密集,其长轴平行于软骨表面;中心细胞较大呈圆形或椭圆形,同源细胞群排列。模型组大鼠关节面破损严重,软骨组织大量脱落,软骨细胞正常排列改变,排列紊乱,有簇聚现象,细胞数目增多,空泡变大。各干预组大鼠软骨细胞排列紊乱,由平行排列变为纵行排列,细胞数目增多。其中,右归丸高剂量组和硫酸氨基葡萄糖组大鼠软骨细胞排列整齐,分布均匀,钙化层软骨细胞轻度成簇,潮线尚完整。Mankin评分结果显示:与假手术组比较,模型组及各干预组大鼠Mankin评分均明显升高(P<0.05);与模型组比较,右归丸高剂量组和硫酸氨基葡萄糖组大鼠Mankin评分均明显降低(P<0.05);与硫酸氨基葡萄糖组比较,右归丸低、中剂量组大鼠 Mankin评分均明显升高(P<0.05,图 1,表 1)。
Tab.1 Mankin scores ofmorphology structure of articular cartilage in each group(,n=10)

Tab.1 Mankin scores ofmorphology structure of articular cartilage in each group(,n=10)
*P<0.05 vs sham group;#P<0.05 vs model group;△P<0.05 vs glucosamine sulfate group
Group Mankin scores Sham 0.20±0.089 Model 4.55±0.599*Glucosamine sulfate 2.55±0.896*#Youguipill low-dose 3.91±0.553*△Youguipillmiddle-dose 3.82±0.579*△Youguipill high-dose 2.88±0.680*#
2.3 右归丸对软骨组织 DKK1、W ISP1、Wnt1、βcatenin和LRP5 mRNA表达的影响
与假手术组比较,模型组和各干预组大鼠软骨组织 WISP1、Wnt1、β-catenin和 LRP5 mRNA表达增高,模型组和右归丸低剂量组DKK1 mRNA表达降低(P<0.05)。与模型组比较,右归丸高剂量组和硫酸氨基葡萄糖组大鼠 WISP1、Wnt1、β-catenin和LRP5mRNA表达降低,DKK1 mRNA表达升高(P<0.05)。与硫酸氨基葡萄糖组比较,右归丸低、中剂量WISP1、Wnt1、β-catenin和 LRP5 mRNA表达增高,DKK1mRNA表达降低(P<0.05,表 2、表 3)。
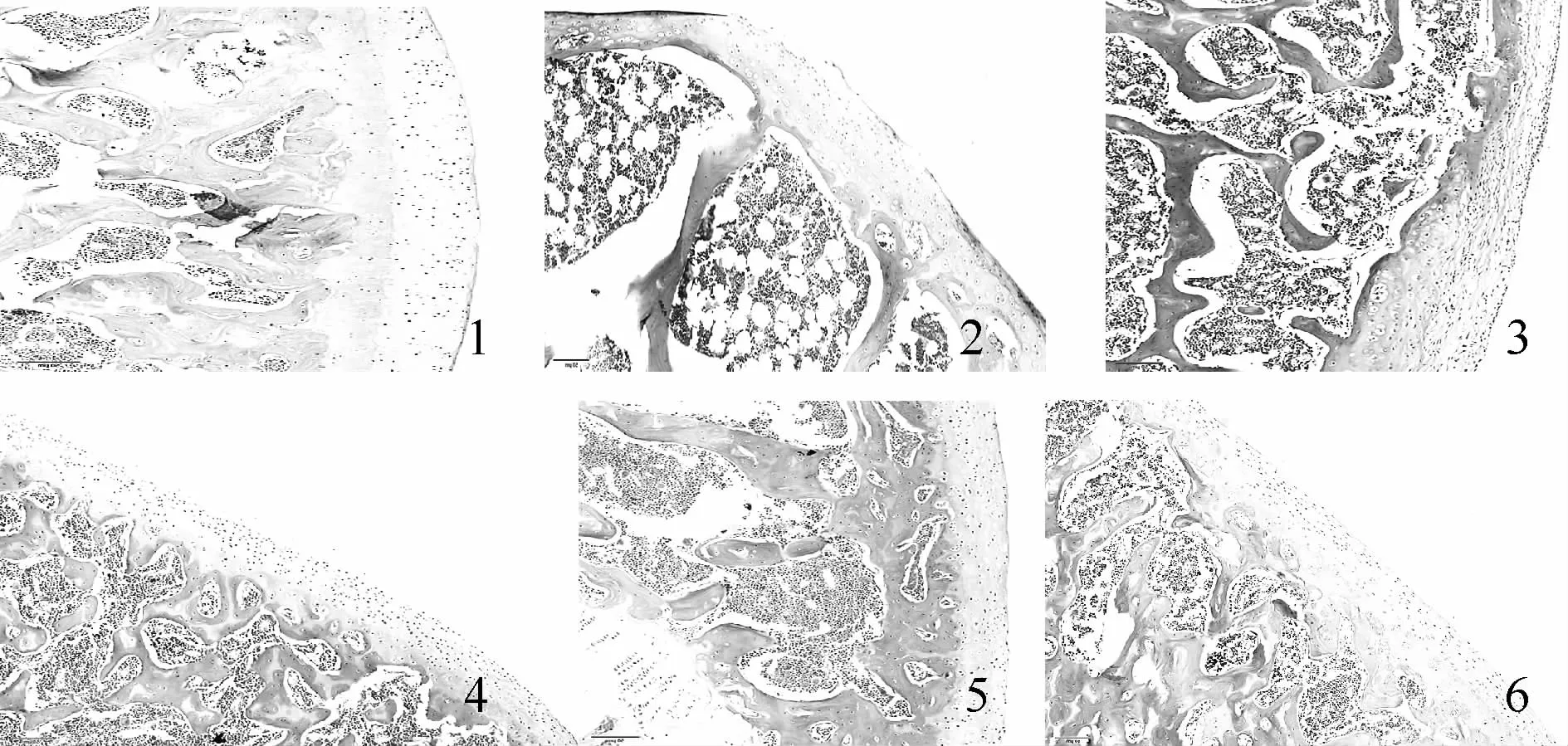
Fig.1 Pathological changes of articular cartilage in knee joints(HE×200)
Tab.2 Effects of Youguipill on expressions of DKK1、W1SP1 and Wnt1mRNA in cartilage tissue(,n=10)
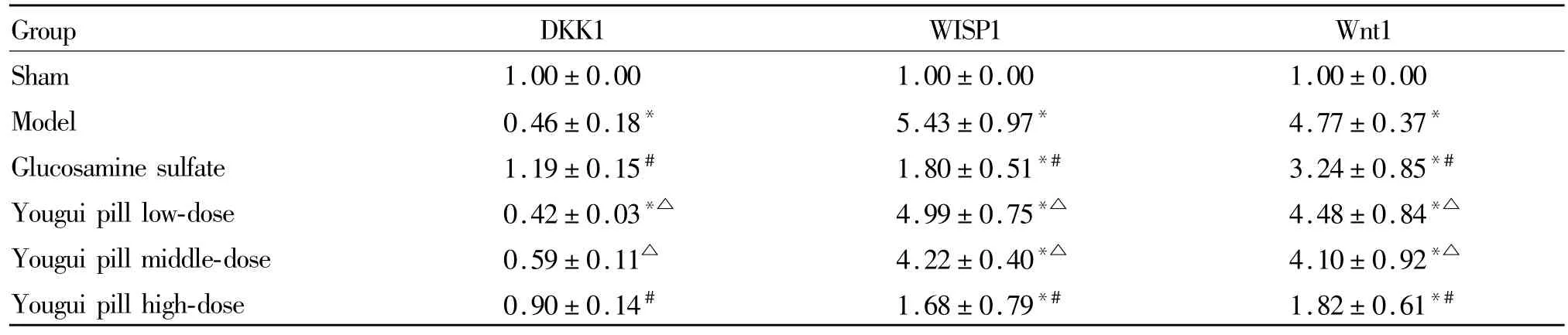
Tab.2 Effects of Youguipill on expressions of DKK1、W1SP1 and Wnt1mRNA in cartilage tissue(,n=10)
*P<0.05 vs sham group;#P<0.05 vs model group;△P<0.05 vs glucosamine sulfate group
Group DKK1 WISP1 Wnt1 Sham 1.00±0.00 1.00±0.00 1.00±0.00 Model 0.46±0.18* 5.43±0.97* 4.77±0.37*Glucosamine sulfate 1.19±0.15# 1.80±0.51*# 3.24±0.85*#Youguipill low-dose 0.42±0.03*△ 4.99±0.75*△ 4.48±0.84*△Youguipillmiddle-dose 0.59±0.11△ 4.22±0.40*△ 4.10±0.92*△Youguipill high-dose 0.90±0.14# 1.68±0.79*# 1.82±0.61*#
Tab.3 Effects of Yougui pill on expressions ofβ-catenin、LRP5 mRNA in cartilage tissue(,n=10)

Tab.3 Effects of Yougui pill on expressions ofβ-catenin、LRP5 mRNA in cartilage tissue(,n=10)
*P<0.05 vs sham group;#P<0.05 vs model group;△P<0.05 vs glucosamine sulfate group
Group β-catenin LRP5 Sham 1.00±0.00 1.00±0.00 Model 3.53±0.99* 4.34±0.89*Glucosamine sulfate 2.19±0.69*# 2.72±0.96*#Youguipill low-dose 3.41±0.19*△ 4.29±0.64*△Youguipillmiddle-dose 3.33±0.75*△ 3.49±0.34*△Youguipill high-dose 2.08±0.85*# 2.14±1.11*#
2.4 右归丸对软骨组织 DKK1、W ISP1、Wnt1、βcatenin和LRP5蛋白质表达的影响
与假手术组比较,模型组、右归丸低、中剂量组大鼠软骨组织 WISP1、Wnt1、β-catenin和 LRP5蛋白质表达增高,DKK1蛋白质表达降低(P<0.05);与模型组比较,右归丸高剂量组和硫酸氨基葡萄糖组大鼠 WISP1、Wnt1、β-catenin和 LRP5蛋白质表达降低,DKK1蛋白质表达升高(P<0.05);与硫酸氨基葡萄糖组比较,右归丸低、中剂量组WISP1、Wnt1、βcatenin和LRP5蛋白质表达增高,DKK1蛋白质表达降低(P<0.05,表 4、表 5,图 2-6)。
Tab.4 Effects of Yougui pill on protein expressions of DKK1,WISP1 and Wnt1 in cartilage tissue(,n=10)
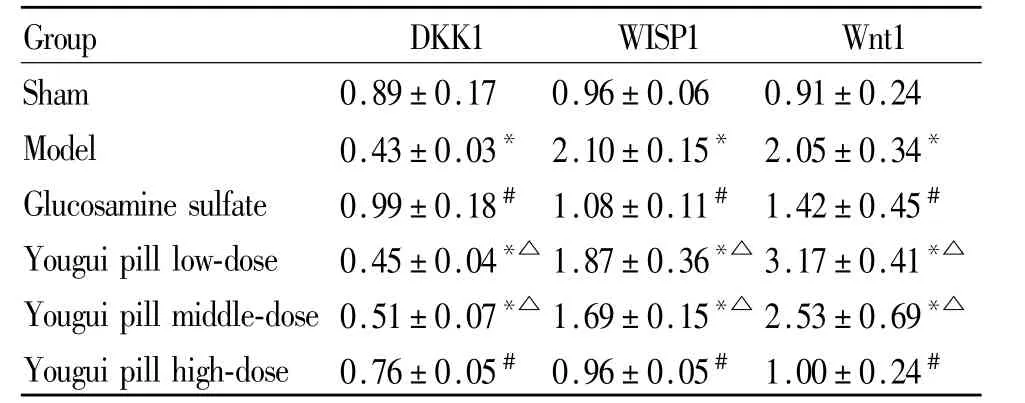
Tab.4 Effects of Yougui pill on protein expressions of DKK1,WISP1 and Wnt1 in cartilage tissue(,n=10)
*P<0.05 vs sham group;#P<0.05 vs model group;△P<0.05 vs glucosamine sulfate group
Group DKK1 WISP1 Wnt1 Sham 0.89±0.17 0.96±0.06 0.91±0.24 Model 0.43±0.03*2.10±0.15*2.05±0.34*Glucosamine sulfate 0.99±0.18# 1.08±0.11# 1.42±0.45#Youguipill low-dose 0.45±0.04*△ 1.87±0.36*△ 3.17±0.41*△Youguipillmiddle-dose 0.51±0.07*△ 1.69±0.15*△ 2.53±0.69*△Youguipill high-dose 0.76±0.05# 0.96±0.05# 1.00±0.24#
Tab.5 Effects of Yougui pill on protein expressions ofβ-catenin and LRP5 in cartilage tissue(,n=10)

Tab.5 Effects of Yougui pill on protein expressions ofβ-catenin and LRP5 in cartilage tissue(,n=10)
*P<0.05 vs sham group;#P<0.05 vs model group;△P<0.05 vs glucosamine sulfate group
Group β-catenin LRP5 Sham 0.78±0.11 1.00±0.24 Model 1.57±0.15* 3.49±0.21*Glucosamine sulfate 0.78±0.07# 1.00±0.04#Youguipill low-dose 1.19±0.44*△ 2.60±0.64*△Youguipillmiddle-dose 1.28±0.49*△ 1.89±0.22*△Youguipill high-dose 0.71±0.11# 0.79±0.04#

Fig.2 Effects of Youguipill on DKK1 protein expression in cartilage tissue

Fig.3 Effectsof YouguipillonWISP1 protein expression in cartilage tissue
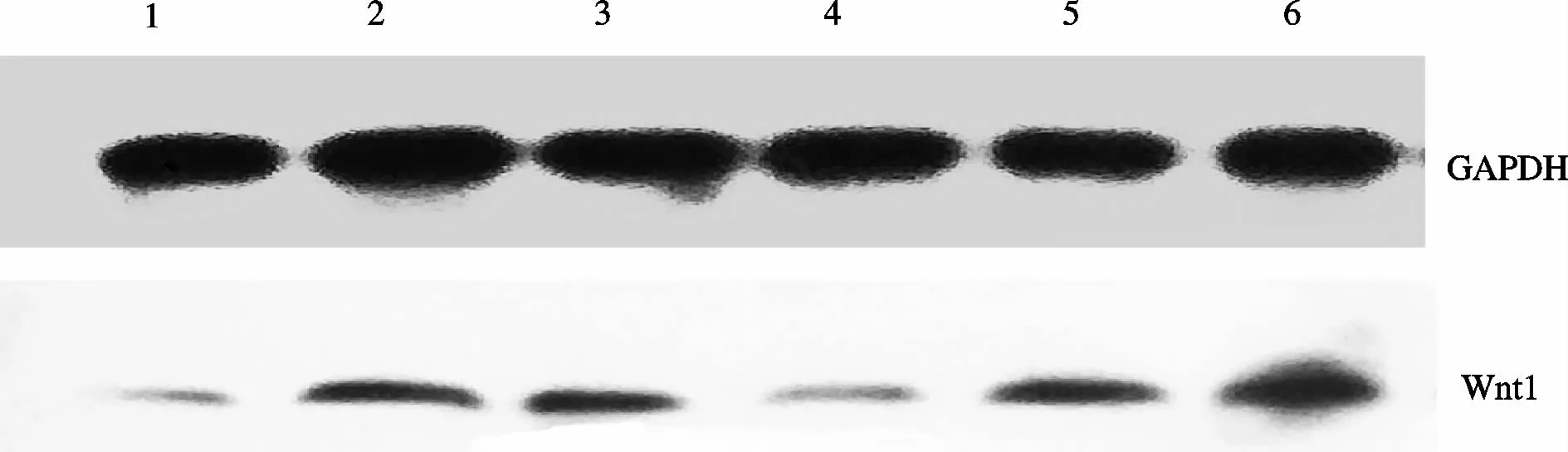
Fig.4 Effects of Yougui pill onWnt1 protein expression in cartilage tissue

Fig.5 Effectof Youguipillonβ-catenin protein expression in cartilage tissue
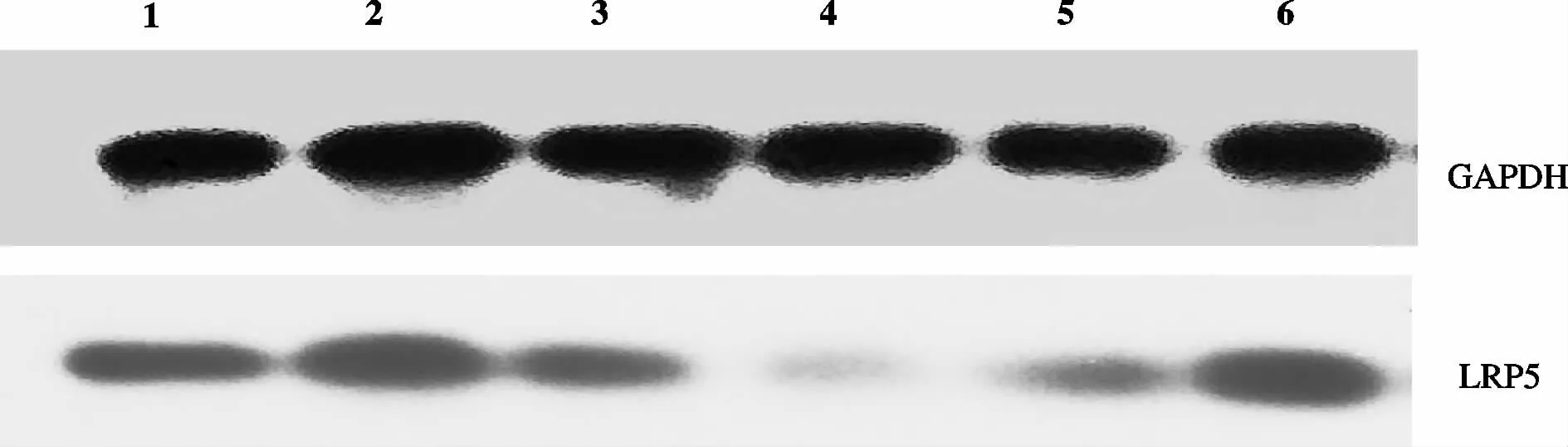
Fig.6 Effects of Yougui pill on LRP5 protein expression in cartilage tissue
3 讨论
近年研究发现,经典Wnt信号通路与胚胎软骨发育,出生后软骨发生、成骨细胞和破骨细胞生成、软骨内成骨、骨重塑、骨折修复等密切相关,成为治疗KOA的潜在靶点[11]。本研究发现,KOA模型组大鼠软骨组织DKK1 mRNA和蛋白质表达降低,WISP1、Wnt1、β-catenin和 LRP5 mRNA和蛋白质表达增高,与以往的研究一致[12-16]。由此推测 Wnt/βcatenin信号通路被异常激活参与了KOA发生、发展,是导致KOA软骨破坏、滑膜损伤的主要原因。大剂量右归丸干预后,能够有效地促进KOA模型组大鼠DKK1mRNA和蛋白表达,有效地抑制WISP1、Wnt1、β-catenin和 LRP5 mRNA和蛋白质表达。推测,右归丸可能是通过抑制经典Wnt/β-catenin信号通路来达到治疗KOA的目的。
另外,本实验病理形态学及Mankins评分结果显示,模型组大鼠软骨组织大量脱落,软骨细胞数目增多,空泡变大,排列紊乱,出现簇聚现象,而右归丸高剂量组大鼠软骨细胞排列整齐,分布均匀,钙化层软骨细胞轻度成簇,潮线尚完整。模型组大鼠Mankin评分显著高于假手术组,这与周颖燕等人的研究一致[17]。模型组及各干预组大鼠Mankin评分均高于假手术组,硫酸氨基萄葡糖组与右归丸高剂量组大鼠Markin评分均低于模型组(P<0.05),提示硫酸氨基萄葡糖与高剂量右归丸治疗膝骨性关节炎有效。
总之,高剂量右归丸能较好地减轻KOA的关节软骨病变,其具体的机制可能是通过抑制经典Wnt/β-catenin信号通路中的 WISP1、Wnt1、β-catenin和LRP5关键因子来实现的。
[1] 李 波,姜 泉,巩 勋,等.清热活血方药对 CIA大鼠 Wnt信号通路成骨细胞相关因子的影响[J].中国中医基础医学杂志,2017,23(1):75-77.
[2] 董 宁,宫宇宝,杨 晨,等.探讨膝骨性关节炎患者关节液中WISP-1的表达水平[J].中国标准卫生管理,2016,11(9):1233-1237.
[3] 周明旺,李盛华,陈 娴,等.膝骨性关节炎患者低密度脂蛋白受体相关蛋白5基因与中医体质相关性研究[J].西部中医药,2016,29(10):5-7.
[4] Blom AB,Brockbank SM,van Lent PL,et al.Involvement of theWnt signaling pathway in experimental and human osteoarthritis:prominent role ofWnt-induced signaling protein 1[J].Arthritis Rheum,2009,60(2):501-512.
[5] 姜 旭,吴成爱,王 莹,等.膝关节骨性关节炎中WISP-1调控机制的研究[J].中国骨质疏松杂志,2015,21(5):537-540.
[6] 王新革.针刺、艾灸联合右归丸治疗膝关节骨性关节炎 102例[J].中医研究,2014,27(8):62-63.
[7] 吴 嵩,廖佑荣,吴和平.安络痛胶囊联合右归丸治疗阳虚寒凝型膝骨性关节炎疗效观察[J].药物流行病学杂志,2016,25(6):342-346.
[8] De Souza RA,Xavier M,Mangueira NM,et al.Raman spectroscopy detection of molecular changes associated with two experimentalmodels of osteoarthritis in rats[J].Lasers Med Sci,2014,29(2):797-804.
[9] Seo BK,Park DS,Baek YH.The analgesic effect of electroacupuncture on inflammatory pain in the ratmodelof collagenase-induced arthritis:mediation by opioidergic receptors[J].Rheumatol Int,2013,33(5):1177-1183.
[10]李登晓,徐 璇,朱 洁,等.滑膜炎胶囊对兔膝骨性关节炎组织病理学及 NO、SOD、COMP等的影响[J].上海中医杂志,2014,48(4):86-90.
[11]Hoeppner LH,Secreto FJ,Westendorf JJ.Wntsignaling as a therapeutic target for bone disease[J].ExpertOpin Ther Targets,2009,13(4):485-496.
[12]Cawthorn WP,Bree AJ,Yao Y,et al.Wnt6,Wnt10a and Wnt10b inhibit adipogenesis and stimulate osteoblastogenesis through aβ-catenin-dependentmechanism[J].Bone,2012,50(2):477-489.
[13]Blom AB,Brockbank SM,van Lent PL,et al.Involvement of theWnt signaling pathway in experimental and human osteoarthritis:prominent role ofWnt-induced signaling protein 1[J].Arthritis Rheum,2009,60(2):501-512.
[14] Lara-Castillo N,Johnson ML.LRP receptor family member associated bone disease[J].Rev Endocr Metab Disord,2015,16(2):141-148.
[15] Qiu W,Chen L,Kassem M.Activation of non-canonical Wnt/JNK pathway byWnt3a is associated with differentiation fate determination of human bonemarrow stromal(mesenchymal)stem cells[J].Biochem Biophys Res Commun,2011,413(1):98-104.
[16]Cao Z,Liu R,Zhang H,etal.Osterix controls cementoblast differentiation through downregulation of Wnt-signaling via enhancing DKK1 expression[J].Int J Biol Sci,2015,11(3):335-344.
[17]周颖燕,徐侦雄,林洁华,等.熟地寄生壮骨方对膝骨关节炎模型大鼠关节软骨形态的影响[J].广州中医药大学学报,2015,32(4):711-714.
