紫茎泽兰水浸提液对不同基因型水稻种子萌发及幼苗生长的影响
2018-06-08,,,,,,,,
, , , , , , , ,
(1.四川省内江市农业科学院, 四川 内江 641000;2.西南科技大学 生命科学与工程学院, 四川 绵阳 621010;3.内江市种子管理站, 四川 内江 641000)
紫茎泽兰(Eupatoriumadenophorum)隶属于菊科(Compositae)泽兰属(EupatoriumL.)多年丛生型半灌木草本植物;原产于美洲的墨西哥、哥斯达黎加一带,是一种世界性入侵有毒杂草;现广泛分布于新西兰、新加坡、缅甸、中国等热带、亚热带30多个国家和地区[1-2]。20世纪40年代,该植物由中缅边境侵入我国的云南境内[3]。经过几十年的迅速扩散,现已波及云贵、川渝、两广、两湖、山西、西藏、海南、台湾、福建以及浙江等省,并呈现出由热带、亚热带地区向高海拔的寒冷地区和干旱地区蔓延的趋势[4-5]。
植物的化感作用是指植物通过地上部分茎叶挥发、茎叶淋溶、残体分解和根系分泌等途径向环境中释放化学物质,从而对四周的植物、动物以及微生物产生直接和间接的抑制或促进作用[6]。化感作用广泛存在于自然界中,不仅可促进优势种的形成和群落的演替,而且在生态系统自然调控方面起着重要的作用[7-8]。种子萌发是植物生活史的重要阶段,化感物质通过抑制或促进种子萌发,从而影响种群的建立和更新。研究表明,紫茎泽兰具有较强的化感作用[9-11]。目前,关于紫茎泽兰对水稻种子萌发和幼苗生长化感作用的报道较少。因此,本研究以不同浓度的紫茎泽兰地上部分水浸提液处理不同基因型的水稻,研究其对水稻种子萌发和幼苗生长的影响,旨在揭示紫茎泽兰对水稻的化感作用,为解决入侵地域的水稻日常生产提供参考。
1 材料与方法
1.1 材 料
紫茎泽兰的地上部分于2017年10月采于乐山犍为岷江附近的水稻田周边;供试的水稻品种为内5优306(审定号:川审2012001)、内5优39(审定号:国审2011009)、内7优39(审定号:国审2014015)。试验选取籽粒饱满、大小一致的种子为试材,于2017年11月在内江杂交水稻科技开发中心进行。
1.2 方 法
1.2.1 紫茎泽兰水浸提液的制备
用蒸馏水将刚采集的紫茎泽兰新鲜叶片清洗2~3次,并置于室内自然晾干;将处理好的叶片放入研钵中研磨,注入一定量的蒸馏水,搅匀并室温下振荡浸提48 h;用3层纱布过滤,并稀释成质量百分比为0.25%、1.00%、2.5%等3个不同浓度以备用。
1.2.2 发芽试验
每个基因型的水稻发芽试验为1个对照(蒸馏水),3个试验(0.25%、1.00%、2.5%的紫茎泽兰地上部分水浸提液),共4个处理。每个处理3个重复,每个重复50粒种子。试验采用双层滤纸培养皿法,即在铺有2层滤纸的培养皿中放入选好的水稻种子,加入10 mL不同浓度的紫茎泽兰地上部分水浸提液(以蒸馏水为对照),置于25 ℃的恒温光照培养箱中进行培养。试验的光照周期以12 h(光)/12 h(暗)依次交替,光照强度为2 000 lx。
1.2.3 指标测定
每间隔12 h观察统计水稻种子的萌发数,第3天计算种子的发芽势,第7天计算发芽率、发芽指数等指标[12-13]。同时,每个处理随机选取10株幼苗,测量其根长、芽长、鲜重,并用茚三酮法、硫代巴比妥酸比色法测定脯氨酸、丙二醛等生理指标。
1.2.4 数据的统计与分析
试验数据采用Microsoft Excel 2007软件和SPSS软件进行统计、处理、分析。
2 结果与分析
2.1 紫茎泽兰水浸提液对水稻种子萌发特性的影响
不同浓度的紫茎泽兰地上部分水浸提液均可抑制3个不同基因型的水稻种子萌发。随着处理浓度的提高,与对照组相比,3种水稻的萌发率均呈显著下降的趋势。浓度为0.25%时,内5优306、内5优39、内7优39的种子萌发率分别为84.00%、81.00%、82.00%,较对照下降了11.00%、11.33%、8.33%;浓度为1.00%时,内5优306、内5优39、内7优39的种子萌发率分别为50.33%、48.00%、49.33%,较对照下降了44.67%、44.33%、41.00%;浓度为2.50%时,内5优306、内5优39、内7优39的种子萌发率分别为18.00%、21.67%、25.00%,较对照下降了77.00%、70.67%、65.33%。通过表1可以发现,随着处理液浓度的提高,内5优306的种子萌发受抑制最强,而内7优39则相对较小;当浓度为2.50%时,内5优306的种子萌发率下降比内7优39的多近12个百分点。
进一步分析表明,随着紫茎泽兰地上部分水浸提液浓度的提高,3种水稻种子的发芽率、发芽势、发芽指数均较对照显著下降,而且内5优306对紫茎泽兰的抑制最为敏感,内7优39耐性相对较强。说明不同基因型水稻对外界的耐受程度或抗逆性有一定的差异。
表1 紫茎泽兰水浸提液对水稻种子萌发特性的影响
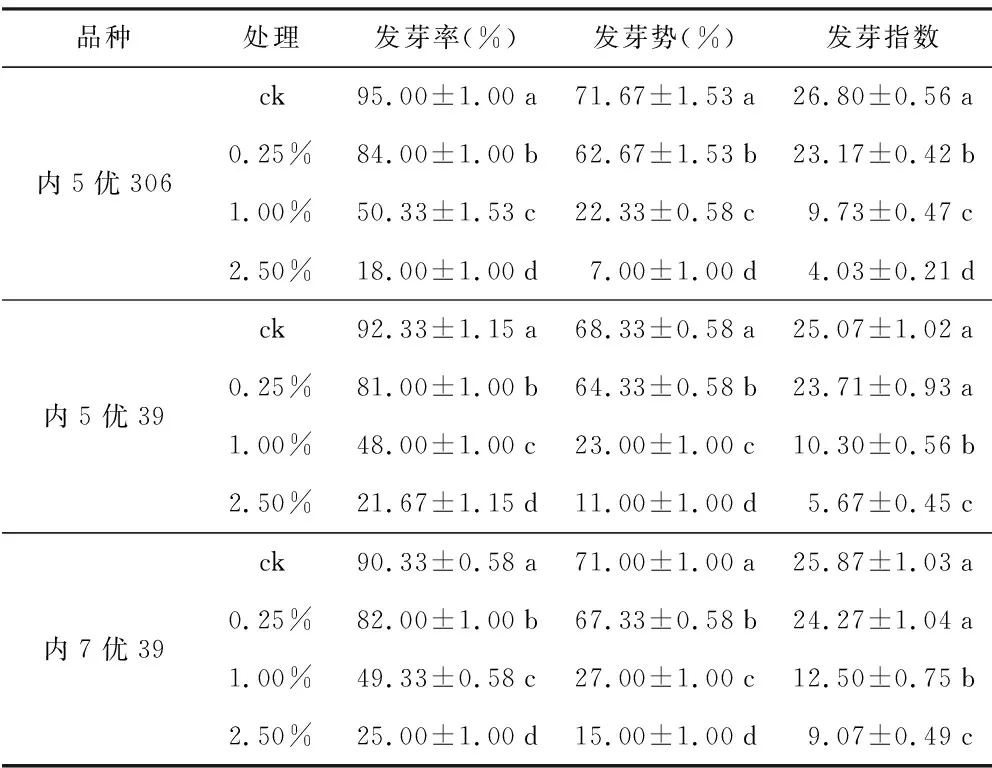
品种处理发芽率(%)发芽势(%)发芽指数内5优306ck95.00±1.00a71.67±1.53a26.80±0.56a0.25%84.00±1.00b62.67±1.53b23.17±0.42b1.00%50.33±1.53c22.33±0.58c9.73±0.47c2.50%18.00±1.00d7.00±1.00d4.03±0.21d内5优39ck92.33±1.15a68.33±0.58a25.07±1.02a0.25%81.00±1.00b64.33±0.58b23.71±0.93a1.00%48.00±1.00c23.00±1.00c10.30±0.56b2.50%21.67±1.15d11.00±1.00d5.67±0.45c内7优39ck90.33±0.58a71.00±1.00a25.87±1.03a0.25%82.00±1.00b67.33±0.58b24.27±1.04a1.00%49.33±0.58c27.00±1.00c12.50±0.75b2.50%25.00±1.00d15.00±1.00d9.07±0.49c
2.2 紫茎泽兰水浸提液对水稻幼苗生长的影响
紫茎泽兰地上部分的水浸提取液对3种水稻幼苗根长、芽长、鲜重的抑制程度随着浓度的增加而增大。随着处理浓度的增加,相应的指标均显著低于对照组(表2)。浓度为0.00%时(ck),内5优306幼苗的芽长、根长和鲜重分别为4.40 cm、5.63 cm和30.33 mg,内5优39幼苗的芽长、根长和鲜重分别为3.50 cm、4.73 cm和28.07 mg,内7优39幼苗的芽长、根长和鲜重分别为3.50 cm、5.33 cm和29.57 mg。说明ck条件下,内5优306的整体表现明显强于另外2个基因型。
随着处理液浓度的增加,3种水稻受抑制的程度依次为内5优306>内5优39>内7优39。当浓度为2.50%时,内5优306幼苗的芽长、根长和鲜重分别为1.07 cm、1.70 cm、8.73 mg,分别下降了75.68%、69.80%、71.22%;内5优39幼苗的芽长、根长和鲜重分别为1.40 cm、1.80 cm、10.57 mg,分别下降了60.00%、61.95%、62.34%;内7优39幼苗的芽长、根长和鲜重分别为1.47 cm、2.13 cm、11.9 mg,分别下降58.00%、60.04%、59.52%。3种水稻在2.5%处理液作用下,幼苗的芽长、根长和鲜重的绝对值大小为内7优39>内5优39>内5优306;而与对照组相比,内5优306的芽长、根长和鲜重都比内7优39分别多下降近17、10、12个百分点。说明内7优39的抗逆性相对较强。
2.3 紫茎泽兰水浸提液对水稻幼苗丙二醛和脯氨酸含量的影响
丙二醛是脂质过氧化的主要产物。它可以破坏细胞的膜系统,增加各种膜的通透性,其含量可间接表示细胞膜受损伤的程度。研究表明,随着紫茎泽兰地上部分水浸提液浓度的升高,3种不同基因型水稻幼苗的丙二醛含量逐渐升高。浓度为0.25%、1.00%、2.50%时,内5优306丙二醛的含量分别为21.18,25.55,31.52μmol/g,均显著高于ck的8.21μmol/g;内5优39的分别为22.46,26.20,31.29μmol/g,而内7优39的则为20.96,25.58,28.53μmol/g,均显著高于对照组。这表明紫茎泽兰地上部分的化感作用强,可促进丙二醛的积累,导致水稻幼苗的膜质过氧化,破坏细胞的膜系统。而脯氨酸含量则随着处理液浓度的上升呈先上升后下降的趋势。当处理液的浓度为1.00%时,3种不同基因型水稻的脯氨酸含量与对照组无显著差异;为2.50%时,供试材料的脯氨酸含量均较对照组显著降低。
表2 紫茎泽兰水浸提液对水稻幼苗生长的影响
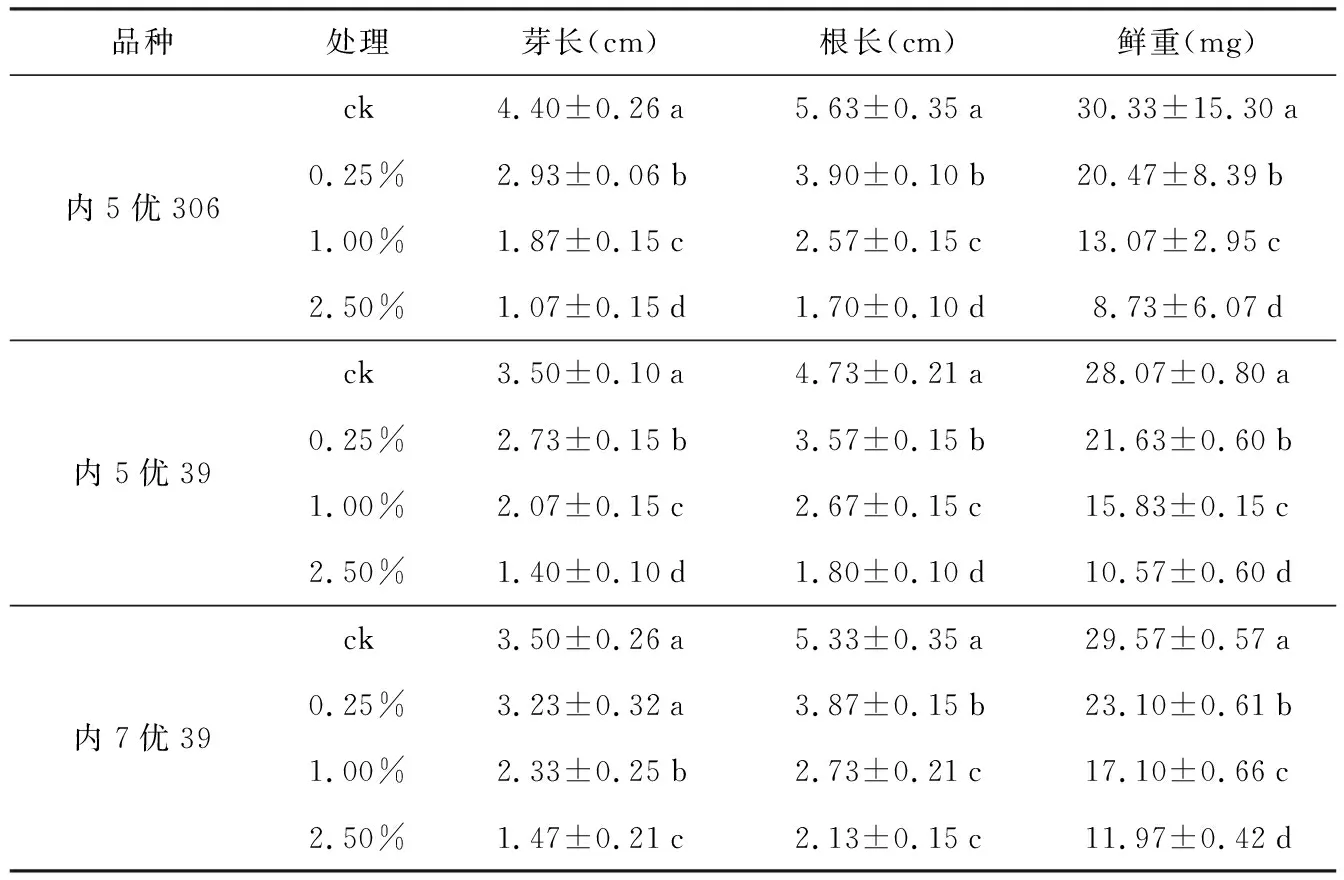
品种处理芽长(cm)根长(cm)鲜重(mg)内5优306ck4.40±0.26a5.63±0.35a30.33±15.30a0.25%2.93±0.06b3.90±0.10b20.47±8.39b1.00%1.87±0.15c2.57±0.15c13.07±2.95c2.50%1.07±0.15d1.70±0.10d8.73±6.07d内5优39ck3.50±0.10a4.73±0.21a28.07±0.80a0.25%2.73±0.15b3.57±0.15b21.63±0.60b1.00%2.07±0.15c2.67±0.15c15.83±0.15c2.50%1.40±0.10d1.80±0.10d10.57±0.60d内7优39ck3.50±0.26a5.33±0.35a29.57±0.57a0.25%3.23±0.32a3.87±0.15b23.10±0.61b1.00%2.33±0.25b2.73±0.21c17.10±0.66c2.50%1.47±0.21c2.13±0.15c11.97±0.42d
表3 紫茎泽兰水浸提液对水稻幼苗丙二醛和脯氨酸含量的影响

处理 内5优306 内5优39 内7优39 丙二醛(μmol/g)脯氨酸(μg/g)丙二醛(μmol/g)脯氨酸(μg/g)丙二醛(μmol/g)脯氨酸(μg/g)ck18.21±0.27d34.17±0.76b18.53±0.50d35.50±0.50b18.40±0.53d33.93±1.25b0.25%21.18±1.04c37.97±0.95a22.46±0.61c38.57±0.51a20.96±0.44c37.23±1.17a1.00%25.55±0.51b34.87±0.81b26.20±1.06b35.83±0.47b25.58±0.62b33.23±1.27b2.50%31.52±0.50a30.37±0.71c31.29±0.62a31.77±0.70c28.53±1.25a29.03±0.75c
3 讨 论
入侵植物大多可以向环境中释放化感物质,从而达到抑制周围物种生长,促进自身对周围环境资源和空间的占有,进而形成优势种之目的。紫茎泽兰作为一种外来入侵植物,因其是多克隆植物而在遗传背景上具有丰富的基因型,而不同的基因型可强化紫茎泽兰入侵后对环境的适应能力,最后降低植物体被淘汰的几率,增加其可入侵性和生态适应性[14-15]。该植物入侵不仅影响当地物种多样性,还对生态系统造成不可逆转的破坏,最终间接危害农业、畜牧业的发展[14]。紫茎泽兰通过释放可抑制植物种子萌发和幼苗生长的萜类物质,抑制周围的物种生长[9]。
本研究结果表明,随着紫茎泽兰地上部分水浸提液浓度的增加,供试的3种不同基因型水稻种子的发芽率、发芽势、发芽指数等萌发特性指标均显著下降。这和其他学者的研究结果相一致[9-11,13],说明紫茎泽兰对其他植物具有较强的化感作用。刘晓燕研究了紫茎泽兰对多花黑麦草、紫苜蓿等牧草生长的影响,结果发现,4种牧草的出苗率、株高和鲜重均无显著性差异,籍此认为化感可能不是成功入侵的主要原因,而竞争才可能是该植物可以肆无忌惮蔓延的根源[16];王亚麒等比较了新鲜和腐熟紫茎泽兰的浸提液对牧草种子萌发和幼苗生长的影响,结果表明,新鲜的浸提液可抑制其种子发芽和幼苗生长,而腐熟后的浸提液可以刺激牧草种子发芽,促进幼苗生长[11]。而本研究结果发现,3种不同基因型水稻的幼苗生长也受到明显抑制,芽长、根长、鲜重均与处理液的浓度呈反比关系。这与刘晓燕[16]、王亚麒等[11]的研究结果有所出入,但却与李渊博等[17]、曹子林等[9-10]的研究结果相类似。同时,郑丽等研究紫茎泽兰浸提液对草本植物幼苗生长的影响发现,幼苗植株的丙二醛含量明显增加[18];徐成东等[19]探讨紫茎泽兰叶水提液对玉米幼苗生长的影响时,也得出同样的结论;而本研究结果表明,3种不同基因型水稻幼苗的丙二醛含量也随着处理液浓度的升高而增加,与郑丽等[18]、徐成东等[19]的结论一致。说明丙二醛含量可能是衡量紫茎泽兰化感作用的敏感指标之一。此外,脯氨酸的含量呈现先上升后下降的趋势,胡凯茜等[20]的研究也支持这一结果。综上表明,紫茎泽兰地上部分水浸提液对不同基因型的水稻种子萌发和幼苗的生长均产生显著的抑制,但不同基因型对之敏感度不同。
参考文献:
[1]Wan F H,Liu W X,Guo J Y,et al.Invasive mechanism and control strategy of Ageratina adenophora (Sprengel)[J].Science China Life Sciences,2010,53(11):1 291-1 298.
[2]于文清,刘万学,桂富荣,等.外来植物紫茎泽兰入侵对土壤理化性质及丛枝菌根真菌(AMF)群落的影响[J].生态学报,2012,32(22):7 027-7 034.
[3]Xie Y,Li Z Y,Gregg WP,et al.Invasive species in China-an overview[J].Biodivers Conser,2001,10:1 317-1 341.
[4]万方浩,刘万学,郭建英.外来植物紫茎泽兰的入侵机理与控制策略研究进展[J].中国科学(生命科学),2011(1):13-21.
[5]Qu Y,Xiao Z,Zhou G.Mapping the distribution of Crofton weed (Eupatorium adenophorum spreng) in southwest of China using time series remote sensing data[J].Geoscience & Remote Sensing Symposium,2011:660-663.
[6]王大力.豚草属植物的化感作用研究综述[J].生态学杂志,1995,14(4):48-53.
[7]周伟佳,吴颖胤,郑思思,等.黑荆(Acaciamearnsii)对几种林下植物种子萌发的化感作用[J].植物研究,2011,31(2):235-240.
[8]谷文祥,段舜山,张弛,等.萜类化合物的生态特征及对植物的化感作用[J].华南农业大学学报,1998,19(4):108-112.
[9]曹子林,王乙媛,王晓丽,等.紫茎泽兰对杉木种子萌发及幼苗生长的化感作用[J].种子,2017,36(7):32-36.
[10]曹子林,王乙媛,王晓丽,等.紫茎泽兰对蓝桉种子萌发及苗生长的化感作用[J].种子,2017,36(11):38-43.
[11]王亚麒,焦玉洁,陈丹梅,等.紫茎泽兰浸提液对牧草种子发芽和幼苗生长的影响[J].草业学报,2016,25(2):150-159.
[12]徐芬芬,颜有娟,郭定生,等.PEG浸种对水稻种子萌发和幼苗生长及其耐冷性的影响[J].杂交水稻.https://doi.org/10.16267/j.cnki.1005-3956.20170515.107.
[13]赵高卷,马焕成,胡世俊,等.紫茎泽兰对木棉种子萌发和幼苗光合特性的影响[J].应用与环境生物学报,2014,20(4):683-689.
[14]李霞霞,张钦弟,朱珣之.近十年入侵植物紫茎泽兰研究进展[J].草业科学,2017,34(2):283-292.
[15]周凌娟.入侵植物紫茎泽兰遗传变异及克隆多样性研究[D].北京:中国科学院植物研究所,2006.
[16]刘晓燕.紫茎泽兰化感作用及化学防除的研究[D].泰安:山东农业大学,2010.
[17]李渊博,徐晗,石雷,等.紫茎泽兰对五种苦苣苔科植物化感作用的初步研究[J].生物多样性,2007,15(5):486-491.
[18]郑丽,冯玉龙.紫茎泽兰叶片化感作用对10种草本植物种子萌发和幼苗生长的影响[J].生态学报,2005,25(10):2 781-2 787.
[19]徐成东,浦雪梅,李国树,等.紫茎泽兰叶水提液对玉米种子萌发和幼苗生长的影响[J].华北农学报,2010,25(增刊):124-127.
[20]胡凯茜,郑元,黄新会,等.紫茎泽兰对桉树幼苗生长及生理生态指标的影响[J].中南林业科技大学学报,2016(6):51-55.

各类文献规范数据选项表
注:“√”为必备项,“0”为任选项,“*”为有则加项,“-”为不要求项。
