白及组织培养及其无性系建立的研究
2018-06-08坤华
, 坤华, , , ,
(1.广西壮族自治区药用植物园, 南宁 530023; 2.广西中医药大学药学院, 南宁 530023;3.广西林业勘测设计院, 南宁 530023)
白及是我国常用中药材,为兰科植物白及[Bletillastriata(Thunb.) Reichb.f.]的干燥块茎,别名白根、地螺丝、白鸡儿、白鸡娃、连及草、羊角七等。产陕西南部、甘肃东南部、江苏、安徽、浙江、江西、福建、湖北、湖南、广东、广西、四川和贵州[1]。生于海拔100~3 200 m的常绿阔叶林下、栋树林或针叶林下、路边草丛或岩石缝中,朝鲜半岛和日本也有分布。白及味苦、甘,性凉,有补肺止血、消肿生肌的功效,是白百抗痨颗粒、百贝益肺胶囊、结核丸、千山活血膏、伤科灵喷雾剂等多种中成药的主要原料。近年来,白及还广泛应用于食品、日用品和化工品等方面。此外,由于白及花大色艳,具有较高的观赏价值,许多地方已将其作为园林花卉植物广泛栽培[2]。
随着生活水平的提高和科学技术的不断发展,白及药用需求和景观需求都不断增加。由于多年无节制的采挖以及生态环境的严重破坏,野生白及资源已濒临枯竭,因此,快速繁殖白及幼苗以挽救白及资源迫在眉睫[3]。传统的人工栽培通常采用分株繁殖,其繁殖效率较低,周期长,不适宜用于商业化的规模种植,无法满足市场需求。所以具有繁殖速度快、周期短、可人工控制培养条件、管理方便等优点的植物组织培养技术是白及快速繁殖方法的重要选择。鉴于此,本研究从白及组培外植体的选择、消毒方法、培养基、激素的选择以及炼苗移栽等方面进行实验,建立组织培养及无性系,为白及的组培快繁及产业化栽培提供参考[4-5]。
1 材料与方法
1.1 材 料
白及[Bletillastriata(Thunb.)Reichb.f.]饱满种子。
1.1.1 实验仪器
AIR TECH超净工作台,立式压力蒸汽灭菌锅,EL电子天平,灭菌器等。
1.1.2 实验试剂
奈乙酸(NAA)、吲哚丁酸(IBA)、6-苄基腺嘌呤(6-BA)、噻二唑苯基脲(TDZ)等。
1.2 方 法
1.2.1 种子灭菌与诱导
取白及蒴果,用洗洁精水清洗表面污垢,流水冲洗5~8 min,再用75%酒精表面灭菌40 s,然后在0.1%的氯化汞溶液中分别灭菌8,12,15 min,无菌水冲洗3~5次。最后在超净工作台上,用消毒好的解剖刀剖开蒴果,并用解剖刀取出种子均匀接种于MS培养基上,将播种好的培养瓶放到培养室中。
1.2.2 丛生芽增殖
白及种子发芽后,继续培养一段时间,待芽长至2 cm以上时,于无菌条件下,切取长约1.5 cm的单苗转接至不同的丛生芽诱导培养基中,每一处理接种24个芽外植体,重复3次,培养30 d进行观察。
丛生芽诱导培养基以MS培养基为基本培养基,添加不同浓度的TDZ、6-BA、IAA进行正交试验。
1.2.3 生根诱导
当丛生芽长到5~7 cm时,将其切成单芽接种于不同浓度的生根培养基中,每一处理接种24个单苗,重复3次,培养30 d后观察生根情况。
生根培养基以1/2 MS培养基为基本培养基,培养基配方分别为:1/2 MS+IBA 0.5 mg/L、1/2 MS+NAA 0.5 mg/L、1/2 MS+NAA 0.5 mg/L+6-BA 0.1 mg/L、1/2 MS+NAA 0.5 mg/L+6-BA 0.5 mg/L。
1.2.4 培养条件
培养温度(25±2)℃,光照强度约2 000 lx,光照时间为12 h/d。
近年来,政府做了很多努力,企业也有诸多进步,但消费者对食品安全的感知仍有待加强,这是食品安全领域的重要议题。有社会学家认为,不科学的信息带给消费者的伤害远远大于真正的食品安全问题。
2 结果与分析
2.1 不同灭菌时间对种子灭菌效果的影响
种子灭菌分别设置3个时间处理,灭菌后播种于MS培养基上进行培养, 10 d后观察到种子变为绿色小球体状,即原球茎,继续培养30~50 d,原球茎不断繁殖增多(见图1)。

图1 白及种子萌发
由表1可以看出,灭菌12 min效果较好,萌发率最高,为84.44%。灭菌时间为8 min时,灭菌时间短,污染率高,存活率比较低;随着灭菌时间的延长,在12 min时,白及种子污染率降低,存活率有所上升,萌发率达到所有处理中的最高值;当灭菌时间延长至15 min时,污染率最低,为10.00%,但由于时间过长,导致部分种子丧失活力,萌发率逐渐下降,为67.5%。
表1 不同灭菌时间对种子消毒诱导效果的影响
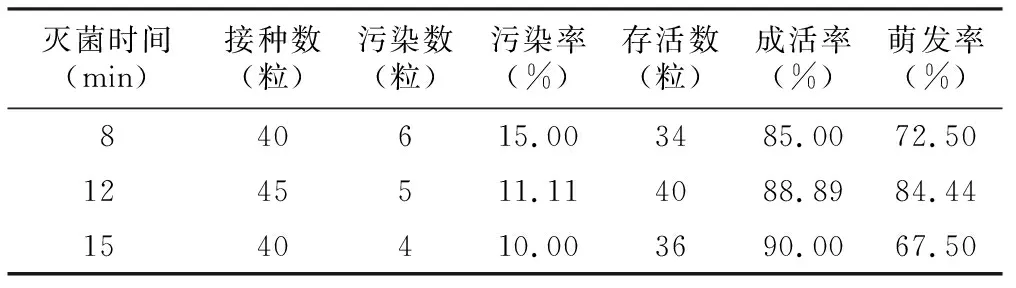
灭菌时间(min)接种数(粒)污染数(粒)污染率(%)存活数(粒)成活率(%)萌发率(%)840615.003485.0072.501245511.114088.8984.441540410.003690.0067.50
2.2 不同激素对白及芽分化的影响
种子萌发后继续在MS培养基上培养7 d,原球茎逐渐增多并开始长出嫩叶(见图2)。

图2 白及原球茎
待芽长至1.2~2 cm后,进行分化增殖L 9(34)正交试验,从试验结果(表2)可以看出,较高浓度的TDZ对白及芽分化有显著的作用。
表2 白及芽分化增殖正交试验结果

处理序号TDZ(mg/L)6-BA(mg/L)IBA(mg/L)接种芽数(个)增殖芽数(个)增值系数10.10.50.124351.4620.11.00.824582.4230.13.01.524612.5441.00.50.824451.8851.01.01.524672.7961.03.00.124753.1372.00.51.524783.2582.01.00.1241245.1792.03.00.8241034.29F值3714.620352251.534246575

图3 白及芽分化培养
TDZ浓度为2.0 mg/L时增殖系数均高于其他处理。其中处理8效果最好(见图3),增殖系数达5.17,其次为处理9和处理7。观察发现,处理8、处理9、处理7 3个处理苗长势最好,株健壮、叶色嫩绿,处理1、处理2苗相对细弱,叶色黄。综合各种情况来看,在芽分化培养基中,MS+TDZ 2.0 mg/L+6-BA 1.0 mg/L+IBA 0.1 mg/L+蔗糖30 g/L+4.5 g/L琼脂的激素组合效果最佳。
2.3 不同激素组合对生根诱导的影响
当丛生芽长到3~5 cm时,将其切成单芽接种于1/2 MS的生根培养基中(图4),培养30 d后观察生根情况。

图4 白及组培苗壮苗生根培养
从表3可看出,NAA更有利于白及的生根,以不同浓度的6-BA和NAA组合对生根效果均优于单一的NAA或单一的6-BA,其中以1/2 MS+NAA 0.5 mg/L+6-BA 0.1 mg/L激素组合生根效果最好,生根率为87.50%,根长势也最好,而1/2 MS+NAA 0.5 mg/L+6-BA 0.5 mg/L的激素组合虽然生根率最高,但根较细弱,不利于炼苗移栽。
表3 不同激素组合对生根诱导的影响

激素组合(mg/L)接种数(株)生根数(株)生根率(%)根长势1/2MS+NAA0.5241979.17+++1/2MS+6-BA0.5241666.67++1/2MS+NAA0.5+6-BA0.1242187.50++++1/2MS+NAA0.5+6-BA0.5242291.67+++
注:++++表示长势最好;+++表示长势较好;++表示长势一般。
2.4 炼苗与移栽
当白及组培苗在生根培养基上根长有3条以上,苗高5~7 cm,且叶色浓绿、生长健壮时,打开培养瓶,并注入少量水淹没培养基,于室内自然光下炼苗1周,用镊子小心取出试管苗,洗净培养基后移栽至基质比例为泥炭土∶蕨根∶木屑=2∶1∶1的基质中,基质以疏松透气、排水良好、不易发霉为宜。根据需要每周喷施1~2次10倍稀释的MS大量元素营养液,移至遮阳荫棚培养,视基质的干湿度喷雾补水。
移栽至荫棚2个月后,白及组培苗成活率为85.7%。
3 讨 论
白及种子自然萌发率极低,采取人工繁育是提高白及产量的有力措施,但现在人工繁育的常规方法大多以分株为主,即将块茎分切成小块种植,在人工栽培条件下,1个块茎每年能形成1~3 个新块茎,繁殖系数、组培苗移栽成活率均较低,苗质量差,大面积发展供种困难,难以满足大规模生产的需要。
在白及灭菌及诱导过程中,在MS基本培养基上培养即可萌发,细胞分裂素TDZ、6-BA和IBA组合可促进原球茎的诱导和增殖,且TDZ对幼苗的分化也有极显著的影响[6]。
从不同浓度的生长素对白及试管苗生根的影响上看,NAA的生根效果较好,说明天然生长素NAA具有良好的促进白及试管苗生根的作用,改变6-BA的浓度后发现,虽然6-BA对白及的生根率有促进作用,但是若6-BA浓度过大,则会使白及根过细,不利于移栽,故在使用6-BA时应控制其浓度[7-9]。
参考文献:
[1]刘逢芹,夏丽娅.中药白芨的现代研究概况[J].山东医药工业,2009,19(5):32-33.
[2]宋立人,洪恂,丁绪亮,等.现代中药学大辞典(卷1)[M].北京:人民卫生出版社,2001.
[3]王倩,李东华,李继坤.白及胶对体外培养兔胆管成纤维细胞形态及活性的影响[J].河北中医,2007,29(8):752-753.
[4]Michinori K,Noriko S,Miho Y,et al.Application studies of Rhizoma Bletillae (rhizomes of Bletilla striata) on atopic dermatitis[J].Nature medicine,2003,57(2):55-60.
[5]陈玉,张晓芳,朱剑东.中药白芨对变链菌产酸和黏附影响的实验研究[J].牙体牙髓牙周病学杂志,2008,18(7):390-393.
[6]叶静,郑晓君,管常东,等.白芨的无菌萌发与组织培养[J].云南大学报(自然科学版),2010,32(S 1):422-425.
[7]赵漫丽,黄春球,李明静,等.添加剂对白芨组培的影响[J].云南农业大学学报,2011,26(6):821-827.
[8]邹娜,李意,连芳青.优良观赏药用地被植物——白芨组织培养及快速繁殖研究[J].江西农业大学学报,2013,35(5):950-955.
[9]张燕,黎斌,李汝娟,等.白芨种子的无菌萌发过程观察和组培快繁研究[J].北方园艺,2013(3):158-160.
