白细胞介素-32与妊娠期糖尿病的相关性
2018-06-07于志艳黄新梅管军华吴跃跃查兵兵
于志艳 黄新梅 管军华 张 瑞 杨 敏 吴跃跃 查兵兵 刘 军△
(1复旦大学附属上海市第五人民医院内分泌科, 2妇产科 上海 200240)
妊娠期糖尿病(gestational diabetes mellitus,GDM)是指在妊娠前糖耐量正常、妊娠期间首次发现血糖异常的糖尿病,是糖尿病的一种特殊类型[1]。GDM的发病率为1%~14%,且亚洲人口GDM发病率较高[2]。GDM患者的血糖如果没有得到及时有效的控制,对孕妇和胎儿都会有不良影响,会增加分娩后2型糖尿病发病率[3]。此外,GDM的产儿在儿童时期和成年后肥胖和糖尿病的发病率高于正常糖耐量孕妇的产儿[3-4]。随着医学研究的进展,发现糖尿病患者体内存在慢性炎症,很多炎症因子(如IL-1、IL-6、CRP、TNF等)的表达与胰岛素抵抗程度成正比,且IL-1β和TNF-α也是导致β细胞损伤和胰岛素抵抗重要的炎症介质[5-6]。IL-32是一种新近发现的炎症因子,主要由自然杀伤(natural killer,NK)细胞、T细胞、单核细胞、内皮细胞等分泌[7]。病毒及细菌等感染后,可诱导IL-32的产生,进而参与多种疾病的发展,如乙型肝炎、炎症性肠病等[8-9]。有研究发现IL-32与1型糖尿病相关[10],但IL-32是否参与GDM的发病,目前并没有相关研究,本文旨在研究IL-32是否参与GDM的发病。
资 料 和 方 法
研究对象随机选取2015年11月—2016年6月在复旦大学附属上海市第五人民医院妇产科分娩的孕妇80例,其中GDM孕妇42例(剖宫产28例,顺产14例;15例采用胰岛素治疗,27例采用饮食和运动治疗),正常对照组38例(剖宫产20例,顺产18例)。纳入标准为:年龄>18岁,在本院建卡并进行规律产检、分娩,有完善的临床资料,单胎妊娠,怀孕前均无糖尿病、高血压,足月分娩。排除标准:妊娠24~28周内缺乏口服75 g无水葡萄糖耐量试验(OGTT)资料,通过人工授精或者促排卵后妊娠,合并有其他妊娠并发症,有心、肾、肝脏等功能不全,有自身免疫性疾病史等。
临床资料回顾性收集患者24~28周的OGTT试验数据,作为分组依据。同时回顾性收集孕妇妊娠前的身高、体重数据,计算孕前BMI,BMI (kg/m2)=体重(kg)/身高(m)2,并记录孕妇入院期间的血压、血脂、血常规、肝功能等临床资料。
诊断标准GDM诊断标准选用2017年美国糖尿病协会(ADA)的诊断标准[11],在妊娠的24~28周进行OGTT试验。OGTT前72 h正常饮食,在禁食8~14 h采集空腹血,之后将75 g无水葡萄糖溶于250 mL水中,5 min内喝完,从喝第一口糖水开始,抽取1、2 h静脉血送检。当空腹血糖≥5.1 mmol/L,1h血糖≥10.0 mmol/L,2 h血糖大于8.5 mmol/L,3项当中有1项及以上异常时即诊断为GDM,归为GDM组,3项均正常归为正常对照组。
血标本采集孕妇分娩当日清晨,无菌静脉取血3 mL,室温下静置30 min后进行离心(587×g,10 min),取上清,分装后迅速置于-80 ℃冰箱保存,以待进行IL-32 ELISA 检测。
胎盘、皮下脂肪和大网膜标本采集80例产妇顺产和剖宫产后,立即取胎盘母体面的绒毛组织(避开钙化梗死灶),大小约1 cm×1 cm×1 cm、脐带1 cm长;28例GDM组产妇及20例正常对照组产妇剖宫产术中取下腹部皮下脂肪和大网膜脂肪,一部分用PBS缓冲液冲洗所选取的组织去除血污,用滤纸吸干后,置于冻存管中迅速放入液氮中保存,以待进行IL-32总RNA的提取;另一部分用甲醛固定后石蜡包埋,进一步行IL-32的免疫组织化学染色。本研究的标本采集均获得患者的知情同意。
空腹血糖、胰岛素测定采用葡萄糖氧化酶法测定空腹血糖(FBG),电化学发光法检测空腹胰岛素(FINS),试剂盒购于罗氏诊断产品(上海)有限公司,均为同批测定,批内变异<5%。GDM组FINS计算时,去除采用胰岛素治疗的15例患者,以减少外来胰岛素对结果的影响,并以此均值代替该15人的FINS,计算胰岛素抵抗指数,计算公式为:HOMA-IR=FBG(mmol/L)×FINS(pmol)/22.5。
实时定量逆转录聚合酶链反应测定IL-32mRNA相对表达量采用日本Takara公司的Trizol(批号9109)提取组织内的总RNA后,加入焦炭酸二乙酯(diethyl pyrocarbonate,DEPC)水,进行260/280吸光度测量(控制在1.8~2.0内)并进行核酸定量。采用日本Takara公司的反转录试剂盒(批号:RR036A),严格按照试剂盒内说明书的操作步骤,以RNA为模板,合成cDNA。再以cDNA为模板,采用Takara公司qPCR检测试剂盒(批号RR420A)进行qPCR,严格按照说明书步骤操作,每个标本重复3次,使用Biosystems 7500荧光定量分析机器进行结果分析。以目标基因(IL-32)与内参照物β肌动蛋白(β-Actin)的吸光度比值作为目标基因的mRNA相对表达水平。引物序列:IL-32正向引物:5’-GGTGAAGGAGAAGGTGGT-3’,反向引物:5’-CGTAGGACTGGAAAGAGGA-3’;β-Actin正向引物:5’-CTACCTCATGAAGATCCT-CACCGA-3’,反向引物:5’-TTCTCCTTAATG-TCACGCACGATT-3’。
免疫组织化学法检测胎盘及脐带内IL-32蛋白表达量胎盘及脐带组织石蜡包埋后,切片(厚度为5 mm),后经二甲苯脱腊、梯度乙醇水化后,加入Dako PH6的抗原修复液(1∶10稀释),高压锅煮沸20 min,然后用Dako封闭液封闭30 min,用免疫组化笔在组织周围画圈后,加入Abcam IL-32一抗(型号:ab7158,1∶300稀释),37 ℃,2 h,洗掉一抗后,加入Dako公司抗兔二抗,室温孵化30 min后,加入DAB显色,Harrs’s 苏木精复染。每个步骤用1×TBST洗3次,每次5 min。染色后的组织经梯度乙醇脱水后,放入Histoline溶液,去除免疫组化笔的印记,用中性树脂封片。显微镜下拍照后,Image Plus 9.0软件进行分析。
ELISA测定血清IL-32水平采用ELISA检测血IL-32的表达。试剂盒购自美国LifeSpan公司(型号为LS-F22937),实验操作严格按照试剂盒说明书进行,并且每个样本设置2个重复孔,以减少操作误差。测定450 mm的吸光度(D)值,绘制标准曲线,计算每个样本的IL-32含量。

结 果
一般临床资料GDM组的空腹血糖、1 h血糖、2 h血糖、HOMA-IR明显高于正常对照组(P<0.05);此外,与妊娠期间血糖正常的孕妇相比,GDM患者的血淋巴细胞百分比明显增加[(18.73%±4.34%)vs.(15.48%±3.46%),P=0.017],血三酰甘油明显增加[(2.91±1.17)vs.(2.18±0.85) mmol/L,P=0.009],血-谷氨酰转移酶(-GT)明显增加[(19.67±11.23)vs.(11.17±5.77) U/L,P=0.003],其余肝功能相关指标略增高,但差异无统计学意义(P>0.05)。两组孕妇的妊娠年龄、孕前身高、孕前体重、孕前BMI、分娩孕周及胎儿出生体重、血压等差异无统计学意义(P>0.05,表1)。
胎盘、皮下脂肪和大网膜脂肪组织的IL-32mRNA表达GDM组胎盘组织IL-32mRNA的表达水平明显高于正常对照组[(3.06±0.49)vs.(1.32±0.23),t=3.29,P<0.01],大网膜脂肪组织内IL-32mRNA的表达水平也明显高于正常对照组,差异有统计学意义[(5.21±0.91)vs.(1.96±0.29),t=4.23,P<0.01],但皮下脂肪组织内IL-32mRNA的表达水平两组间差异无统计学意义[(3.78±0.53)vs.(3.61±0.35),t=0.28,P>0.05,图1]。


Height:Height before pregnancy;Weight:Weight before pregnancy;BMI:BMI before pregnancy;FINS:Fasting insulin;SBP:systolic blood pressure;DBP:Diastolic blood pressure;TC:Total cholesterol;TG:Triglyceride;ALT:Alanine aminotransferase;AST:Aspartate aminotransferase;-GT:-glutamyltransferase.

A:Relative expression of IL-32 in subcutaneous adipose tissue;B:In greater omentum;C:In placental tissue.
图1胎盘及脂肪组织内IL-32mRNA实时定量PCR结果
Fig1RealtimePCRanalysisofIL-32mRNAexpressionintheplacentaandfattissue
胎盘及脐带内IL-32蛋白的表达量IL-32在GDM组和非GDM组的胎盘绒毛膜及脐带动脉、脐带静脉、脐带间质内都可以检测到,脐动脉和脐静脉内的表达量均较高,在脐带间质内含量相对较低。脐动脉内IL-32主要表达于内膜,GDM组的IL-32在脐动脉的表达量明显高于对照组组,增加了29.9%,差异具有统计学意义(P=0.011,图2A-C)。在对照组的脐带静脉内膜内可以检测到IL-32蛋白的表达,但表达量比GDM组低31.5%,差异具有统计学意义(P=0.034,图2D-F)。GDM组和对照组的脐带间质内都可以检测到IL-32,但是两者之间并没有明显差异(P=0.207,图2 G-I)。GDM组胎盘内的IL-32蛋白表达量明显增高,比对照组增加了27.3%,差异具有统计学意义(P=0.019,图2 J-L)。
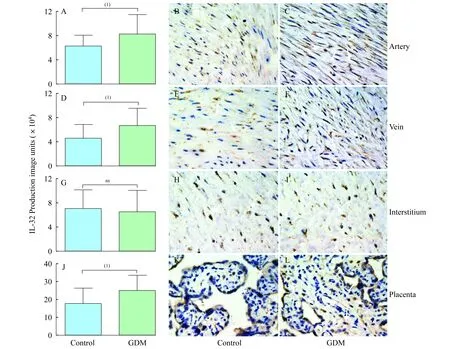
IL-32 production in the umbilical artery was significantly higher from GDM than that from non-GDM patients(A).The micrographs demonstrate the representative pictures of IL-32 staining in umbilical artery from control (B) and GDM (C) group.Significantly higher IL-32 was detected in GDM umbilical veins than that of control group (D),with representative micrographs (E and F).IL-32 production can detected in the umbilical interstitial tissues from both GDM (I) and control group (H) without significant difference (G).IL-32 was also highly produced in the GDM compared with that from non-GDM placenta (J).The representative micrographs of control group (K) and GDM group (L).Arrows in figures show the expression of IL-32 protein.(1)P<0.05;ns:P>0.05.
图2IL-32在脐动脉、脐静脉、脐带间质和胎盘内的表达
Fig2IL-32productioninumbilicalartery,umbilicalvein,umbilicalinterstitiumandplacenta
血清IL-32水平GDM组孕妇血清内IL-32的表达水平明显高于正常对照组孕妇[(129.3±5.78)vs.(105.6±8.61) pg/mL,t=2.227,P<0.05],差异具有显著的统计学意义。
血清IL-32水平与空腹血糖及HOMA-IR相关性分析血清IL-32水平与FBG和HOMA-IR均具有正相关的关系,相关系数分别为0.56 (P<0.001)和0.43 (P=0.005)。
讨 论
GDM是妊娠期常见的一种合并症,近年来其发病率有逐渐升高的趋势。虽然GDM的病程较短,但仍可对孕妇及产儿产生一系列不良的影响。目前对于GDM的发病机制尚不清楚,炎症可能是其发病原因之一。有报道显示,GDM患者血清内的TNF-α增加,与IR有明显的相关性[12]。陈立春等的研究显示,脂肪因子瘦素、视黄醇结合蛋白4 (RBP4)、IL-6、TNF-α明显升高,而RBP4脂联素明显降低,脂肪因子、炎症因子的过度分泌导致的炎性激活,也验证了炎症因子参与了GDM的发病[13]。
我们的研究结果中TC、LDL、HDL和的新生儿体重未见明显差异,与先前的研究[14]结果不完全一致,可能是样本量差异所致。GDM组孕妇的三酰甘油和-GT水平明显高于Non-GDM组,原因可能是,GDM患者体内的高血糖,妨碍了血脂的代谢,而脂代谢与糖代谢相辅相成,高血脂可能会进一步升高血糖。分娩前,GDM组孕妇静脉血内,淋巴细胞百分比增加,提示GDM患者体内存在有炎症反应。
IL-32作为一种新近发现的炎症因子,参与了多种炎症、非炎症性疾病的发病,可以促进炎症,抑制病毒的增殖。最初IL-32被认为是IL-2或IFN刺激后表达的转录物,但随后的研究结果显示,IL-32具有通过NF-кB和p38促分裂原活化蛋白激酶和NOD1、2信号通路的活化,而诱导其他促炎细胞因子和趋化因子(如TNF-α,IL-1β,IL-6)产生的作用[15,16]。在肥胖人群体内,IL-32的表达量增加,减重手术后,IL-32表达量可以降低,而通过控制饮食减重的人群体内,IL-32表达量未见明显减少,提示胃肠道激素可能影响IL-32的合成和分泌[17]。体外实验结果显示,IL-32基因沉默后,能量产生的相关基因(肌酸激酶,PPARGC1A等)上调,ATP水平增加,在胰岛素刺激后,AKT的磷酸化增加,提示胰岛素敏感性增加,肌肉活检后检测的IL-32水平,与HOMA-IR具有相关性[18],IL-32转基因的小鼠,经过高脂饲养后,骨骼肌重量明显降低、对胰岛素的反应性降低,此外小鼠体内丙酮酸循环和柠檬酸循环通路的相关基因下调[18]。IL-32分子共有7种不同的亚型,IL-32(α、β、γ、δ、ε、ζ)[15,19]及一个新的亚型[20],目前各亚型功能尚未完全清楚,且各个亚型功能并不完全一致甚至相反:IL-32γ可以增加STZ对胰腺细胞的损害和炎症,进而加速T1DM的造模速度;而IL-32β过表达的小鼠,高脂饲养后,与对照组相比,可以明显改善肝内脂肪变性和炎症[21]。
我们的结果显示,与Non-GDM组相比,GDM患者胎盘、脐带血管、大网膜脂肪内IL-32的蛋白及mRNA的表达量均增加,并且循环中IL-32的水平明显增加,与空腹血糖及HOMA-IR具有正相关关系,以往的研究结果显示,肥胖的人群体内IL-32表达水平增加[17]。我们的两组孕妇孕前的BMI无统计学意义,说明GDM组IL-32水平的增加,不是因GDM组孕妇肥胖所致,IL-32的升高与GDM发病具有相关性。本研究结果可为未来GDM的治疗和病因学研究提供理论基础。
本文的不足之处在于,未具体检测IL-32的不同亚基的表达量及IL-32作用的上、下游的信号通路,未来需进一步研究,来探讨IL-32不同的分子片段与GDM的相关性,及其作用的具体分子通路。
参 考 文 献
[1] Diagnostic criteria and classification of hyperglycaemia first detected in pregnancy:a World Health Organization Guideline[J].DiabetesResClinPract,2014,103(3):341-363.
[2] Gestational diabetes mellitus[J].DiabetesCare,2004,27(Suppl 1):S88-S90.
[3] DAMM P.Future risk of diabetes in mother and child after gestational diabetes mellitus[J].IntJGynaecolObstet,2009,104(Suppl 1):S25-S26.
[4] DABELEA D.The predisposition to obesity and diabetes in offspring of diabetic mothers[J].DiabetesCare,2007,30(Suppl 2):S169-S174.
[5] KILB H,MANDRUP-POULSEN T.An immune origin of type 2 diabetes?[J].Diabetologia,2005,48(6):1038-1050.
[6] KNUDSEN SH,PEDERSEN BK.Targeting inflammation through a physical active lifestyle and pharmaceuticals for the treatment of type 2 diabetes[J].CurrDiabRep,2015,15(10):82.
[7] KHAWAR MB,ABBASI MH,SHEIKH N.IL-32:A novel pluripotent inflammatory interleukin,towards gastric inflammation,gastric cancer,and Chronic Rhino Sinusitis[J].MediatorsInflamm,2016,2016:8413768.
[8] SHIOYA M,NISHIDA A,YAGI Y,etal.Epithelial overexpression of interleukin-32alpha in inflammatory bowel disease[J].ClinExpImmunol,2007,149(3):480-486.
[9] XU Q,PAN X,SHU X,etal. Increased interleukin-32 expression in chronic hepatitis B virus-infected liver[J].JInfect,2012,65(4):336-342.
[10] JHUN H,CHOI J,HONG J,etal.IL-32γ overexpression accelerates streptozotocin (STZ)-induced type 1 diabetes[J].Cytokine,2014,69(1):1-5.
[11] AMERICAN DIABETES ASSOCIATION.Management of diabetes in pregnancy[J].DiabetesCare,2017,40(Suppl 1):S114-114S119.
[12] WINKLER G,CSEH K,BARANYI E,etal.Tumor necrosis factor system in insulin resistance in gestational diabetes[J].DiabetesResClinPract,2002,56(2):93-99.
[13] 陈利春,陈冠军,叶俊良,等.妊娠期糖尿病患者脂肪细胞因子与炎症的相关性分析[J].安徽医科大学学报,2012,47(7):842-845.
[14] 孔令英,杨慧霞,孟文颖,等.妊娠期血脂与妊娠期糖尿病、巨大儿的关系研究[J].中华糖尿病杂志,2016,8(12):735-740.
[15] KIM SH,HAN SY,AZAM T,etal.Interleukin-32:a cytokine and inducer of TNFalpha[J].Immunity,2005,22(1):131-142.
[16] NETEA MG,AZAM T,FERWERDA G,etal.IL-32 synergizes with nucleotide oligomerization domain (NOD) 1 and NOD2 ligands for IL-1beta and IL-6 production through a caspase 1-dependent mechanism[J].ProcNatlAcadSciUSA,2005,102(45):16309-16314.
[18] DAVEGÅRDH C,BROHOLM C,PERFILYEV A,etal.Abnormal epigenetic changes during differentiation of human skeletal muscle stem cells from obese subjects[J].BMCMed,2017,15(1):39.
[19] GODA C,KANAJI T,KANAJI S,etal.Involvement of IL-32 in activation-induced cell death in T cells[J].IntImmunol,2006,18(2):233-240.
[20] IMAEDA H,ANDOH A,AOMATSU T,etal.A new isoform of interleukin-32 suppresses IL-8 mRNA expression in the intestinal epithelial cell line HT-29[J].MolMedRep,2011,4(3):483-487.
[21] LEE DH,HONG JE,YUN HM,etal.Interleukin-32β ameliorates metabolic disorder and liver damage in mice fed high-fat diet[J].Obesity(SilverSpring),2015,23(3):615-622.
