PD-1/PD-L通路在食管癌中的表达 及临床意义的研究进展
2018-06-07综述杨晓冬孙奉昊审校
马 可(综述) 杨晓冬 孙奉昊 詹 成(审校) 王 群
(复旦大学附属中山医院胸外科 上海 200032)
食管癌是最常见的恶性肿瘤之一,而我国是世界上食管癌发病率和死亡率最高的国家,接近一半的新发病例和死亡病例发生在我国[1-2]。近年来,尽管食管癌的治疗方式有了一定的进展,但其总体治疗结果仍然不尽如人意[3]。
程序性死亡分子1 (programmed death-1,PD-1)及其配体(programmed death-1 ligand,PD-L)是当前肿瘤靶向治疗的研究热点之一。PD-1是一种跨膜糖蛋白,通常在T细胞活化的过程中作为负协同刺激分子受体,其基因定位于人染色体2q37.3,由6个外显子编码,268个氨基酸组成,主要表达在T细胞、B细胞、NK细胞等多种免疫细胞的膜表面。目前已发现PD-L有两类:PD-L1和PD-L2。二者在人体正常组织中的表达分布不同:PD-L1表达于所有专职或非专职抗原呈递细胞、血管内皮细胞、胰岛细胞、胎盘、睾丸、角膜等细胞或组织中,而PD-L2则在活化的巨噬细胞、树突状细胞中表达[4];PD-L2对PD-1的亲和力是PD-L1的3~5倍[5]。当PD-1与PD-L结合后,通过多种途径下调T细胞的功能,包括拮抗T细胞受体以抑制其信号传导、改变T细胞的正常代谢以抑制其分化、降低T细胞的抗氧化功能以抑制其杀伤作用[6-7]。在正常生理状态下,PD-1/PD-L通路作为免疫调定点发挥免疫抑制的作用,避免自身免疫反应的发生并为上述一些组织提供免疫豁免[6]。在肿瘤组织中,募集的T细胞分泌干扰素γ (interferon γ,IFN-γ),PD-L1和PD-L2能被IFN-γ诱导表达[8],过表达的PD-L与PD-1结合,最终引起肿瘤的免疫逃逸[9]。因此,抑制PD-1/PD-L1通路可以上调T细胞的作用,抑制肿瘤抗免疫作用,从而用于肿瘤治疗。近年来,已有PD-1/PD-L通路抑制剂被FDA批准进入临床,在某些肿瘤如恶性黑色素瘤、非小细胞肺癌、肾细胞癌的治疗中已取得了较满意的疗效[10-12]。目前,许多学者对PD-1/PD-L在食管癌中的表达和功能进行了初步研究,现将研究成果综述如下。
PD-1/PD-L通路在食管癌中的表达与临床意义
PD-1 在食管癌中的表达及临床意义(表1) Feng等[13]采用免疫组化对88例食管鳞癌患者手术标本中的PD-1表达情况进行了研究,结果显示正常食管组织、癌旁不典型增生组织及肿瘤组织中PD-1的表达率分别为6.7% (2/30)、22.9% (8/35)和51.2% (45/88),肿瘤组织中PD-1的表达明显增高[13]。结合各临床参数:PD-1表达与患者是否存在淋巴结转移、病理分化程度的相关性有统计学意义,存在淋巴结转移的患者(无转移vs.有转移:30.2%vs.60.0%,P<0.05)、分化较低(高分化vs.中分化vs.低分化:16.7%vs.51.6%vs.84.6%,P<0.05)的患者肿瘤组织中PD-1阳性比例较高;与年龄(P=0.37)、性别(P=0.71)、肿瘤直径(P=0.67)、浸润深度(P=0.08)、TNM分期(P=0.89)等无关[13]。PD-1表达阳性的患者较阴性的患者相比生存时间差异无统计学意义(中位生存时间:29.8个月vs.32.1个月)[13]。
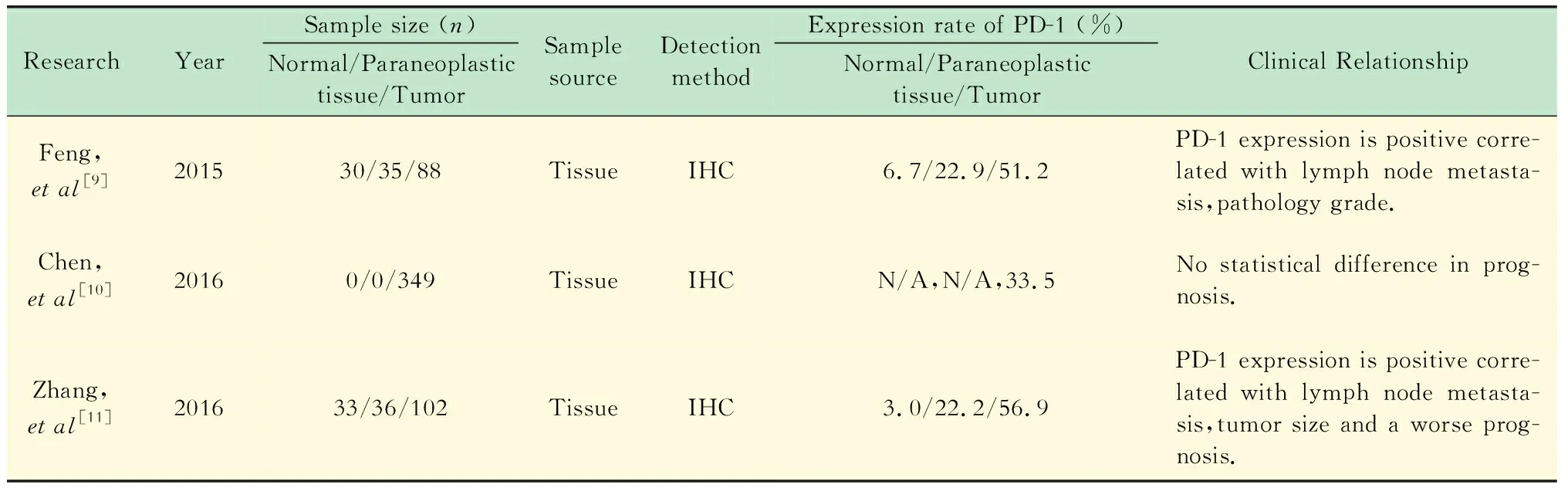
表1 PD-1在食管癌中的表达及临床意义Tab 1 PD-1 expression and clinical relationship in esophageal cancer
Chen等[14]采用免疫组化检测了349例食管鳞癌患者手术标本中PD-1的表达,阳性率为33.5% (117/349),比较PD-1的表达与各临床参数发现:PD-1的表达与年龄(P=0.37)、性别(P=0.55)及TNM分期(P=1.00)等临床因素以及患者总生存期的相关性无统计学意义[14]。
张锋等[15]采用免疫组化检测了102例食管鳞癌患者手术标本的33例正常组织、36例癌旁组织及102例肿瘤组织中PD-1的表达情况,结果显示三者中PD-1的表达率分别为3.0%(1/33)、22.2%(8/36)和56.9% (58/102)。结合各临床因素认为:在肿瘤直径较大的患者(≤3 cmvs.>3 cm:42.9%vs.73.9%,P=0.03)及淋巴结有转移(无转移vs.有转移:45.3%vs.69.4%,P=0.01)的患者中,肿瘤PD-1阳性表达率较高;同时PD-1的表达与患者的预后呈负相关(中位生存时间:23.2个月vs.38.9个月,P<0.05),与年龄(P=0.87)、性别(P=0.73)、浸润深度(P=0.33)、病理分级(P=0.41)等因素无关[15]。
一项关于中国人PD-1基因多态性的研究显示,在rs10204525这一位点上,GG基因型相比于AA/AG基因型,食管鳞癌的发病风险更低[16]。
PD-L1在食管癌中的表达及临床意义(表2) Chen等[17]采用免疫组化检测了99例食管癌患者手术标本中PD-L1的表达,并进一步研究了细胞膜、细胞质、细胞核等不同位置PD-L1的表达情况。研究结果显示,PD-L1在食管癌细胞膜及细胞质中表达率为82.8% (82/99),在细胞核中表达率为72.7% (72/99)[17]。研究者统计了患者预后及各临床参数与PD-L1表达率的关系,发现细胞膜及细胞质中PD-L1阳性的患者,其总生存率显著低于阴性的患者(P=0.04)。此外,在T分期较高的患者中(T1+T2vs.T3+T4:71.4%vs.89.1%,P=0.03),PD-L1的表达率较高[17]。
Ohigashi等[18]采用实时定量PCR和免疫组化的方法,同时检测了31例食管鳞癌患者手术标本癌组织中PD-L1 mRNA水平和蛋白质水平的表达,发现在mRNA水平上PD-L1表达率为48.4%(15/31),在蛋白质水平上表达率为41.9%(13/31),二者呈正相关(P=0.02);通过统计31例患者组织中PD-L1的表达与患者生存时间、各临床因素的关系,认为总生存率与PD-L1的表达呈负相关(P=0.03);多变量分析结果认为PD-L1是影响食管癌预后的一个独立变量(P<0.01)[18]。

表2 PD-L1在食管癌中的表达及临床意义Tab 2 PD-L1 expression and clinical significance in esophageal cancer
Tanaka等[19]采用免疫组化对180例食管鳞癌患者进行了PD-L1表达的检测,结果显示阳性率为29.4%(53/180)。统计PD-L1表达率与患者预后的关系,结果同样显示PD-L1阳性的患者总生存率显著低于阴性患者(P=0.01),另外,在淋巴结有转移的患者中(无转移vs.有转移:15.1%vs.35.4%,P=0.01)PD-L1表达率较高,从而加速了T细胞的凋亡[19]。
Chen等[14]采用免疫组化检测了536例食管鳞癌患者肿瘤细胞中PD-L1的表达率,结果显示阳性率为41.4% (222/536)。结合各临床因素分析认为:在肿瘤分化较高(高分化vs.中分化vs.低分化:54.3%vs.43.8%vs.30.6%,P=0.01)、TNM分期较低(Ⅰ期vs.Ⅱ期vs.Ⅲ期vs.Ⅳ期:57.4%vs.46.2vs.43.1%vs.57.1%,P<0.01)、N分期较低(N0vs.N1vs.N2vs.N3:51.8%vs.32.4%vs.39.3%vs.27.0%,P<0.01)的患者中,PD-L1表达率较高,且PD-L1表达阳性的患者预后较好,据此他们认为PD-L1阳性是预后良好的预测因素[14]。这与上面几个研究有所不同。这种差异上的来源可能是一部分PD-L1阳性表达的患者,其肿瘤组织中的CD8+T细胞低表达甚至不表达PD-1,这类T细胞与PD-L1共同被IFN-γ诱导表达,但PD-L1因缺乏受体而未激活负协同刺激信号,因此呈现出PD-L1高表达时预后更好的结果[20]。
PD-L2在食管中的表达及临床意义(表3) Derks 等[21]用免疫组化检测了354例食管腺癌患者肿瘤组织中PD-L2的表达,发现PD-L2的表达率高达81.6%(289/354)。统计分析显示,在肿瘤分期较低(Ⅰ期vs.Ⅱ期vs.Ⅲ期vs.Ⅳ期:31.0%vs.13.2%vs.15.2%vs.8.3%,P<0.01)、T分期较低(T1vs.T2vs.T3vs.T4:30.4%vs.13.9%vs.12.6%vs.20.0%,P<0.01)、肿瘤分化较好(高分化vs.中分化vs.低分化:54.2%vs.22.8%vs.13.0%,P<0.01)的患者中,PD-L2表达率较高,提示PD-L2的表达在食管腺癌中是预后良好的一个预测因素[21]。进一步研究显示,PD-L2在食管腺癌的癌前病变——Barrett’s食管中表达率为42.8%(9/21),研究者推测:Barrett’s食管中的慢性炎症反应介导了PD-L2的高表达,而这种慢性炎症环境有利于食管腺癌的预后,因此出现PD-L2阳性表达的患者预后更好[21]。
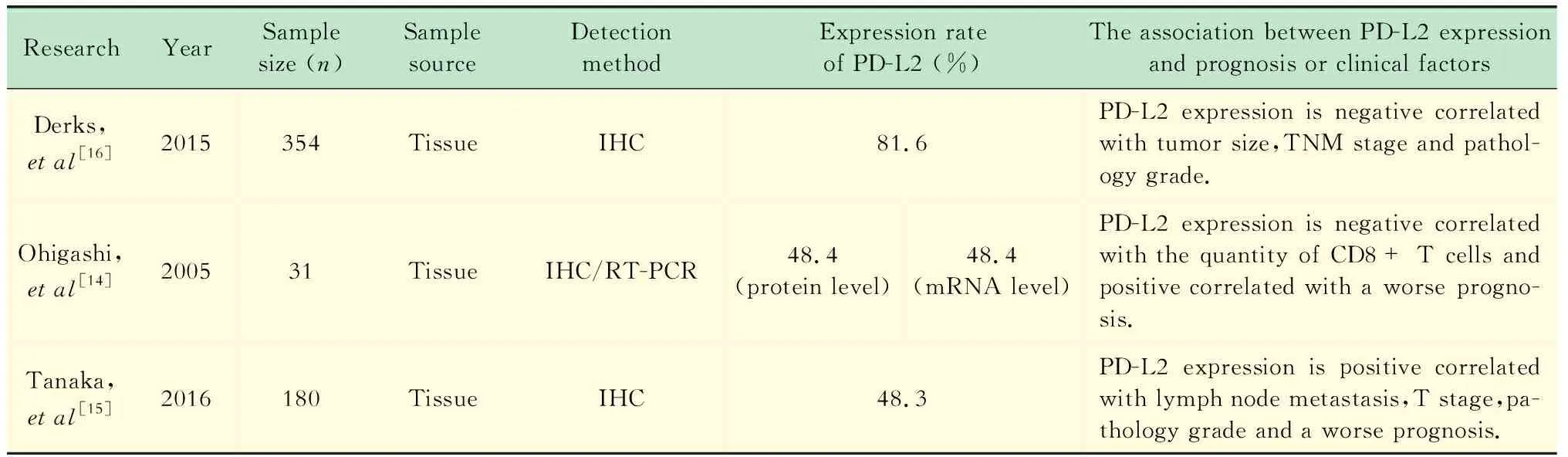
表3 PD-L2在食管中的表达及临床意义Tab 3 PD-L2 expression and clinical significance in esophageal cancer
Ohigashi等[18]的研究显示:31例食管鳞癌患者手术标本的PD-L2在mRNA水平和蛋白质水平的表达率为都48.4%(15/31),二者呈正相关(P<0.01)。PD-L2的表达与CD8+T细胞的数量呈负相关(P=0.01),PD-L2阳性表达的患者的预后更差,提示PD-L2的表达是预后不良的一个因素[18]。
Tanaka等[19]的研究表明:180例食管鳞癌患者的PD-L2表达率为48.3%(87/180)。在T分期较高(T1+T2vs.T3+T4:33.8%vs.48.5%,P<0.01)、淋巴结有转移(无转移vs.有转移:28.3%vs.56.7%,P<0.01)、肿瘤分期较高(Ⅰ期+Ⅱ期vs.Ⅲ期+Ⅳ期:31.9%vs.59.3%,P<0.01)的患者中,PD-L2的表达率较高;PD-L2阳性表达的患者预后较差[19]。
综上所述,较高比例的食管癌患者肿瘤组织中PD-1、PD-L1、PD-L2表达阳性,阳性比例显著高于癌旁组织和正常组织,这意味着针对这一通路的治疗方法可能在食管癌中有着较好的前景。不同研究结果中,食管癌中PD-1、PD-L1和PD-L2的表达与临床特征的关系有一定差异,尚有待进一步的研究以确认。
PD-1/PD-L通路与食管癌的治疗由于PD-1/PD-L通路在许多肿瘤中广泛存在,在肿瘤的免疫逃逸机制中起着重要作用,因此针对这一通路的靶向治疗是当前的研究热点。多个PD-1抑制剂及PD-L1抑制剂已进入临床试验阶段,有些已应用于肿瘤治疗中。Nivolumab是首个上市的PD-L1抑制剂,被FDA批准用于转移性黑色素瘤、非小细胞肺癌及进展期肾癌的治疗[22]。目前,见诸报道的PD-1或PD-L靶向抑制剂在食管癌中的临床试验仅有1项。这项Nivolumab用于化疗无效的食管癌患者的二期临床试验[23]显示:在64例受试者中,客观缓解率为15.6% (10/64,完全缓解1例,部分缓解9例);在12名受试者中出现了18人次不良反应;没有出现与治疗相关的死亡病例。
一些研究表明,放疗和化疗可使肿瘤组织中PD-L1、PD-L2的表达产生变化。Lim等[24]比较了19例新辅助同步放化疗和9例新辅助化疗患者治疗前后的肿瘤组织中PD-L1的表达率,发现前者的PD-L1表达明显上调,而后者则明显下调,认为放疗会提高肿瘤组织中PD-L1的表达率,因此放疗与PD-1/PD-L抑制剂的联合疗法可能具有良好的效果。Tanaka等[19]的研究发现,PD-L1阳性的患者中,有新辅助化疗史的比例较大,但PD-L1的表达与化疗效果无相关性;而PD-L2阳性的患者在接受化疗后效果较差。PD-L1和PD-L2对患者预后的影响与是否曾接受新辅助化疗密切相关:未接受新辅助化疗的患者总生存率与PD-L1或PD-L2是否阳性无相关性;而有新辅助化疗史的患者总生存率明显低于阴性的患者,研究者认为PD-L1和PD-L2在肿瘤细胞免疫逃逸过程中发挥的作用有所不同[19]。
结语目前研究表明,较大比例的食管癌组织中存在PD-1/PD-L表达,这为针对PD-1/PD-L通路的食管癌靶向治疗提供了初步依据。但目前PD-1/PD-L通路在食管癌中的基础研究仍不充分,并且缺乏相关药物在食管癌中的大规模临床试验,未来将有更多的研究和试验进一步证明PD-1/PD-L通路在食管癌治疗中的价值。
参 考 文 献
[1] TORRE LA,BRAY F,SIEGEL RL,etal.Global cancer statistics,2012[J].CACancerJClin,2015,65(2):87-108.
[2] ZENG H,ZHENG R,ZHANG S,etal.Esophageal cancer statistics in China,2011:estimates based on 177 cancer registries[J].ThoracCancer,2016,7(2):232-237.
[3] KIM T,GROBMYER SR,SMITH R,etal.Esophageal cancer--the five year survivors[J].JSurgOncol,2011,103(2):179-183.
[4] BOUSSIOTIS VA.Molecular and biochemical aspects of the PD-1 checkpoint pathway[J].NEnglJMed,2016,375(18):1767-1778.
[5] LIANG SC,LATCHMAN YE,BUHLMANN JE,etal.Regulation of PD-1,PD-L1,and PD-L2 expression during normal and autoimmune responses[J].EurJImmunol,2003,33(10):2706-2716.
[6] REYNOSO ED,ELPEK KG,FRANCISCO L,etal.Intestinal tolerance is converted to autoimmune enteritis upon PD-1 ligand blockade[J].JImmunol,2009,182(4):2102-2112.
[7] PATSOUKIS N,BARDHAN K,CHATTERJEE P,etal.PD-1 alters T-cell metabolic reprogramming by inhibiting glycolysis and promoting lipolysis and fatty acid oxidation[J].NatCommun,2015,6:6692.
[8] LATCHMAN Y,WOOD CR,CHERNOVA T,etal.PD-L2 is a second ligand for PD-1 and inhibits T cell activation[J].NatImmunol,2001,2(3):261-268.
[9] KEIR ME,BUTTE MJ,FREEMAN GJ,etal.PD-1 and its ligands in tolerance and immunity[J].AnnuRevImmunol,2008,26:677-704.
[10] GETTINGER S,RIZVI NA,CHOW LQ,etal.Nivolumab monotherapy for first-line treatment of advanced non-small-cell lung cancer[J].JClinOncol,2016,34(25):2980-2987.
[11] MOTZER RJ,ESCUDIER B,MCDERMOTT DF,etal.Nivolumab versus everolimus in advanced renal-cell carcinoma[J].NEnglJMed,2015,373(19):1803-1813.
[12] ROBERT C,LONG G V,BRADY B,etal.Nivolumab in previously untreated melanoma without BRAF mutation[J].NEnglJMed,2015,372(4):320-330.
[13] FENG Z,XIANG-LEI L,HAI-TAO W,etal.Programmed cell death 1 expression in esophageal squamous cell carcinoma and association with clinical characteristics[J].IndianJCancer,2015,52(Suppl 3):E176-E178.
[14] CHEN K,CHENG G,ZHANG F,etal.Prognostic significance of programmed death-1 and programmed death-ligand 1 expression in patients with esophageal squamous cell carcinoma[J].Oncotarget,2016,7(21):30772-30780.
[15] 张锋,韦海涛,王作培,等.食管鳞癌组织中程序性死亡分子1表达变化及意义[J].山东医药,2016,56(26):41-43.
[16] QIU H,ZHENG L,TANG W,etal.Programmed death-1 (PD-1) polymorphisms in Chinese patients with esophageal cancer[J].ClinBiochem,2014,47(7-8):612-617.
[17] CHEN L,DENG H,LU M,etal.B7-H1 expression associates with tumor invasion and predicts patient's survival in human esophageal cancer[J].IntJClinExpPathol,2014,7(9):6015-6023.
[18] OHIGASHI Y,SHO M,YAMADA Y,etal.Clinical significance of programmed death-1 ligand-1 and programmed death-1 ligand-2 expression in human esophageal cancer[J].ClinCancerRes,2005,11(8):2947-2953.
[19] TANAKA K,MIYATA H,SUGIMURA K,etal.Negative influence of programmed death-1-ligands on the survival of esophageal cancer patients treated with chemotherapy[J].CancerSci,2016,107(6):726-733.
[20] DROESER RA,HIRT C,VIEHL CT,etal.Clinical impact of programmed cell death ligand 1 expression in colorectal cancer[J].EurJCancer,2013,49(9):2233-2242.
[21] DERKS S,NASON KS,LIAO X,etal.Epithelial PD-L2 expression marks Barrett’s esophagus and esophageal adenocarcinoma[J].CancerImmunolRes,2015,3(10):1123-1129.
[22] LI Y,LI F,JIANG F,etal.A mini-review for cancer immunotherapy:molecular understanding of PD-1/PD-L pathway and translational blockade of immune checkpoints[J].IntJMolSci,2016,17(7): pii:E1151.
[23] TAKASHI U,MURO K,HARA H,etal.Phase 2 study of Nivolumab(anti-PD-1;ONO-4538)in patients with esophageal cancer preliminary report[J].EurJCancer,2015,51(Suppl 3):S432.
[24] LIM SH,HONG M,AHN S,etal.Changes in tumour expression of programmed death-ligand 1 after neoadjuvant concurrent chemoradiotherapy in patients with squamous oesophageal cancer[J].EurJCancer,2016,52:1-9.
