Wnt通路抑制剂ETC-159处理对口腔鳞癌细胞增殖迁移的影响
2018-06-06段艳军陈文杰王凤娟
段艳军 徐 卫 陈文杰 王凤娟
口腔鳞状细胞癌(Oral squamous cell carcinoma,OSCC)是最常见的口腔肿瘤类型,占全部口腔恶性肿瘤的90%,头颈部肿瘤的38%,每年诊断超过50万的新发病例[1]。Wnt信号通路是细胞信号转导过程中的经典途径之一,ETC-159是Wnt信号通路的一个强效抑制剂,能有效抑制几乎所有种类的Wnt蛋白的活性和分泌,同时已被证明在结直肠癌中有出色的疗效,但是其作用机制尚不明确[2]。由于口腔鳞状细胞癌治疗手段相对匮乏,给患者及其家人带来沉重的精神以及经济负担,因此对口腔鳞状细胞癌治疗药物的进一步研究迫在眉睫。本研究拟通过细胞实验证明,ETC-159能否影响口腔鳞癌细胞的增殖或迁移,并对其机制进行一定的探讨,为口腔鳞状细胞癌治疗药物的开发提供新的证据。
1 材料与方法
1.1 细胞和试剂
SCC-15细胞(属于口腔鳞癌细胞系)购自中科院上海细胞库,DMEM高糖培养基(Gibco公司),胎牛血清FBS(Gibco公司),CCK8试剂盒(碧云天公司),二甲基亚砜(DMSO,Sigma公司),ETC-159(Med Chem Express,MCE),Transwell小室(康宁公司),Ripa细胞裂解液(碧云天),兔抗Wnt3a、β-catenin、c-Myc、cyclin D1、CD146多克隆抗体和鼠抗DM1A单克隆抗体(Abcam公司,稀释比均为1∶1 000),荧光标记的羊抗兔以及羊抗鼠二抗抗体(LI-COR公司,稀释比均为1∶15 000),PVDF膜(Hyclone公司),抗体稀释液(碧云天公司)。
1.2 CCK8检测细胞增殖
将SCC-15细胞接种于96孔板,每孔约1×103个,每孔加入培养基100 μL,置37℃细胞培养箱中培养12 h后,取24孔加入DMSO(每孔0.2 μL)(即DMSO组),分别培养12 h(12孔)和24 h(12孔),另取24孔加入ETC-159(DMSO稀释至1.45 μΜ,每孔加入0.2 μL使其工作浓度为2.9 nM)(即ETC-159组),分别培养12 h(12孔)和24 h(12孔)后换液(每孔加培养基90 μL),同时加入CCK8反应液10 μL,继续培养4 h后用酶标仪检测450 nm波长处的吸光度,每次检测以加入培养基和反应液的无细胞孔为空白对照。细胞增殖活性=(ETC-159组吸光度-空白对照吸光度)/(DMSO组吸光度-空白对照吸光度)。
1.3 Transwell小室检测细胞转移
将Transwell小室放入24孔板,上室加入300 μL DMEM高糖培养基孵育25 min,吸净培养基,细胞使用无血清培养基培养24 h后制备悬液,取200 μL接种入Transwell上室,下室加入含10% FBS的DMEM高糖培养基,分别使用DMSO和ETC-159处理细胞,培养12 h或24 h后擦去上室细胞和基质胶,下室使用4%多聚甲醛处理20 min,之后使用1%结晶紫染色,镜下观察染色细胞,任选视野计数细胞,每组三孔,每孔6个视野。
1.4 Western blot检测相关蛋白的表达
当细胞生长融合至80%左右时,将其分为三组进行药物处理:DMSO组(即DMSO处理24 h),ETC-159处理12 h组(DMSO处理12 h后加入ETC-159处理12 h),ETC-159处理24 h组(加入ETC-159处理24 h)。处理完成后,弃培养基,PBS洗涤,加入RIPA裂解液4℃裂解15 min,刮取细胞,超声裂解后离心取上清,将上清液与样品缓冲液(50 mmol/L Tris·HCl(pH 7.6)、2%SDS、10%甘油、10 mmol/L DTT和0.2%溴酚蓝)混合,煮沸10 min,凝胶电泳分离蛋白质(凝胶分为上部4% SDS-PAGE浓缩胶以及下部10% SDS-PAGE分离胶,电泳浓缩为每块胶恒定电流10 mA,分离则为恒定电压100 V)并转移至PVDF膜(转膜为恒定电流275 mA,时间为1 h),5% BSA封闭30 min,一抗4℃孵育过夜,荧光标记的二抗室温孵育1 h,使用LI-COR公司Odyssey红外荧光扫描成像仪显色,使用Image J软件进行灰度分析,统计均为灰度值相对水平,即各组灰度值/DMSO组。
1.5 统计学方法

2 结果
2.1 ETC-159处理对SCC-15细胞增殖的影响
ETC-159处理12 h和24 h后SCC-15细胞的增殖活性与DMSO组相比均显著性下降,差异具有统计学意义(P<0.05)(表1)。
表1ETC-159处理不同时间后SCC-15细胞增殖活性
Table1Proliferative activity of SCC-15 cells treated with ETC-159 for different time-point
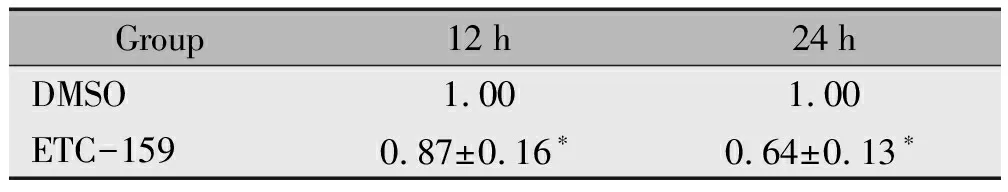
Group12h24hDMSO1.001.00ETC-1590.87±0.16∗0.64±0.13∗
Note:*P<0.05,when compared to the DMSO group.
2.2 ETC-159处理对SCC-15细胞迁移能力的影响
Transwell小室实验观察穿膜细胞数量发现在12 h以及24 h后ETC-159处理组SCC-15细胞的穿膜数量均显著性低于DMSO处理组,差异具有统计学意义(P<0.05)(表2)。
表2ETC-159处理后不同时间点SCC-15细胞穿膜数目
Table2Penetration number of SCC-15 cells treated with ETC-159 for different time-point

Group12h24hDMSO67±9 131±21ETC-15942±7∗ 79±17∗
Note:*P<0.05,when compared to the DMSO group.
2.3 ETC-159处理对SCC-15细胞Wnt信号通路的影响
ETC-159处理12 h组和ETC-159处理24 h组中,SCC-15细胞中Wnt3a和β-catenin蛋白含量均显著性下降,与DMSO组相比差异具有统计学意义(P<0.05)(图1)。
2.4 ETC-159处理对SCC-15细胞Wnt信号通路调节的部分增殖迁移相关蛋白的影响
ETC-159处理12 h组和ETC-159处理24 h组中SCC-15细胞中增殖相关蛋白c-Myc与cyclin D1以及迁移相关蛋白CD146含量均显著性降低,与DMSO组相比差异具有统计学意义(P<0.05)(图2)。

图1 ETC-159处理对SCC-15细胞Wnt信号通路的影响Figure 1 Effects of ETC-159 on the Wnt signaling pathway in SCC-15 cellsNote:A.The results of Western blot;B.Quantitative analysis of the blots(n=3).* P<0.05,when compared to the DMSO group.

图2 ETC-159处理对SCC-15细胞部分增殖迁移相关蛋白的影响Figure 2 Effects of ETC-159 on the levels of c-Myc,cyclin D1,CD146 and DM1A in SCC-15 cellsNote:A.The results of Western blot;B.Quantitative analysis of the blots(n=3).* P<0.05,when compared to the DMSO group.
3 讨论
Wnt信号通路的异常是多种恶性肿瘤的生物学特征,并且在许多癌症类型肿瘤的发生和转移中起到重要作用[3]。在口腔鳞状细胞癌中,Wnt蛋白下游信号β-catenin膜表达的丧失可能与其预后不良相关,并且被认为是口腔鳞状细胞癌复发的生物标志物之一[4-5]。同时,DNA甲基化的表观遗传学沉默导致的Wnt拮抗相关蛋白(包括SFRP-2,WIF-1,DKK-1,DACH1和RUNX3)表达变化可能与口腔鳞状细胞癌的发生以及复发有着显著性的关联[6]。这些均提示Wnt信号通路可能参与口腔鳞状细胞癌的发生。另外,Wnt信号负调控因子Dickkopf-1(Dkk1)的抑制能增加口腔鳞状癌细胞的增殖和迁移[7],而长非编码RNA MEG3可通过抑制Wnt/β-catenin信号通路减少口腔鳞癌细胞的增殖和转移[8]。因此,Wnt信号通路的抑制可能是口腔鳞状细胞癌治疗的一个有效的策略。
增殖和迁移能力的增加是肿瘤细胞最显著的生理特征,也是影响其预后的重要因素,而能否对其进行抑制则是肿瘤治疗药物的重要指标[9]。Wnt信号通路可通过调节多种蛋白表达进而影响细胞的增殖和迁移,其中c-Myc是首个确认受Wnt信号通路调节的原癌基因,参与癌细胞的增殖调控、分化和凋亡,cyclin D1则是调节细胞进入增生期的细胞周期蛋白,Wnt信号通路能通过增加它们的表达从而促进肿瘤细胞增殖,而CD146则是一种具备跨膜结构的细胞黏附因子,Wnt信号通路已被证明在多种肿瘤细胞中通过激活其表达促进肿瘤细胞的迁移[10-12],而在口腔鳞癌细胞中也发现了这些蛋白的表达[13-15]。
ETC-159是一种强效的口服PORCN抑制剂,能通过阻断Wnt蛋白的脂肪酰基修饰抑制其分泌,进而抑制Wnt信号通路[2]。同时ETC-159已被证明在结直肠癌细胞中能有效抑制Wnt家族蛋白的表达进而削弱Wnt信号通路最终抑制其增殖和迁移[2]。提示ETC-159可能通过抑制Wnt信号通路降低口腔鳞癌细胞的增殖和迁移能力进而对其起到一定的治疗效果。
本研究发现,ETC-159处理12 h和24 h后SCC-15细胞的增殖活性与DMSO组相比均有明显的降低,使用Transwell小室观察到ETC-159处理后SCC-15细胞迁移能力也显著性降低,这些结果提示,ETC-159能有效抑制SCC-15细胞的增殖和迁移。ETC-159处理12 h组与24 h组中,Wnt家族蛋白Wnt3a含量均显著性降低,进一步提示ETC-159能够抑制Wnt蛋白在SCC-15细胞中的表达,而Wnt蛋白是通过与其受体在细胞膜上的相互作用抑制GSK-3β诱导的β-catenin的磷酸化,从而导致β-catenin在细胞质中的积累,进而激活Wnt信号通路,造成后续的影响[16]。因此,为进一步确认ETC-159对Wnt信号通路的影响,本研究还检测了ETC-159处理12 h和24 h后细胞中β-catenin的含量,发现与DMSO组相比均显著性降低,进一步证明了ETC-159在SCC-15细胞中对Wnt信号通路的抑制。同时我们还发现ETC-159处理12 h和24 h后的SCC-15细胞中,c-Myc、cyclin D1、CD146的含量均显著性降低,也提示我们ETC-159可能通过降低c-Myc、cyclin D1以及CD146的表达抑制SCC-15细胞的增殖和迁移能力。
综上所述,Wnt信号通路抑制剂ETC-159能通过降低c-Myc、cyclin D1以及CD146的水平抑制SCC-15细胞的增殖和迁移,提示ETC-159有可能作为一种新的药物参与口腔鳞状细胞癌的治疗。但是由于体外细胞实验的局限性,ETC-159对口腔鳞状细胞癌的治疗作用是否能在体内达到同样的效果尚未可知,而且ETC-159对机体正常细胞是否具备毒副作用,其体内应用的适宜浓度、制剂方式以及作用的具体分子机制等问题,都有待进一步研究。
1 Hema KN,Smitha T,Sheethal HS,et al.Epigenetics in oral squamous cell carcinoma[J].J Oral Maxillofac Pathol,2017,21(2):252-259.
2 Madan B,Ke Z,Harmston N,et al.Wnt addiction of genetically defined cancers reversed by PORCN inhibition[J].Oncogene,2016,35(17):2197-2207.
3 Polakis P.Wnt signaling in cancer[J].Cold Spring Harb Perspect Biol,2012,4(5):8052.
4 de Aguiar A Jr,Kowalski LP,de Almeida OP.Clinicopathological and immunohistochemical evaluation of oral squamous cell carcinoma in patients with early local recurrence[J].Oral Oncol,2007,43(6):593-601.
5 Mahomed F,Altini M,Meer S.Altered E-cadherin/beta-catenin expression in oral squamous carcinoma with and without nodal metastasis[J].Oral Dis,2007,13(4):386-392.
6 Paluszczak J,Sarbak J,Kostrzewska-Poczekaj M,et al.The negative regulators of Wnt pathway-DACH1,DKK1,and WIF1 are methylated in oral and oropharyngeal cancer and WIF1 methylation predicts shorter survival[J].Tumour Biol,2015,36(4):2855-2861.
7 Ogoshi K,Kasamatsu A,Iyoda M,et al.Dickkopf-1 in human oral cancer[J].Int J Oncol,2011,39(2):329-336.
8 Liu Z,Wu C,Xie N,et al.Long non-coding RNA MEG3 inhibits the proliferation and metastasis of oral squamous cell carcinoma by regulating the WNT/beta-catenin signaling pathway[J].Oncol Lett,2017,14(4):4053-4058.
9 王睿,余成欢,方杰.miR-409-5p对肝癌细胞系HepG2增殖及迁移的影响[J].实用肿瘤学杂志,2017,31(4):305-309.
10 Lee KB,Jin H,Ye S,et al.Recombinant human bone morphogenetic protein-2 inhibits gastric cancer cell proliferation by inactivating Wnt signaling pathway via c-Myc with aurora kinases[J].Oncotarget,2016,7(45):73473-73485.
11 Zhang J,Gill AJ,Issacs JD,et al.The Wnt/beta-catenin pathway drives increased cyclin D1 levels in lymph node metastasis in papillary thyroid cancer[J].Hum Pathol,2012,43(7):1044-1050.
12 Ye Z,Zhang C,Tu T,et al.Wnt5a uses CD146 as a receptor to regulate cell motility and convergent extension[J].Nat Commun,2013,4:2803.
13 Pérez-Sayáns M,Suárez-Pearanda JM,Padín-Iruegas E,et al.Quantitative determination of c-myc facilitates the assessment of prognosis of OSCC patients[J].Oncol Rep,2014,31(4):1677-1682.
14 Zhao Y,Yu D,Li H,et al.Cyclin D1 overexpression is associated with poor clinicopathological outcome and survival in oral squamous cell carcinoma in Asian populations:insights from a meta-analysis[J].PLoS One,2014,9(3):e93210.
15 Abou Asa S.Immunohistochemical expression of MCAM/CD146 in canine melanoma[J].J Comp Pathol,2017,157(1):27-33.
16 Gonzalez-Moles MA,Ruiz-Avila I,Gil-Montoya JA,et al.beta-catenin in oral cancer:an update on current knowledge[J].Oral Oncol,2014,50(9):818-824.
