SRC1在胃癌中的表达及其与预后的关系
2018-06-06薛英威
姚 强 王 宽 薛英威
胃癌是消化道最常见的恶性肿瘤之一,胃癌的发病率在我国排第2位,世界排第5位。国际癌症研究中心(IARC)数据显示全球新发胃癌占所有新发肿瘤的6%~8%[1-3],而所有新发胃癌病人当中,中国占比大约达到了42%。中国胃癌的发病率在所有恶性肿瘤中排在第2位,死亡率排在第3位,并且目前仍然呈现上升趋势[4]。1995年,Onate等利用人体B淋巴细胞cDNA文库内的酵母双杂交系统的PR-LBD作为诱导物成功克隆出一种蛋白质,并证实其可以在不改变启动子活性的情况下增强PR、ER、AR等多种类固醇受体的转录活性,将其命名为类固醇受体辅助活化因子-1(Steroid receptor coactivator 1,SRC1)。在随后的研究中,人们又进一步发现了SRC1的两种同源蛋白,即SRC2和SRC3。SRC家族是众多的辅助激活因子中较为重要的一类,它们的基因分别定位于人类染色体2p23、8q21和20q12。它们以配体依赖的形式与核受体相互作用,通过受体的甲基化或乙酰基化以及其他一些辅助因子的参与来提高核受体基因的转录活性。随着研究的深入,SRC家族在生物体中的表达、分布、功能及其在某些疾病的临床治疗中的作用日益受到科研工作者的关注。
1 材料与方法
1.1 临床资料
选取2008年哈尔滨医科大学附属肿瘤医院进行胃癌手术病人36例。所有病人术前均未接受过化疗、放疗或其它抗肿瘤治疗,术前均已获得明确病理诊断,术后病理再次确诊为腺癌,有明确的病理分期,共纳入36对癌变和匹配相邻的正常非癌性胃黏膜组织。手术切除后,新鲜组织立即浸入RNAlater(Ambion,Inc,USA),然后在-80℃冰箱保存,直到进行RNA和蛋白质提取。本研究已通过哈尔滨医科大学附属肿瘤医院医学伦理审批并取得患者知情同意。
1.2 胃癌组织中SRC1mRNA的提取、逆转录及qRT-PCR反应
胃癌/配对癌旁正常组织匀浆:约0.1 g胃癌/配对癌旁正常胃组织加入1 mL Trizol,用电动匀浆器匀浆。加入氯仿分层,转移水相,置入无酶EP管中,加入500 μL异丙醇,离心,弃上清液,向沉淀中加入75%乙醇,离心弃上清液,加入DEPC水。测定RNA纯度,进一步逆转录cDNA:总RNA 2 μL加DEPC水68 μL至70 μL,稀释35倍。使用ABI逆转录试剂盒,按说明书依次加入反应体系。cDNA样本取出后-20℃保存。实时定量PCR:在96孔板中,依次加入以下成分,Mix(Rox)5 μL,引物F 0.15 μL,引物R 0.15 μL(上海英潍捷基有限公司合成,5′GCCAUUACCAGGAUAUAAATT3′-正向,5′UUUAUAUCCUGGUAAUGGCTT3′-逆向),三蒸水3.7 μL,cDNA 1 μL,每个样品设两个复孔。封膜,离心,完毕后将孔板转移至PCR仪中,反应条件:95℃10 min,95℃30 s,60℃15 s,95℃15 s。共40个循环。
1.3 Western blot方法检测胃癌组织中SRC1蛋白表达
组织总蛋白的提取:100 mg组织加入1 mL RIPA裂解液匀浆裂解,离心,吸取上清液进行蛋白浓度测定。制胶,上样及电泳:各孔等量上样(50 μg),5 μL蛋白Marker。120 V,30 min至浓缩胶,100 V,60 min至分离胶底部0.5 cm时,停止电泳。转膜:剪取合适大小的PVDF膜,然后置于转膜液中,放入电转印系统,电转移1 h。印迹:取下PVDF膜,TBST缓冲液洗。加入一抗4℃过夜。去掉一抗后,TBST缓冲液洗,再加入二抗,在保鲜膜上滴好显影液,将膜蛋白面朝下与此液体充分接触混合,放入暗室,化学发光显影。
1.4 免疫组化法检测SRC1蛋白
选取2008年哈尔滨医科大学附属肿瘤医院胃癌组织蜡块共286例,制备切片,脱蜡、水化,抗原修复,加一抗,4℃冰箱过夜。加二抗,室温孵育1 h。DAB显色30 s左右(视染色情况);苏木素复染20 s。酒精梯度浓度脱水、二甲苯透明,中性树胶封片。结果染色阳性判断:SRC1阳性反应物定位于细胞浆中,胞浆中出现明显的棕黄色颗粒为阳性细胞。SRC1免疫组化总评分由阳性细胞率评分(肿瘤细胞阳性细胞所占百分率)和染色强度评分乘积组成。阳性细胞率标准如下:0分,<5%,阴性;1分,5%~25%,分散;2分,25%~50%,局部密集;3分,>50%,弥漫。染色强度评分标准:0分,无染色;1分,弱染色;2分,中度染色;3分,强染色。免疫组化总评分0~9分不等。根据免疫组化总评分可将病例分为两组(高表达组和低表达组)。依据上述方法,本研究中286例患者分为2组(高表达组和低表达组),定义SRC1表达强度的标准如下:“-”,阴性,0~1分;“+”,弱阳性,2~3分;“++”,中度阳性,4~6分;“+++”,强阳性,>6分。因此,SRC1表达为“-”、“+”的患者归为低表达组,表达为“++”、“+++”的患者归为高表达组。
1.5 统计学分析
采用SPSS 18.0软件进行统计学分析,两组间的比较用配对t检验,多组间比较用完全随机设计资料的方差分析,率的比较采用卡方检验。生存分析用Kaplan-Meier法计算,组间比较用Log-Rank法检验,多因素分析采用Cox比例风险回归模型,P<0.05为差异有统计学意义。
2 结果
2.1 SRC1 mRNA在胃癌组织中的表达
与癌旁正常组织相比,胃癌组织中的SRC1 mRNA水平显著下调,两者表达差异具有统计学意义(P=0.004)(图1)。
2.2 SRC1蛋白在胃癌组织和细胞中的表达
SRC1蛋白产物出现在160 kDa处。以β-actin为内参对照,SRC1在胃癌组织中的表达明显低于癌旁正常组织的表达(图2)。

图1 胃癌组织和对应癌旁组织中SRC1 mRNA的表达Figure 1 The mRNA expression of SRC1 in gastric cancer tissues(Tumor)and adjacent non-tumor tissues(Normal)

图2 胃癌组织(T)与癌旁组织(N)中的SRC1蛋白的表达Figure 2 The expression of SRC1 protein in gastric cancer tissues(T)and adjacent tissues(N)
2.3 SRC1蛋白在胃腺癌石蜡组织切片中的表达
采用免疫组化方法检测了哈尔滨医科大学附属肿瘤医院286例胃腺癌及癌旁正常组织中SRC1的表达情况。SRC1蛋白在胃癌组织中的表达水平明显低于正常胃黏膜的表达水平。按照表达程度把这些结果分为相对高表达组(简称高表达)与相对低表达组(简称低表达)。其中158例肿瘤组织中的SRC1为高表达(+++/++),128例为低表达(+/-)。正常胃黏膜组织显示SRC1为强阳性(+++)(图3)。
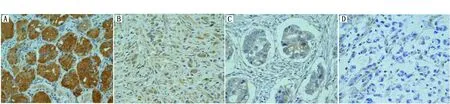
图3 免疫组化检测SRC1蛋白在胃癌和癌旁正常组织的表达Figure 3 The expression of SRC1 protein in gastric cancer and adjacent normal tissues was detected by immunohistochemistryNote:A.Normal gastric tissue SRC1(+++);B.Gastric cancer tissue(++);C.Gastric cancer tissue(+);D.Gastric cancer tissue(-)×200.
2.4 SRC1蛋白表达与胃腺癌临床病理特征的相关性
根据免疫组化SRC1的表达强度,分析其表达与胃癌病人年龄、性别、肿瘤位置、肿瘤浸润程度T、淋巴结是否转移N、远处转移M、肿瘤大小等临床病理特征的关系(表1)。然而,通过χ2检验,本研究发现SRC1蛋白的表达强度与胃癌病人临床病理特征无显著关系。
2.5 SRC1蛋白表达与胃腺癌患者的预后关系
本研究将免疫组化结果按不同表达程度分为低表达和高表达,低表达组中位生存时间为34.271月,95%CI:30.475~38.067(月),5年生存率为39.06%。高表达组中位生存时间为41.677月,95%CI:38.575~44.760(月),5年生存率为50.63%。Kaplan-Meier生存曲线分析发现高表达SRC1组5年生存率高于低表达组(P=0.009)(图4)。单因素Cox风险回归模型发现低表达SRC1、肿瘤侵袭T4a~T4b、淋巴结转移N、远处转移M1是影响总生存时间的危险因素(表2)。多因素Cox回归分析结果显示低表达SRC1、肿瘤侵袭T4a~T4b、淋巴结转移N、远处转移M1是独立的影响总生存时间的不良因素。结果显示:T高分期为危险因素,T4期患者死亡的风险是T1~T3期患者的1.806倍(HR=1.806,95%CI:1.203~2.713,P=0.004);N淋巴结转移为危险因素,有淋巴结转移患者死亡的风险是无淋巴结转移患者的1.644倍(HR=1.644,95%CI:1.027~2.631,P=0.038);M高分期为危险因素,M1分期患者死亡的风险是M0分期患者的4.351倍(HR=4.351,95%CI:2.819~6.717,P<0.001);SRC1相对高表达为保护因素,SRC1相对高表达患者死亡的风险是SRC1低表达患者的0.592倍(HR=0.592,95%CI:0.426~0.822,P=0.002)。总之,这些研究结果表明,在胃癌患者中SRC1蛋白表达水平越低,可能提示预后越差。
表1SRC1蛋白表达与胃腺癌临床病理参数之间的关系
Table1Relationship between the expression of SRC1 protein and clinicopathological parameters of patients with gastric cancer

VariablesLow(n=128)High(n=158)PAge(years)0.821<607388≥605570Gender0.501Male81106Female4752Tumor location0.323Distant88117Proximal4041Tumor infiltration0.059T1^T34573T4a^T4b8385Lymph metastasis0.482Negative3841Positive90117Distant metastasis0.436M0117140M11118Tumor size0.281<5cm7785≥5cm5173

图4 胃腺癌患者SRC1高表达组与SRC1低表达组5年生存率比较Figure 4 The 5-year survival rate in the SRC1 overexpression group was significantly higher than that in the SRC1 low expression group

表2 单因素和多因素分析SRC1与临床病理因素在胃癌预后中的作用
3 讨论
胃癌约68%的治疗主要以手术治疗为主,其他综合治疗为辅。进展期胃癌病人发生淋巴结转移,常规治疗后5年生存率约为30%左右。早期胃癌病人通过外科手术治疗效果相对理想,其5年生存率可以达到50%~69%。近些年我国各地胃癌发病率有明显上升趋势,发病人数剧增给广大群众带来巨大痛苦,给国家带来沉重负担。加强对胃癌发生发展的研究,寻找与胃癌相关的生物学指标,将有助于胃癌的诊疗。早发现、早诊断和早治疗对于控制病情,减少死亡和经济负担有着重要意义。胃镜检查是早期发现胃癌的主要方法,但由于是侵入性检查,大部分人群较为抵触,不易用于筛查。因此寻找肿瘤分子标志物来早期诊断胃癌具有重要意义。
已经确定了三个SRC家族成员,SRC1、SRC2和SRC3。最初发现SRC1与ER、PR相关[5],研究发现SRC1通过多种核受体如ER、PR、GR、NF-κB[6]和AP-1介导的转录事件发挥功能[7]。GR和ER配体结合域的相互作用导致了SRC2发现[8]。SRC3在人类乳腺癌的细胞系中,对PR、GR和ER、cAMP调节元素结合蛋白等作用[9]。总之,在许多正常组织如心脏、脑、肝脏、肺、乳腺、胰腺等组织细胞中都可检测到SRC的表达[10]。
SRC1在肿瘤细胞增殖侵袭信号通路中扮演着重要角色。在本课题中,我们研究发现SRC1在胃癌组织中明显下调。在5种胃癌细胞系与正常胃黏膜细胞系的对比中也表现出同样的表达趋势。尽管尚未发现SRC1的表达强度与胃癌患者临床病理特征有显著的关系,不过我们的多变量分析结果提示SRC1的表达下调、肿瘤侵袭(T)、淋巴结转移(N)、远处转移(M)与胃腺癌患者预后有着明显的相关性,即SRC1低表达者比表达高者预后差。通过Kaplan-Meier生存分析,SRC1低表达组的五年生存期明显低于高表达组。这也提示SRC1可能是一种抑癌基因,其在胃癌中的作用机制仍需更深入的研究。我们已经提前做了细胞差异表达分析,后续将进一步在机制上深入开展研究。SRC1在正常乳腺上皮细胞中不表达,但在乳腺癌细胞中可检测到SRC1蛋白高水平表达[11]。SRC1以多种方式参与乳腺癌细胞的增殖,其过表达促进雌二醇表达,而雌二醇刺激癌细胞生长,这说明SRC1可能是通过雌二醇介导发挥重要作用[12]。SRC1在前列腺癌组织中的表达水平目前还难以明确,一直存在着较大争议。Xu等[10]认为SRC1在前列腺癌的表达与癌症进展程度呈负相关,但Mori等[13]却发现SRC1与前列腺癌生长之间不存在相关性。不过Agoulnik等[14]发现,SRC1可增强AR在雄激素依赖或非依赖途径中的功能,进而促进前列腺癌的生长。此外,Tien等[15]发现,SRC1在前列腺癌发生过程中的蛋白水平恒定。
除了在类固醇依赖性癌症如乳腺癌、前列腺癌和子宫内膜癌中表达外,SRC1也在类固醇非依赖性癌症如星形细胞瘤和黑色素瘤中表达[16]。进一步的研究表明,甲状腺癌、子宫内膜癌、黑色素瘤的SRC1的表达水平均明显升高[12],上述癌症中的表达及作用机制尚不明确,有待进一步的研究。
综上所述,SRC1在胃癌组织中存在基因和蛋白低表达的现象,其表达情况与胃癌的发生发展和转移存在相关性。总之,这是第一次报道SRC1的低表达与胃腺癌的预后相关。我们观察到了SRC1可能是胃癌的抑癌基因和预后基因,并且希望可能作为一个治疗靶点应用于胃腺癌的靶向治疗中。
1 季加孚.我国胃癌防治研究三十年回顾[J].中国肿瘤临床,2013,40(22):1345-1351.
2 IARC.All cancers(excluding non-melanoma skin cancer)estimated incidence,mortality and prevalence worldwide in 2012.http://globocan.iarc.Fr/Pages/fact_sheets_cancer.aspx.
3 Herrero R,Park JY,Forman D.The fight against gastric cancer-the IARC Working Group report[J].Best Pract Res Clin Gastroenterol,2014,28(6):1107-1114.
4 中华人民共和国国家卫生和计划生育委员会.http://www.moh.gov.cn/zwgkzt/tjnj/list.
5 Onate SA,Tsai SY,Tsai MJ,et al.Sequence and characterization of a coactivator for the steroid hormone receptor superfamily[J].Science,1995,270(5240):1354-1357.
6 Na SY,Lee SK,Han SJ,et al.Steroid receptor coactivator1 interacts with the p50 subunit and coactivates nuclear factor kappa B-mediated transactivations[J].J Biol Chem,1998,273(18):10831-10834.
7 Lee SK,Kim HJ,Na SY,et al.Steroid receptor coactivator-1 coactivates activating protein-1-mediated transactivations through interaction with the c-Jun and c-Fossubunits[J].J Biol Chem,1998,273(27):16651-16654.
8 Hong H,Kohli K,Trivedi A,et al.GRIP1,a novel mouse protein that serves as a transcriptional coactivator in yeast for the hormone binding domains of steroid receptors[J].Proc Natl Acad Sci U S A,1996,93(10):4948-4952.
9 Xu J,O′Malley BW.Molecular mechanisms and cellular biology of the steroid receptor coactivator(SRC)family in steroid receptor function[J].Rev Endocr Metab Disord,2002,3(3):185-192.
10 Carapeti M,Aguiar RC,Chase A,et al.Assignment of the steroid receptor coactivator1(SRC1)gene to human chromosome band 2p23[J].Genomics,1998,52(2):242-244.
11 Wang Y,Lonard DM,Yu Y,et al.Small molecule inhibition of the steroid receptor coactivators,SRC-3 and SRC-1[J].Mol Endocrinol,2011,25(12):2041-2053.
12 Zhang D,Guo Q,Bian C,et al.Alterations of steroid receptor coactivator-1(SRC-1)immunoreactivities in specific brain regions of young and middle-aged female Sprague-Dawley rats[J].Brain Res,2011,1382:88-97.
13 Mori R,Wang Q,Quek ML,et al.Prognostic value of the androgen receptor and its coactivators in patients with D1 prostate cancer[J].Anticancer Res,2008,28:425-430.
14 Agoulnik IU,Vaid A,Bingman WE,et al.Role of SRC-1 in the promotion of prostate cancer cell growth and tumor progression[J].Cancer Res,2005,65(17):7959-7967.
15 Tien JC,Zhou S,Xu J.The role of SRC-1 in murine prostate cancinogenesis is nonessential due to a possible compensation of SRC-3/AIB1 overexpression[J].Int J Biol Sci,2009,5(3):256-264.
16 De Blacam C,Byrne C,Hughes E.HOXC11-SRC-1 regulation of S100β in cutaneous melanoma:new targets for the kinase inhibitor dasatinib[J].Br J Cancer,2011,105(1):118-123.
