头臂干夹层致脑梗死1例
2018-06-06敬佩凤陈秋惠张医芝
敬佩凤,陈秋惠,张医芝,张 颖
(吉林大学第二医院神经内科,长春 130041;*通讯作者,E-mail:chen_qiuhui@126.com)
脑动脉夹层(cerebral arterial dissection,CAD)又称脑动脉剥离,是指由于血管内皮、内膜或内弹性膜撕裂,在强有力的血液冲击下,循环血液流入其间隙,可位于内膜或外膜下,前者可继发血管狭窄闭塞导致脑梗死,后者则易导致管腔扩张形成动脉瘤[1]。颅内及颅外动脉均可发生,而其中头臂干夹层引起的脑梗死比较少见,在此报道1例头臂干夹层引起的脑梗死。
1 病例资料
患者,男性,68岁,农民,于2017年5月10日因头晕、视物模糊、记忆力下降2 d入院。患者于入院前2 d无明显诱因出现头晕,昏沉感,伴有双眼视物模糊,并有记忆力下降、走路不稳。病程中无头痛、意识障碍、饮水呛咳、吞咽困难及肢体活动不灵。既往有高血压病病史5年余,否认糖尿病病史。有长期饮酒史,否认吸烟史。入院时查体:血压180/86 mmHg,心肺听诊无明显异常。神经系统查体:意识清楚,言语流利,少言,概测定向力、记忆力、计算力均减退。双眼视力指数/20 cm,四肢肌张力及肌力正常。右侧肢体指鼻试验及跟膝胫试验欠稳准,余神经系统查体未见异常。影像学检查:头部磁共振+弥散加权成像(2017-6-5)示:脑干、右侧小脑、双侧颞叶、双侧枕叶、双侧基底节、双侧放射冠、双侧丘脑及半卵圆中心可见多发斑点状长T1长T2信号影,DWI显示右侧小脑、双侧颞、枕叶、右侧丘脑多发斑片状高信号影,ADC呈低信号(见图1A,B,C)。头颈动脉计算机断层扫描血管造影(computed tomography angiography,CTA)示:头臂干管壁见非钙化斑块形成,管腔狭窄,局部呈双腔改变(见图1D,E)。右侧椎动脉起始部及颅内段管壁见非钙化斑块形成,起始部管腔中度狭窄(见图1F),左侧椎动脉开口于主动脉弓、未汇入基底动脉(见图1G)。双侧大脑前动脉A2段局部管腔中重度狭窄,右侧大脑后动脉局部P2段以及远端管腔未见造影剂充盈,左侧颈总、颈外、颈内动脉可见多发斑块形成,管腔轻度狭窄。颈部动脉血管彩超示:头臂干内径2.0 cm,头臂干起始部内膜增厚,可见厚约0.43 cm的半环状斑块形成,近端可见厚0.29 cm,长约2.3 cm的条带状回声,随血流飘动,其基底部似附着于前壁。右侧椎动脉起始部狭窄30%-50%。实验室检查:尿常规示潜血(+++)。血脂示:甘油三酯2.75 mmol/L,总胆固醇4.25 mmol/L,低密度脂蛋白胆固醇3.00 mmo/L。血常规、凝血常规、血糖、肾功、肝功、离子、同型半胱氨酸、心肌酶学、心肌损伤标志物、BNP、尿常规、便常规、甲功三项等均未见异常。心电图:窦性心律、正常心电图。结合患者病史、体征、辅助检查,诊断为脑梗死(基底动脉尖综合征)、头臂干夹层、高血压病3级(极高危险组)、高脂血症、动脉粥样硬化、大脑前动脉狭窄、椎动脉狭窄。治疗上予以减轻脑水肿、抗血小板聚集、改善循环、清除自由基、靶向扩血管及支持治疗。患者住院后病情逐渐好转,住院14 d已无头晕症状,语言交流及定向力恢复正常、记忆力、计算力较入院时明显改善,视力左眼0.5、右眼0.8,共济运动检查正常。住院期间建议患者进一步行DSA以指导下一步治疗,但患者及家属表示拒绝。
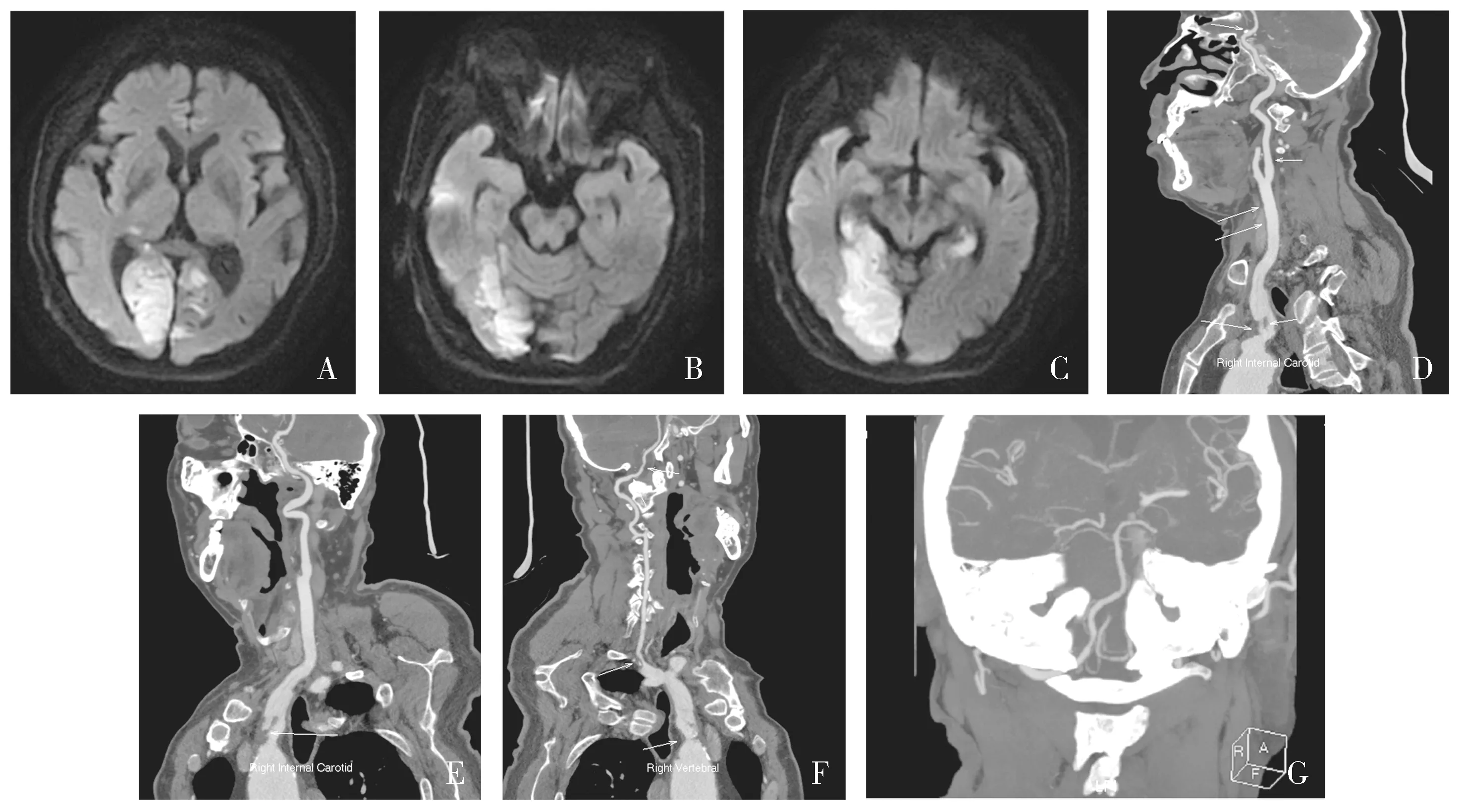
A,B,C.头颅MRI示右侧小脑、双侧颞、枕叶、右侧丘脑梗死(新发病灶);D,E.头颈CTA示头臂干狭窄,局部呈双腔改变;F.头颈CTA示右侧椎动脉起始部中度狭窄;G.头颈CTA示左侧椎动脉未汇入基底动脉图1 头臂干夹层致脑梗死患者头颅MRI与头颈CTA影像表现
2 讨论
脑梗死的常见病因是动脉粥样硬化,其次包括各种栓子随血流进入脑动脉阻塞血管,血管炎、血管发育异常、动脉夹层等等。其中动脉夹层引起的脑梗死罕见。而动脉夹层是中青年脑梗死的重要原因之一[2],老年人尤其少见。根据发病部位可分为颅内动脉夹层及颅外动脉夹层,其中颅外段动脉更易发生夹层,颅外段血管中,颈内动脉较椎动脉发生夹层的可能性更大。根据假腔所在位置可分为内膜下夹层、外膜下夹层、混合型、单纯壁内血肿四种类型。根据病因可分为自发性与继发性(开放性)两大类。自发性夹层的病因有动脉粥样硬化、肌纤维发育不良、马方综合征、弹力纤维性假黄瘤、妊娠产后等。而继发性夹层的主要原因为外伤、外部机械损伤。国内外文献报道颈动脉夹层及椎动脉夹层绝大多数为自发性,少数为外伤、颈椎按摩或运动后诱发[3,4]。CAD好发于颈内动脉颅外段,主要是因为该段血管在颈部活动度大,易受附近骨性结构或外力损伤[5]。CAD的发病机制目前尚未完全明确,研究表明,高血压、糖尿病、动脉粥样硬化、高同型半胱氨酸血症、偏头痛、感染、分娩、CAD家族史、口服避孕药等可能是CAD的危险因素[6-8],而夹层动脉瘤的患者高血压的发生率高达50%,提示高血压病在夹层形成中起一定作用[3]。
脑动脉夹层的常见临床表现为头痛、Horner征及局灶性脑缺血症状,其次可有耳鸣、颅神经麻痹等症状[2]。大部分患者在头痛症状后数天发生卒中,2周内症状呈反复性[9]。CAD可通过两种机制致缺血性脑卒中:①血管内膜破裂局部形成血栓,脱落后造成动脉源性栓塞;②血管壁内血肿形成导致局部管腔重度狭窄甚至闭塞,造成远端低灌注性缺血事件[10]。其中以第一种机制最常见。该患者考虑为第二种机制导致脑梗死。本病例中,该患者并无动脉夹层造成的头痛表现,容易漏诊,在入院后查头颈部CTA意外发现患者有头臂干夹层伴血管狭窄,且对侧椎动脉发育异常未加入基底动脉,无基底动脉狭窄而出现基底动脉尖综合征。
CAD可引起蛛网膜下隙出血(subar achnoid hemorrhage,SAH)、脑动脉缺血等致命症状,因此CAD的诊断具有重要的临床意义。CAD的诊断有赖于血管超声及影像学检查,其中DSA在目前仍被公认为诊断动脉夹层的金标准。在DSA上的表现包括:①双腔征:是诊断动脉夹层分离最可靠的征象;②动脉膨大:纺锤形或玫瑰花样膨大;③串珠征:管腔膨大与狭窄并存;④鼠尾征或线样征:管腔狭窄或闭塞;⑤对比剂滞留。DSA虽被认为是诊断夹层的金标准,但出现“双腔征(与原管腔平行的血流轨迹)”或“静脉期对比剂滞留”直接征象的概率较小,其中,双腔征在患者中出现此种改变的比例低于10%[11]。而以纺锤形膨大和串珠征最为多见。但DSA不能直观地显示动脉壁情况,看不到壁内血肿[12]。而且DSA价格高、耗时长,且为侵入性检查,存在一定风险。与DSA比较,CTA有着操作简便,耗时短的优点。CTA的轴位上可见“靶征”或“双腔征”,还可发现包括动脉狭窄、闭塞、夹层动脉瘤、管壁增厚,甚至破损掀起的内膜。而MRA也可看到“偏心性狭窄”或“双腔征”,但准确性较CTA低[13]。MRI可以直接看到血管壁间血肿,也是诊断颈部血管夹层不错的方法。轴位脂肪抑制像可以看到夹层的血管壁间呈“新月形”的偏心高信号。但是可能会受颈部骨骼及血管弯曲程度的影响,产生假的新月体。另外,血肿不同时期在T1上出现的信号强度也会变化,干扰对夹层的早期诊断[14]。彩色多普勒超声检查具有无创、简洁的优点,可发现动脉夹层真假双腔样特征性改变,还可发现是否存在局限性狭窄及血流速度改变[15]。本病例是以急性脑梗死为主要临床表现的头臂干夹层,十分少见。结合该患者既往有长期高血压病史,以及头颈部CTA及血管彩超提示该患者的头臂干管壁见非钙化斑块形及内膜增厚,因此考虑由动脉粥样硬化引起的夹层,该头臂干夹层及右侧椎动脉起始部存在狭窄,且左侧椎动脉存在先天走行变异,未汇入基底动脉,从而导致了基底动脉尖发生缺血表现,从而引起了右侧小脑、双侧颞叶、枕叶、右侧丘脑的急性梗死。
目前对于脑动脉夹层的治疗尚未达成共识。欧洲动脉夹层和缺血性脑卒中患者试验推荐在以下情况首选抗凝[16]:包括血管闭塞、抗血小板聚集治疗后仍病情反复、管腔内有活动性栓子。除以上情况下应用抗血小板聚集药物[17]。2010年美国心脏协会/美国卒中协会的缺血性卒中防治指南推荐抗凝和抗血小板聚集治疗均可应用于颈部动脉夹层[18]。目前,对于内科治疗效果不好,存在夹层动脉瘤逐渐扩大,伴有明显血流动力学障碍的情况,可考虑介入支架置入术[19]。该患者治疗上给予抗血小板聚集治疗后,临床症状稳定,并逐渐好转,因该患者及家属拒绝进一步行DSA检查及进一步介入治疗,并未给予血管内处理。另外对于血栓栓塞所致缺血症状可以选择溶栓,但存在腔内血肿扩大、动脉瘤形成、血管破裂、血栓移位的风险,因此,溶栓治疗夹层要慎重。
动脉夹层是青年梗死的重要原因,但并不意味着老年患者中不存在。众所周知,CAD存在出血的高危风险,可危及生命,其中颅内段血管夹层因多为动脉瘤样改变而出血率高,非创伤性颅内动脉夹层的分布为53.3%位于前循环,46.7%位于后循环,83.3%的患者罹患SAH[20]。因此治疗上与单纯动脉硬化血管闭塞有所不同,预后也有所不同,其中颅内段动脉夹层致死率及致残率较高,生存者中半数遗留较严重神经功能缺失症状[15]。因此应重视病史采集、全面详细的体格检查、完善相关检查,尽早发现CAD伴有缺血性脑卒中是十分重要的,有助于风险评估以及病情的告知,同时针对夹层的治疗,有利于预防脑梗死的复发、减少动脉夹层出血的发生。
参考文献:
[1] Schievink WI. Spontaneous dissection of the carotid and vertebral arteries[J].N Engl J Med,2001,344:898-906.
[2] Fusco MR,Harrigan MR.Cerebrovascular dissections-a review part I spontaneous dissections[J].Neurosurgery,2011,68:242-257.
[3] 王志敏,王鹏.缺血性脑卒中的另一个重要危险因素:原发性颈内动脉夹层分离[J].中风与神经疾病杂志,,2009,26(1):104-105.
[4] 雷蕾,杨觅,何俐.自发性椎动脉夹层临床特点及预后分析[J].华西医学,2010,25(9):1611-1614.
[5] 刘礼斌.颈动脉夹层致脑梗死1例报告[J].山东医药,2014,54(22):89-90.
[6] Guillon B,Berthet K,Benslamia L,etal.Infection and the risk of spontaneous cervical artery dissection:a case-control study[J].Stroke,2003,34(7): 79-81.
[7] Caso V,Cardaioli G,Gallai V,etal. Vertebral artery dissection and hyperhomocysteinemia:a case report[J].Cerebrovasc Dis,2000,10(4):9-11.
[8] Pezzini A,Granella F,Grassi M,etal. History of migraine and the risk of spontaneous cervical artery dissection[J].Cephalalgia,2005,25(8):575-580.
[9] 马廉亭.颅内动脉夹层与夹层动脉瘤的诊断与治疗[J].中国临床神经外科杂志,2008,13(10):577-578.
[10] Redekop GJ. Extracranial carotid and vertebral artery dissection: a review[J]. Can J Neurol Sci,2008,35(2):146-152.
[11] Flis CM,Jager HR, Sidhu PS. Carotid and vertebral artery dissections:clinical aspects,imaging features and endovascular treatment[J].Eur Radiol,2007, 17:820-834.
[12] Sikkema T,Uyttenboogaart M,Eshghi O,etal. Intracranial artery dissection[J].Eur J Neurol,2014,21:820-826.
[13] 石际俊.脑动脉夹层的临床特点研究[J].J Clin Neurol,2014,27(3):186-188.
[14] 杨博文,许岗勤.椎基底动脉夹层动脉瘤诊断与治疗研究进展[J].中华实用诊断与治疗杂志,2015,29(5):432-434.
[15] 王学廷.脑动脉夹层近期研究概述[J].实用医药杂志,2013,30(9):855-856.
[16] 欧洲卒中组织(ESO)执行委员会和ESO写作委员会,王玉洁,白璇.缺血性卒中和短暂性脑缺血发作处理指南2008[J].国际脑血管病杂志,2008,2(6):401-440.
[17] Kim YK,Schulman S.Cervical artery dissection:pathology epidemiology and management[J].Thromb Res,2009,123:810-821.
[18] Georgiadis D, Arnold M, von Buedingen HC,etal. Aspirin vs anticoagulation in carotid artery dissection:a study of 298 patients[J].Neurology, 2009,72:1810-1815.
[19] Jeon P, Kim BM, Kim DI,etal. Emergent selfexpanding stent placement for acute intracranial or extracranial internal carotid artery dissection with significant hemodynamic insufficiency[J]. Am J Neuroradiol, 2010, 31:1529-1532.
[20] 王守春.脑动脉夹层的诊断与治疗[J].中国实用内科杂志,2014,34(5):460-461.
