下调MMSA-8基因对骨髓瘤细胞RPMI8226增殖和侵袭能力的影响
2018-06-06张王刚张鹏宇李军辉
何 蕊,张王刚,杨 楠,刘 捷,张鹏宇,李军辉
(1西安交通大学第二附属医院肿瘤病院,西安 710004;2西安交通大学第二附属医院血液科;3西安交通大学第二附属医院普外科;*通讯作者,E-mail:zhangwanggang2003@yahoo.com)
多发性骨髓瘤(multiple myeloma,MM)是一种伴随免疫损害的克隆性浆细胞异常增生性疾病[1]。目前,本病已经上升为常见血液系统恶性肿瘤的第二位,因此死亡的患者占血液恶性肿瘤死亡患者的15%-20%[2,3]。近年来,靶向治疗药物硼替佐米以及免疫抑制剂沙利度胺、来那度胺等药物的出现,很大地改善了多发性骨髓瘤患者的预后[4-6]。由于骨髓瘤细胞增殖比例很低,多药耐药的形成,多发性骨髓瘤的治疗反应较差,迄今仍被认为是难以治愈的疾病,很多骨髓瘤患者仍然面临着疾病复发,进展的风险[7]。MMSA-8是本实验室利用“重组cDNA表达文库血清分析法(serological identification of antigens by recombinant expression cloning, SEREX)”筛选出的一个骨髓瘤相关基因,先前的研究提示MMSA-8基因在多发性骨髓瘤患者中表达水平高于正常人群,此外MMSA-8的表达水平还与疾病状态及预后具有明显相关性[8]。为进一步研究MMSA-8在骨髓瘤发生发展中的作用,本研究采用慢病毒介导的RNA干扰技术下调骨髓瘤细胞RPMI8226的MMSA-8表达水平,观察其对RPMI8226细胞增殖和侵袭能力的影响。
1 材料和方法
1.1 细胞株、质粒及主要试剂
人骨髓瘤细胞RPMI8226购于北京协和细胞中心;质粒pGC-FU-GFP-MMSA-8①、pGC-FU-GFP-MMSA-8②、pGC-FU-GFP-MMSA-8③(购自上海吉凯基因有限公司)。RPMI1640培养基(HyClone公司,美国);胎牛血清(FBS,HyClone公司,美国);Lipofectamine 2000 Reagent(Invitrogen公司,美国);侵袭小室(BD公司,美国);MTT试剂盒(Promega,美国);G418(鼎国生物技术公司,北京);RIPA裂解液(碧云天生物信息研究所,中国);BCA蛋白检测试剂盒(博澳森生物公司,中国);Trizol试剂盒(Invitrogen公司,美国);逆转录试剂盒(Takara,大连,中国);SYBR Green PCR试剂盒(Takara,大连,中国),MMSA-8特异性单克隆抗体(ab111598,Abcam,美国);P53特异性单克隆抗体(Abcam,美国);MDM2特异性单克隆抗体(Abcam,美国);抗β-actin和酶标二抗(博士德,武汉)。
1.2 细胞培养
人骨髓瘤细胞RPMI8226培养于含15%胎牛血清、1%青链霉素的RPMI 1640培养基中。37 ℃、5% CO2培养箱中培养。4-5 d传代1次,取对数生长期细胞进行实验。
1.3 重组载体构建
根据GenBank登录已知基因序列(AY952889),按siRNA的设计原则设计引物。三条干扰序列:①5′-TTAGTCCAGCAAGCAATAGTA-3′;②5′-TAGATTCCTGCAAATTTCATG-3′;③5′-AGAAGGTAGTCAGCCAAGCAC-3′;以上序列均由上海吉凯基因公司设计合成。分别定向克隆入pGC-FU-GFP载体,成为pGC-FU-GFP-MMSA-8①、pGC-FU-GFP-MMSA-8②、pGC-FU-GFP-MMSA-8③,以空载体pGC-FU-GFP(Mock)为对照。
1.4 细胞转染及筛选
取对数生长期的RPMI8226细胞,用15% FBS,不含抗生素的RPMI1640培养基接种于96孔板中,待细胞密度达70%时,进行转染。同时以空载体(Mock)组为阴参组,未做任何处理组为空白组。将2 μl LipofectamineTM2000加入48 μl无血清培养基中混匀(A液),37 ℃孵育5 min,分别将1 μl重组质粒pGC-FU-GFP-MMSA-8①、pGC-FU-GFP-MMSA-8②、pGC-FU-GFP-MMSA-8③和1 μl对照质粒pGC-FU-GFP加入49 μl无血清培养基中混匀(B液),室温孵育5 min。将如上A、B两液混匀,37 ℃孵育20 min。D-Hank’s液洗涤1次,加入2 ml含血清RPIM1640培养基,在加入含有质粒的混合液混匀置培养箱中37 ℃培养4-6 h。离心更换新鲜培养基培养72 h,加入含400 μg/ml G418的培养基筛选阳性克隆。
1.5 Q-PCR检测MMSA-8的mRNA表达水平
RNA干扰后72 h收集细胞,PBS洗涤2-3次,用Trizol提取细胞总RNA,逆转录试剂盒将其逆转录为cDNA。按照SYBR Green PCR试剂盒说明操作,使用ABI RPISM 7500实时定量PCR系统完成Real time PCR反应。内参β-actin上游引物5′-TAGTTGCGTTACACCCTTTCTTG-3′,下游引物5′-TCACCTTCACCGTTCCAGTTT-3′。MMSA-8上游引物5′-ACCCTCGGATACGATAGAAAATG-3′,下游引物5′-CACCACCACGAAGTCTCAACA-3。扩增条件:预变性95 ℃ 3 min,95 ℃ 7 s,57 ℃ 10 s,72 ℃ 20 s,40个循环。
1.6 Western blot检测MMSA-8的蛋白表达水平
RNA干扰后72 h收集细胞,PBS洗涤2-3次,加入细胞裂解液裂解细胞提取总蛋白,用BCA法测定蛋白浓度,进行聚丙烯酰胺凝胶电泳、转膜。用5%脱脂奶粉室温封闭2 h后,加入一抗:特异性抗-MMSA-8抗体1 ∶200(ab111598 Abcam,美国)和β-actin一抗1 ∶2 000,4 ℃孵育过夜,加入二抗1 ∶5 000,摇床温和摇动1 h。加入SuperSignal化学发光盒的液体,Image-Pro Plus图像分析管理系统照相,采用Bandscan软件测定各条带积分光密度IOD值,将各目的条带的灰度值与内参β-actin条带灰度值相比,得到各指标比值。检测P53及MDM2蛋白步骤同上。
1.7 MTT法测定MMSA-8对RPMI8226细胞增殖能力的影响
RNA干扰后72 h,将空白组、阴参组及干扰效果最优组细胞悬浮于RPMI1640完全培养基中,调整细胞密度为1×103个/孔,接种于96孔培养板,每孔200 μl培养液;每孔设3个复孔。于1,2,3,4,5,6,7时检测,每孔加入新配制MTT液(5 mg/ml)20 μl,置于37 ℃、5% CO2培养箱继续培养4 h。弃培养液,每孔加入DMSO 150 μl,室温下振荡5 min,静置10 min。酶标仪492 nm处测定吸光度A值,计算均值,绘制生长曲线。
1.8 流式细胞仪检测细胞周期
使用PI法检测细胞周期。过程:收集1×106个细胞,PBS洗细胞2次,加入1 ml生理盐水制成单细胞悬液。加入预冷的无水乙醇2 ml快速混匀,固定细胞。弃固定液,PBS洗细胞2次,离心去上清,加入PI溶液(20 μg/ml)1 ml,4 ℃避光染色15 min,流式细胞仪分析。
1.9 Transwell侵袭实验检测MMSA-8对RPMI8226细胞侵袭能力的影响
将小鼠成纤维细胞NIH3T3用含10%FBS的RPMI1640培养基培养,当细胞达75%融合度时,用PBS洗瓶3次,换用无血清培养基培养24 h后,离心收集培养液上清,-70 ℃保存备用。用50 mg/L Matrigel处理Transwell小室的聚碳酸滤膜小室底部膜的上室面,在室温下干燥过夜。转染后72 h,将上述三组细胞悬浮于无血清RPMI1640培养基中,计数,取8×104个接种于成胶后的小室上室,下室每孔加入800 μl收集的NIH3T3细胞培养上清液和含20%FBS的RPMI1640的培养基(1 ∶1混合液)。培养24 h后,取出Transwell小室,用棉签擦掉Matrigel基质胶,PBS洗涤3次,95%乙醇固定15 min,结晶紫染色,揭下Transwell小室膜反贴在载玻片上。显微镜(×200)计数穿膜细胞数。
1.10 统计学分析
2 结果
2.1 慢病毒介导的RNA干扰细胞系的构建
对五组转染后的细胞行G418筛选,挑单克隆细胞扩大培养(见图1A,B)。Q-PCR实时定量检测MMSA-8 mRNA的表达水平检测(β-actin为内参基因),结果显示,RNAi1,RNAi2以及RNAi3组的MMSA-8表达水平均低于空白组和阴参组,其中RNAi3组细胞中MMSA-8 mRNA表达水平最低(P<0.05),进一步采用Western blot检测MMSA-8蛋白表达水平,结果显示,shRNA干扰组(RNAi1,RNAi2以及RNAi3)MMSA-8表达水平均低于阴参组和空白组,RNAi3组细胞中MMSA-8蛋白水平最低,差异有统计学意义(P<0.05,见图1C)。说明我们特异性地建立了慢病毒介导的MMSA-8的shRNA干扰细胞系,RNA干扰后的RPMI8226细胞MMSA-8表达水平明显降低。我们用干扰效果最好的RNAi3组细胞进行后续实验。
2.2 MMSA-8 shRNA对RPMI8226细胞增殖能力的影响

图1 稳定转染pGC-FU-GFP-MMSA-8的实验结果Figure 1 Results of cells with stable transfection pGC-FU-GFP-MMSA-8
对空白组、阴参组和干扰效果最好的RNAi3组进行MTT检测,绘制生长曲线,比较不同组细胞的增殖能力。结果显示:空白组、阴参组RPMI8226细胞的生长速度基本一致;而RNAi3组的细胞生长明显变慢,组间差异比较有统计学意义(P<0.05,见图2)。表明MMSA-8的表达下调能够明显地抑制RPMI8226细胞的增殖。
2.3 MMSA-8 shRNA对RPMI8266细胞周期分布的影响
用流式细胞仪分析空白组、阴参组、RNAi3组细胞在培养72 h后细胞周期的改变。结果显示:空白组、阴参组、RNAi3组细胞在培养72 h后,G1期、S期、G2期之间比例在三组细胞间无明显差异(P>0.05,见图3);表明抑制MMSA-8的表达对RPMI8226细胞周期无明显影响。但是,RNAi3组细胞在sub-G1期的比例明显增大(见图3C),这就提示MMSA-8的表达下调可能诱导RPMI8226细胞的凋亡,因为凋亡细胞在细胞周期分析中一般处于sub-G1期。

与空白组、阴参组比较,*P<0.05图2 MMSA-8下调抑制了RPMI8226细胞的增殖Figure 2 Downregulation of MMSA-8 inhibited RPMI8226 cell proliferation

图3 各组RPMI8226细胞各周期时相FCM结果比较Figure 3 Cell Cycle of RPMI8226 cells after different transfection by FCM
2.4 MMSA-8shRNA对RPMI8226细胞侵袭能力的影响
Transwell侵袭实验显示,空白组72 h后穿膜细胞数是26.6±2.18,阴参组细胞穿膜数是25.6±2.49,pGC-FU-GFP-MMSA-8③组穿膜细胞数是13.8±1.38。RNAi组(pGC-FU-GFP-MMSA-8③组)穿膜细胞数较空白组和阴参组显著降低(P<0.01,见图4)。空白组和阴参组之间穿膜细胞数无统计学差异。说明抑制MMSA-8在骨髓瘤细胞RPMI8226中的表达,可以明显抑制骨髓瘤细胞体外实验中的侵袭能力。

图4 MMSA-8下调对RPMI8226细胞侵袭力的影响Figure 4 Effect of downregulating MMSA-8 on RPMI8226 cell invasion
2.5 下调MMSA-8表达水平,影响P53与MDM2调控体系
Western blot结果显示,RNAi3组中MDM2蛋白水平与对照组(空白组,阴参组)比较明显下降(P<0.05),空白组与阴参组之间差异无统计学意义(P>0.05,见图5)。而P53蛋白水平在RNAi3组中明显上升(p<0.05),空白组与阴参组之间差异无统计学意义(P>0.05,见图5)。
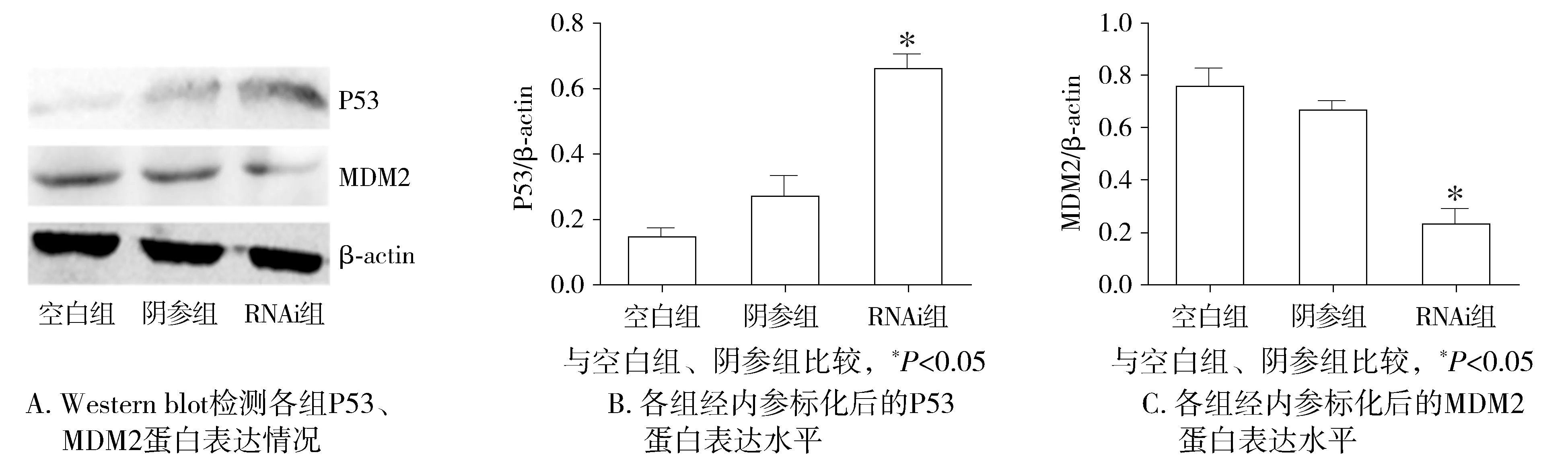
图5 MMSA-8表达下调对RPMI8226细胞P53、MDM2表达的影响Figure 5 Expression of P53 and MDM2 in RPMI8226 cells after downregulating MMSA-8
3 讨论
近年来,基因治疗中运用病毒载体已被大家认可,特别是对于慢病毒载体的研究与发展更加突飞猛进。与腺病毒、逆转录病毒相比,慢病毒载体不仅可以携带基因感染和整合入细胞,而且其转染效率高,可在宿主细胞长期、稳定表达[9]。目前,第3代慢病毒载体可显著减弱免疫原性,在基因表达方面成功地实现了先体外后体内的基因转移。一般情况下,悬浮细胞转染效率较低,本研究采用慢病毒介导的RNA干扰技术,选择RPMI8226悬浮细胞作为实验对象,选择第3代慢病毒载体以期达到更高效率的转染效果,以及得到长期稳定传代的MMSA-8下调的RPMI8226细胞株。针对MMSA-8的mRNA序列设计合成了特异性的3条shRNA,通过Q-PCR和Western blot实验验证RNA干扰后RPMI8226细胞MMSA-8的mRNA和蛋白水平均有下降,其中pGC-FU-GFP-MMSA-8③组下降最为明显,说明在RPMI8226细胞中成功地过通过RNA干扰降低了MMSA-8基因表达,并成功构建了低表达MMSA-8的稳定传代细胞株。
MMSA-8是本实验室利用重组cDNA表达文库血清分析法(SEREX)筛选出的一个骨髓瘤相关基因,经过NCBI的Blast比对分析,结果发现:新获MMSA-8的序列完全覆盖RPS27A转录本1序列(NCBI Reference Sequence:NM-002954.5),它们是相同的序列[8]。RPS27A基因编码连接泛素N端和核糖体蛋白S27A的C端的蛋白质。泛素-RPS27a前体蛋白很快的被特异化水解为泛素单体[10-12]。此外,在一些研究中提示RPS27a还具有核糖体蛋白之外的功能,RPS27a在小鼠肝癌及一些人类肿瘤中过表达[13-15]。本实验室前期实验发现MMSA-8(transcript variant 1 of RPS27A)在多发性骨髓瘤患者中高表达,且表达水平与疾病状态及预后具有明显相关性。并且在P53缺失的患者中,MMSA-8的表达水平高于其他患者[8]。为了进一步研究MMSA-8对骨髓瘤细胞增殖、侵袭的影响。我们用MTT实验来分析MMSA-8下调后对RPMI8226细胞增殖的影响。从MTT实验可见,RNAi组细胞增殖速率均明显低于阴参组和空白组,说明MMSA-8表达水平降低骨髓瘤细胞RPMI8226增殖被抑制,在骨髓瘤细胞RPMI8226中可能是促进肿瘤细胞增殖的因素之一,这一实验结果与之前的研究相符[13,15]。流式细胞仪检测结果发现:MMSA-8表达下调后,细胞在G1期、S期、G2期之间比例无明显变化,但是在sub-G1期的比例明显增大,这就提示MMSA-8的表达下调可能诱导RPMI8226细胞的凋亡,因为凋亡细胞在细胞周期分析中一般处于sub-G1期[15]。也就是说MMSA-8可能在RPMI8226细胞生长中有抗凋亡的作用。在Transwell侵袭实验结果显示,RNA干扰组穿膜的细胞数明显减少,表明下调MMSA-8的表达水平可以显著抑制骨髓瘤细胞RPMI8226的体外的侵袭性。
上述体外实验提示,MMSA-8的表达水平影响着RPMI8226细胞的增殖、凋亡和侵袭行为。MMSA-8可能是一个促进RPMI8226细胞增殖、侵袭以及抗凋亡的调控基因。为进一步研究MMSA-8影响RPMI8226细胞生物学行为的机制,根据以往研究提示RPS27A(MMSA-8)可能是P53转录的靶点,其过表达与DNA损伤有关[16]。RPS27a与MDM2相互作用,可能影响MDM2介导的P53遍在蛋白化,影响P53激活及细胞周期停滞[17]。本实验对MMSA-8表达下调后P53、MDM2表达水平进行检测,发现:MMSA-8表达降低的同时,MDM2表达水平降低,P53表达水平升高。因此推测:在多发性骨髓瘤中DNA损伤导致MMSA-8高表达,其高表达又通过MDM2-P53环路抑制P53的激活,从而导致骨髓瘤细胞的增殖及恶性演进。降低MMSA-8表达水平,MDM2表达水平降低,P53表达水平升高,RPMI8226细胞增殖减慢,侵袭力下降。
综上所述,MMSA-8在促进骨髓瘤细胞RPMI8226增殖、侵袭中具有重要作用。并且这一作用可能是通过调控MDM2-P53环路,调节P53的表达水平实现的。通过本研究不仅有助于我们更全面探索多发性骨髓瘤的生物学行为,也为多发性骨髓瘤的生物治疗提供新的靶点。
参考文献:
[1] Brimnes MK, Svane IM, Johnsen HE. Impaired functionality and phenotypic profile of dendritic cells from patients with multiple myeloma[J]. Clin Exp Immunol, 2006, 144(1):76-84.
[2] Kuboshima M, Shimada H, Liu TL,etal. Presence of serum tripartite motif-containing 21 antibodies in patients with esophageal squamous cell carcinoma[J].Cancer Sci,2006,97(5):380-386.
[3] International Myeloma Working Group. Criteria for the classification of monoclonal gammopathies, multiple myeloma and related disorders: a report of the International Myeloma Working Group[J]. Br J Haematol, 2003, 121(5)749-757.
[4] Kumar SK, Rajkumar SV, Dispenzieri A,etal. Improved survival in multiple myeloma and the impact of novel therapies[J]. Blood, 2008, 111(5):2516-2520.
[5] Pulte D, Gondos A, Brenner H. Improvement in survival of older adults with multiple myeloma: results of an updated period analysis of SEER data[J]. Oncologist, 2011, 16(11):1600-1603.
[6] Brenner H, Gondos A, Pulte D. Expected long-term survival of patients diagnosed with multiple myeloma in 2006-2010[J]. Haematologica, 2009, 94(2):270-275.
[7] Kumar SK, Lee JH, Lahuerta JJ,etal, Risk of progression and survival in multiple myeloma relapsing after therapy with IMiDs and bortezomib: a multicenter international myeloma working group study[J]. Leukemia, 2012, 26(1):149-157.
[8] He R, Yang N, Zhang P,etal. Identification and, expression of MMSA-8, and its clinical significance in multiple myeloma[J]. Oncol Rep, 2017, 37(6):3235-3243.
[9] Abdellatif AA, Pelt JL, Benton RL,etal. Gene delivery to the spinal cord: comparison between lentiviral, adenoviral, and retroviral vector delivery systems[J]. J Neurosci Res, 2006, 84(3):553-567.
[10] Redman KL, Rechsteiner M. Identification of the long ubiquitin extension as ribosomal protein S27a[J]. Nature, 1989, 338(6214):438-440.
[11] Shabek N, Ciechanover A. Degradation of ubiquitin: the fate of the cellular reaper[J]. Cell Cycle, 2010, 9(3):523-530.
[12] Komander D, Clague MJ, Urbé S. Breaking the chains: structure and function of the deubiquitinases[J]. Nat Rev Mol Cell Biol, 2009, 10(8):550-563.
[13] Wang H, Xie B, Kong Y,etal, Overexpression of RPS27a contributes to enhanced chemoresistance of CML cells to imatinib by the transactivated STAT3[J].Oncotarget,2016,7(14):18638-18650.
[14] Wang H, Yu J, Zhang L,etal, RPS27a promotes proliferation, regulates cell cycle progression and inhibits apoptosis of leukemia cells[J].Biochem Biophys Res Commun,2014,446(4):1204-1210.
[15] Gunasekaran VP, Ganeshan M. Inverse correlation of ribosomal protein S27A and multifunctional protein YB-1 in hepatocellular carcinoma[J].Clin Biochem,2014,47(13-14):1262-1264.
[16] Shimura M, Ishizaka Y, You A,etal. Characterization of room temperature induced apoptosis in HL-60[J]. FEBS Lett, 1997, 417(3):379-384.
[17] Nosrati N, Kapoor NR, Kumar V. DNA damage stress induces the expression of Ribosomal Protein S27a gene in a p53-dependent manner[J]. Gene, 2015, 559(1):44-51.
[18] Sun XX, DeVine T, Challagundla KB,etal. Interplay between ribosomal protein S27a and MDM2 protein in p53 activation in response to ribosomal stress[J]. J Biol Chem, 2009, 286(26): 22730-22741.
