术后早期关节腔冲洗对兔前交叉韧带重建后腱-骨愈合的影响
2018-06-06董向辉徐翠香孙正明常彦海
董向辉,徐翠香,孙正明,常彦海,凌 鸣*
(1陕西省人民医院骨科,西安 710068;2陕西省临床检验中心;*通讯作者,E-mail:m.ling0114@163.com)
前交叉韧带(anterior cruciate ligament,ACL)是膝关节的重要稳定结构之一[1],其损伤多发于运动员及喜爱运动的普通人群中,随着全民运动的日益展开及民众健康需求的不断提高,ACL损伤发病率呈逐年上升趋势,损伤后韧带不能自行愈合,需要手术重建[2]。移植物的腱-骨愈合是临床医生关心的重要问题,是手术成败的关键。移植物的种类、固定方式、炎性细胞因子和关节滑液的浸泡等是影响ACL重建预后的重要因素[3,4],而外伤、手术刺激、关节内炎症反应等直接和间接地改变着关节内环境,本实验在ACL重建基础上,通过术后早期关节腔冲洗减少滑液及炎症介质改变关节内微环境的方法,探索其对移植物腱-骨愈合界面的组织学影响。
1 材料和方法
1.1 实验动物及分组
8-10月雄性新西兰大白兔24只,体质量3-3.5 kg,由西安交通大学医学院动物实验中心提供,随机编号,分笼饲养,饲养室温度22-25 ℃,相对湿度40%-60%,每日定时给予紫外线消毒。所有动物术前活动正常,膝关节无肿胀,双侧膝关节抽屉试验、Lachman征均为阴性。每只动物双侧均建立以踇长伸肌腱为移植物的ACL重建模型。随机选取一侧膝作为实验组,术后早期给予关节腔冲洗,对侧不作处理作为对照组。额外饲养2只并制成模型备用,以便补充动物死亡、伤口感染等引起的标本丢失。
1.2 ACL重建方法
术前准备:3.3%戊巴比妥钠(1 ml/kg)经耳缘静脉注射行全身麻醉,用硫化钠进行膝关节周围脱毛处理,肌肉注射40万U青霉素预防感染。
建立模型:常规消毒铺巾,取膝关节正中切口,显露前交叉韧带,在股骨、胫骨附着处将其完全切断,检查前抽屉试验及Lachman征均为阳性,证明前交叉韧带已完整切除。取胫骨下段内侧纵形切口,约2 cm,分离并取出踇长伸肌腱,剔除肌肉部分后对折,两端均用丝线编织,并在两端保留10 cm长的缝线以作预张及重建手术时牵引使用,冲洗并缝合切口,测量编织肌腱的直径,并预张10 min,置于生理盐水中备用。
屈膝45°,用1 mm的克氏针以原ACL起止点为标记分别钻取胫骨及股骨骨道,根据测量的肌腱直径,选取与其直径相近的钻头沿克氏针方向扩大骨髓道,并在骨道出口处钻取骨桥备用,将移植物经牵引线依次穿过胫骨、股骨骨道,屈膝60°将牵引线穿过骨桥打结固定。再次检查抽屉试验前拉及Lachman均为阴性。用双氧水及生理盐水清洗伤口,实验侧膝关节放置冲洗管于关节腔内,远端由切口旁皮下引出并固定于皮肤上,严密缝合切口,碘伏消毒后包扎,术后分笼饲养,自由活动。术后实验组连续5 d每天定时9:00用生理盐水冲洗关节腔内一次,直至流出液清亮为止,对照组不做处理,并给予40万U青霉素肌肉注射,连续5 d,预防感染,5 d后拔除冲洗管。
1.3 获取股骨-移植韧带-胫骨标本
分别在术后第4,8,12周时,用空气栓塞法处死8只实验动物,在胫骨和股骨骨髓道关节外口的远端和近端2 cm处切断股骨、胫骨,剔除膝关节周围除关节囊及韧带以外的其余软组织,保留完整的膝关节内结构,标本置于10%的甲醛溶液中固定。
1.4 苏木精-伊红染色
剔除标本周围软组织,经常规脱钙处理,进行HE染色。在显微镜下观察腱骨界面愈合过程中的组织学变化,随机选取5个高倍视野进行成纤维细胞计数,计算平均值。
1.5 统计学分析
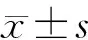
2 结果
术后第4周,实验组移植肌腱与骨髓道贴附较紧密,腱-骨界面之间可见成纤维细胞生长活跃,少量炎细胞存在,有成骨反应及新生血管形成;对照组骨髓道壁与移植肌腱之间部分区域间隙相对较大,连接松散,之间可见少量新生血管、成纤维细胞及较多的炎细胞,炎症反应明显(见图1)。
术后第8周,实验组髓道壁与移植肌腱间连接紧密,由致密的纤维结缔组织构成,以排列规则的胶原纤维为主,可见较多成纤维细胞,炎性细胞减少,靠近骨髓道壁侧成骨活跃,分布有较多细胞核呈类圆形的成软骨细胞,并向肌腱侧移行;对照组髓道壁与移植肌腱之间连接相对紧密,成纤维细胞较多,胶原纤维排列紊乱,毛细血管减少,骨髓道壁侧可见成骨反应(见图1)。
术后第12周,实验组髓道壁与移植肌腱界面区胶原纤维大量产生,排列有序,靠近骨髓道壁侧见大量新生骨组织,包含纤维软骨及钙化软骨,部分区域胶原纤维、纤维软骨、钙化软骨、骨层次较为清晰;对照组髓道壁与移植肌腱界面区连接紧密,胶原纤维较多,排列较规则,髓道侧可见成骨细胞增生及成软骨细胞分布(见图1)。
ACL重建术后第4,8和12周,实验组腱-骨界面成纤维细胞生长活跃,胶原纤维排列规则有序,成骨活跃,对照组成纤维细胞相对较少,胶原纤维排列紊乱,成骨反应相对延迟;腱-骨界面成纤维细胞计数结果显示:实验组腱-骨界面成纤维细胞计数在各个时间点与对照组相比较,差异存在统计学意义(P<0.01)。ACL重建术后实验组和对照组腱-骨界面成纤维细胞均逐渐增加,在第8周末最多,此后逐渐下降,但对照组下降更为明显(见表1)。

ACL重建术后,实验组腱-骨界面成纤维细胞生长活跃,胶原纤维排列规则有序,成骨活跃;对照组成纤维细胞相对较少,胶原纤维排列紊乱,成骨反应相对延迟图1 ACL重建术后不同时间实验组和对照组腱-骨界面组织学形态(苏木精-伊红染色,×100)Figure 1 Morphology of tendon-bone interface in experimental group and control group at weeks 4,8,12 after ACL reconstruction (Hematoxylin-eosin staining,×100)



分组4周8周12周实验组33.25±2.12*45.50±3.46*38.37±1.69*对照组24.75±2.2535.50±1.6029.35±2.49
与对照组相比,*P<0.01
3 讨论
前交叉韧带重建后移植物与骨髓道之间的愈合过程复杂,影响因素较多,比如移植物的类型、微动及应力、固定方式、康复过程、骨髓道位置以及炎性细胞因子和关节滑液的浸泡等。移植肌腱为了适应新的环境一般都要经历一个组织缺血坏死,新生血管、胶原纤维等新组织长入替代及韧带塑形改建的过程[5,6]。前交叉韧带急性损伤期、重建时钻取骨道引起的骨坏死、关节内清理等直接和间接损伤的刺激均会诱发及加重腱-骨交界面的炎症反应,而关节液内白细胞、炎症介质和细胞因子等的浓度变化会明显影响腱骨愈合,如破骨细胞激活促进骨质吸收,降解骨基质[7]。本实验通过早期关节腔冲洗来减少术后滑液及炎症介质以改善关节内环境的方法来观察其对腱骨愈合的影响。
前交叉韧带损伤或者重建后关节滑液的量和性质发生明显改变,ACL损伤患者的关节滑液中IL-1、IL-6、干扰素γ、巨噬细胞炎性蛋白1β及TNF-α等炎症因子含量较正常显著增高[8],1周后逐渐降低,但仍高于正常[9]。Xue等[10]对前交叉韧带断裂的鼠进行研究后发现MMP的含量显著增加,并认为是与韧带愈合差有关,但更为重要的原因是损伤后关节内环境的改变。Demirag等[11]研究兔ACL重建术后用α2巨球蛋白封闭关节滑液中的MMP,实验组中MMP含量明显下降,并促进了腱-骨愈合,认为是α2巨球蛋白封闭MMPS或者胶原酶,改变关节内环境的结果。用保留交叉韧带残端的方法进行重建可以促进腱-骨愈合,其原因是保留的韧带残端可以减少关节滑液向骨髓道中渗漏或反流[12]。
本实验组织学观察表明,实验组的成纤维细胞形成和成骨反应的表现均优于对照组,滑膜爬行覆盖出现较早,胶原纤维排列规整,腱骨之间贴附连接较对照组紧密。成纤维细胞的数量经统计学分析显示,随着术后时间的延长,成纤维细胞呈现逐渐减少的趋势,但在观察的各时间点数量上明显多于对照组,差异具有统计学意义(P<0.05)。正常前交叉韧带是由平行走行、波浪状排列的致密结缔组织构成,主要基质成分是胶原纤维[13,14],而成纤维细胞是合成胶原的主要细胞。ACL重建术后移植肌腱缺乏血供,韧带表面部分纤维束会逐渐坏死,早期不能形成有效的自我修复,术后2周腱-骨界面之间主要被肉芽组织及炎细胞充填[15]。肉芽组织主要是由大量毛细血管及丰富的成纤维细胞构成,随着时间延长,肉芽组织逐渐成熟为纤维结缔组织并已经对移植肌腱形成有效的包裹覆盖,移植肌腱表面再血管化,成纤维细胞长入,而骨髓道壁侧血运丰富,软骨细胞及成骨细胞增生活跃,向腱骨界面之间的结缔组织形成有效的骨长入,形成了术后早期骨组织-结缔组织-移植肌腱的结构层次。早期关节腔冲洗后可以明显减少关节腔内滑液及炎症介质的量,使其对腱骨界面间的肉芽组织破坏减少,局部成纤维细胞数量明显优于对照组,胶原纤维规律的排列分布发生更早,从而形成更具方向性的胶原纤维[16]。ACL重建手术后由于直接及间接的损伤引起的关节腔内炎症反应,关节滑液量明显增多,滑液中炎症介质的含量发生明显改变,各种分解性的酶类增多,平衡失调,关节腔的内环境发生改变,加重关节结构的损伤[17],并且移植韧带内缺乏血液供应,腱周没有结缔组织包裹,与滑液、炎症细胞及介质等直接接触。同时,滑液沿着移植物与骨髓道之间的缝隙流入,对腱-骨界面的愈合产生不利影响[18,19],造成腱-骨愈合进程减慢。由此可见,早期关节腔冲洗可减少关节内滑液及炎症介质,改善关节内环境,增加腱-骨界面之间成纤维细胞的数量,形成更具方向性的胶原纤维,从而促进腱-骨愈合。
因此,本研究认为,前交叉韧带重建后可以通过早期关节腔冲洗的方法改善关节腔内环境,促进腱-骨界面胶原纤维形成,进而促进腱-骨愈合。
参考文献:
[1] Conteduca F, Caperna L, Ferretti A,etal. Knee stability after anterior cruciate ligament reconstruction in patients older than forty years: comparison between different age groups[J]. Int Orthop, 2013, 37(11):2265-2269.
[2] Vaishya R, Agarwal AK, Ingole S,etal. Current trends in anterior cruciate ligament reconstruction: a review[J]. Cureus, 2015, 7(11):e378.
[3] 王辉,王万明.前交叉韧带重建术后腱骨愈合影响因素研究进展[J].实用医学杂志,2014,30(14):2343-2345.
[4] 董向辉,凌鸣,冯伟楼,等.关节滑液对兔前交叉韧带重建后腱骨愈合生物力学和组织学的影响[J].中国组织工程研究,2012,16(11):1937-1940.
[5] Jagodzinski M, Geiges B, von Falck C,etal. Biodegradable screw versus a press-fit bone plug fixation for hamstring anterior cruciate ligament reconstruction a prospective randomized study[J]. Am J Sports Med, 2010, 38(3):501-508.
[6] van Eck C, Working Z, Fu F. Current concepts in anatomic single-and double-bundle anterior cruciate ligament reconstruction[J]. Phys Sportsmed, 2011, 39(2):140-148.
[7] Lui PP, Ho G, Shum WT,etal. Inferior tendon graft to bone tunnel healing at the tibia compared to that at the femur after anterior cruciate ligament reconstruction[J]. J Orthop Sci, 2010, 15(3):389-401.
[8] Cuellar VG, Cuellar JM, Golish SR,etal. Cytokine profiling in acute anterior cruciate ligament injury[J]. Arthroscopy, 2010, 26(10):1296-1301.
[9] Irie K, Uchiyama E, Iwaso H. Intraarticular inflammatory cytokines in acute anterior cruciate ligament injured knee[J]. Knee, 2003, 10(1):93-96.
[10] Xue R, Yang L, Tang Z,etal. The profile of MMP and TIMP in injured rat ACL[J].Mol Cell Biomech,2010,7(2):115-124.
[11] Demirag B, Sarisozen B, Ozer O,etal. Enhancement of tendon-bone healing of anterior cruciate ligament grafts by blockage of matrix metalloproteinases[J]. J Bone Joint Surg Am, 2005, 87(11): 2401-2410.
[12] 祁洁,陈疾忤,陈世益,等.应用异体肌腱鞘内重建前交叉韧带的前瞻性研究[J].中国修复重建外科杂志,2010,48):917-921.
[13] 陈鸿辉,唐毅,李斯明,等.膝关节韧带成纤维细胞的培养及其生物学特性分析[J].中华骨科杂志,2002,22(1):40-44.
[14] 焦晨,敖英芳,赵新荣.正常前交叉韧带的超微结构特点[J].中国运动医学杂志,2010,29(1):56-58.
[15] 张力,靳安民,李奇.rhBMP-2增强前交叉韧带重建术后腱骨界面愈合能力的实验研究[J].南方医科大学学报,2008,28(10):1869-1873.
[16] 梁凯路,秦廷武,杨志明.周期性机械牵张对离体成纤维细胞作用的研究进展[J].生物医学工程学杂志,2004,21(6):1047-1050.
[17] Huang JM,Liu HY,Chen FR,etal.Characteristics of bone tunnel changes after anterior cruciate ligament reconstruction using Ligament Advanced Reinforcement System artificial ligament[J].Chin Med J(Engl),2012,125(22):3961-3965.
[18] Weiler A, Forster C, Hunt P,etal. The influence of locally applied platelet-derived growth factor-BB on free tendon graft remodeling after anterior cruciate ligament reconstruction[J]. Am J Sports Med, 2004, 32(4):881-891.
[19] 王成,敖英芳.前交叉韧带重建术后骨道增宽的临床研究[J].中华外科杂志,2008,46(2):90-93.
