失眠障碍患者小脑中央核磁共振波谱成像研究☆
2018-06-06黄俏庭史长征孙尧李瑽睿廖继武马萍王丝丝潘集阳
黄俏庭 史长征 孙尧 李瑽睿 廖继武 马萍 王丝丝 潘集阳○☆
失眠障碍是最为常见的睡眠障碍,区域人群现患率可高达50%[1-2],但其发病机制尚不明确。近年研究提示小脑可能在睡眠—觉醒调节中扮演重要角色:动物实验发现小脑对睡眠—觉醒脑电存在调节作用[3];临床研究显示小脑顶核电刺激治疗对失眠障碍有效[4-5];影像学研究发现个体在慢波睡眠阶段小脑自发神经活动增加[6],慢性失眠障碍患者小脑灰质密度较睡眠正常者低[7]。然而,现有研究证据未能区分左右侧小脑的作用差异,且尚不足以明确小脑异常是否为失眠障碍的病理基础之一。氢质子磁共振波谱成像(proton magnetic resonance spectroscopy,1H-MRS)可无创测定活体特定脑区神经生化物质代谢状况,可将神经生化和神经影像相结合,更深入地探讨疾病发病机制[8-9]。因此,本研究采用多体素1H-MRS技术半定量研究未经药物治疗的失眠障碍患者双侧小脑中央核N-乙酰天门冬氨酸(N-acetylaspartate,NAA)、胆碱复合物(choline-containing compounds,Cho)和肌酸(creatine,Cr)变化特点,为小脑与失眠障碍的关系研究提供更充分的依据。
1 对象和方法
1.1 研究对象失眠组来源于2015年3月至2016年9月在暨南大学附属第一医院精神医学科睡眠门诊就诊的失眠患者和广告招募的失眠患者。对照组来源于广告招募的志愿者。
失眠组纳入标准:①符合《美国精神障碍诊断与统计手册第 5版》(Diagnostic and Statistical Manual of Mental Disorders,5th Edition,DSM-5)失眠障碍的诊断标准;②匹兹堡睡眠质量指数量表(Pittsburgh sleep quality index,PSQI) 总分≥8 分;③年龄18~60岁;④小学以上文化,右利手;⑤未经药物或物理治疗。对照组纳入标准:①睡眠正常;②PSQI总分<8分;③年龄 18~60岁;④小学以上文化,右利手;⑤与患者无血缘关系,相互间也无血缘关系。
排除标准(两组均适用):①患有躯体疾病或脑器质性疾病;②现患或既往有精神障碍(失眠组除失眠障碍之外),或有精神障碍家族史;③有精神活性物质滥用/依赖;④近2周内倒班工作;⑤妊娠或哺乳期妇女。
共纳入失眠障碍患者23例,其中男性8例,女性 15例,平均年龄(31.3±8.1)岁,受教育年限(15.4±3.4)年,体质量指数(body mass index,BMI)为(20.7±2.1)kg/m2;对照者 18 名,其中男性 8 名,女性 10名,平均年龄(27.1±6.1)岁,受教育年限(14.9±2.3)年,BMI为(21.1±2.7)kg/m2。 两组均为汉族,右利手。两组间性别构成、年龄、受教育年限和BMI均无统计学差异(均P>0.05)。
本研究经暨南大学附属第一医院伦理委员会批准。所有受试者均详细了解本研究,并签署知情同意书。
1.2 诊断与评估
1.2.1 一般情况调查 自制一般情况表用于记录受试者社会人口学等资料,包括性别、年龄、身高、体重、民族、文化程度、职业、烟酒嗜好及精神障碍家族史等。
1.2.2 临床诊断 采用简明国际神经精神障碍访谈(mini-international neuropsychiatric interview,M.I.N.I.)中文版(由司天梅等[10]翻译制成,本研究经作者和翻译者同意授权使用)筛查受试者,然后参照DSM-5进行临床诊断。
1.2.3睡眠质量评估 PSQI用于受试者主观评定最近1个月的睡眠质量。PSQI由19个自评条目和5个他评条目构成,总分为0~21分,得分越高表示睡眠质量越差。PSQI总分≥8分为我国成人睡眠质量问题的参考界值[11]。
1.2.4 失眠程度评估 失眠严重程度指数量表(insomnia severity index,ISI)用于受试者主观评定过去1个月睡眠问题(失眠)的严重程度。ISI共包含7个条目,总分为0~28分,得分越高表示失眠越严重。ISI总分0~7分提示无临床意义的失眠;8~14分提示轻度失眠;15~21分提示中度失眠;22~28分提示重度失眠[12]。
1.2.5 焦虑情绪评估 状态—特质焦虑量表(state-trait anxiety inventory,STAI) 用于受试者主观评定短暂的焦虑情绪状态和人格特质性焦虑倾向。STAI包括状态焦虑量表(SAI)和特质焦虑量表(TAI)2个分量表,各20个自评条目。SAI总分和TAI总分均为20~80分,分别反映受试者状态或特质焦虑的程度,得分越高表示焦虑越严重。SAI和 TAI总分50~59分提示轻度焦虑;60~69分提示中度焦虑;>70分提示重度焦虑[11]。
1.2.6 抑郁情绪评估 贝克抑郁量表(Beck depression inventory,BDI)用于受试者主观评定抑郁的严重程度。BDI包含21个自评条目,总分为0~63分,得分越高表示抑郁越严重。BDI总分0~4分提示无抑郁;5~13分提示轻度抑郁;14~20分提示中度抑郁;≥21分提示重度抑郁[11]。
以上所有专业量表由同一名精神科主治医师评定。对STAI总分>50分和/或BDI总分>5分的受试者,按DSM-5诊断标准进一步复核诊断,以剔除不符合入排标准者。
1.3 夜间客观睡眠参数采集采用澳大利亚Compumedics(康迪)Grael 76通道标准多导睡眠仪采集受试者的夜间多导睡眠图(polysomnography,PSG)数据。由同一名经过中国睡眠研究会国际注册多导睡眠技师认证课程培训的技师进行监测电极安置及报告分析等操作。受试者共接受2晚PSG,第1晚为适应性监测并确认受试者为失眠障碍或正常睡眠,研究数据取第2晚PSG数据。
1.4 1H-MRS数据采集受试者统一于拟行第2晚PSG当天的 19:00~20:00接受1H-MRS扫描。采用GE Discovery 750 3.0 T MR进行多体素2D1H-MRS扫描。扫描时受试者静息闭眼但保持清醒。先进行常规的T1WI、T2WI扫描以排除脑器质性疾病,同时为MRS扫描定位。选择小脑中央核区为感兴趣区(见图1)。成像参数:频率编码方向A/P;发射频率(Freq)10;相位(Phase)10;层厚10 mm;间隔 10 mm;视野(field of view,FOV)为24 cm×24 cm;重复时间(repetition time,TR)/回波时间(echo time,TE)为 1000 ms/144 ms;矩阵 18×18。扫描时间5 min 28 s。使用美国通用公司ADW4.5工作站Functool软件进行后处理,测定代谢物NAA、Cho和Cr的相对水平,并计算NAA/Cr和Cho/Cr比值。所有扫描均由同一名经验丰富的影像科医师操作,扫描后由同一名影像科副主任医师审核进行质控。
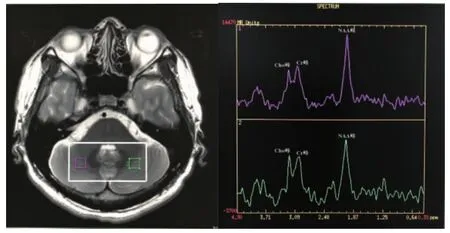
图1 1H-MRS小脑中央核定位和NAA、Cho、Cr波峰图。左侧图为T2WI解剖图,用于小脑中央核MRS定位,标记1和2分别代表两侧的小脑中央核区。右侧图为对应区域代谢物浓度图,波谱线NAA波峰在2.02 ppm处,Cho波峰在3.23 ppm处,Cr波峰在3.02 ppm处
1.5 统计学方法运用SPSS 13.0进行统计分析。本研究中各量表得分、PSG睡眠参数和小脑中央核NAA/Cr、Cho/Cr比值数据符合正态分布。两组间各量表得分、PSG睡眠参数以及NAA/Cr和Cho/Cr比值比较采用独立样本t检验,组内两侧小脑中央核之间NAA/Cr和Cho/Cr比值的比较采用配对样本t检验。NAA/Cr、Cho/Cr比值和PSQI、ISI、SAI、TAI、BDI 总 分 以 及 PSG 睡 眠 参 数 的 相关性采用Pearson相关分析。检验水准α=0.05,双侧检验。
2 结果
2.1 量表评分失眠组与对照组之间PSQI(t=11.892,P<0.001)、ISI(t=10.389,P<0.001)、SAI(t=3.805,P<0.001)、TAI(t=4.014,P<0.001)和 BDI(t=5.128,P<0.001)总分的差异均有统计学意义。见表1。

表1 失眠组和对照组量表评分
2.2 PSG睡眠参数失眠组PSG睡眠潜伏期(t=5.683,P<0.001)、入睡后清醒时间(t=3.171,P=0.004)、入睡后觉醒次数(t=4.964,P<0.001)和 1期睡眠所占比例(t=2.886,P=0.006)高于对照组,睡眠效率(t=3.851,P=0.001)和3期睡眠所占比例(t=2.444,P=0.019)低于对照组,差异均有统计学意义。见表2。

表2 失眠组和对照组PSG睡眠参数
2.3 小脑中央核NAA/Cr和Cho/Cr比值失眠组右侧小脑中央核NAA/Cr比值低于对照组,差异有统计学意义(t=2.280,P=0.028)。两组间左侧小脑中央核NAA/Cr比值和双侧小脑中央核Cho/Cr比值的差异均无统计学意义(均P>0.05)。失眠组两侧小脑中央核之间NAA/Cr和Cho/Cr比值的差异均无统计学意义(均P>0.05)。对照组右侧小脑中央核NAA/Cr比值高于左侧,差异有统计学意义(t=3.386,P=0.004),对照组两侧小脑中央核之间Cho/Cr比值的差异无统计学意义(P>0.05)。见表3。
2.4 右侧小脑中央核NAA/Cr比值与量表评分及PSG睡眠参数的相关性所有受试者右侧小脑中央核NAA/Cr比值与PSQI总分呈统计学负相关(r=-0.369,P=0.018),与 PSG 入睡潜伏期(r=-0.437,P=0.004)及入睡后觉醒次数(r=-0.432,P=0.005)分别呈统计学负相关,与3期睡眠比例呈统计学正相关(r=0.377,P=0.015)。此外,所有受试者右侧小脑中央核NAA/Cr比值与ISI总分呈负相关趋势(r=-0.305,P=0.052),但无统计学意义。
3 讨论
国内外有学者应用1H-MRS技术对失眠障碍患者的不同脑区(全脑皮质[13-14]、枕叶[15-16]、扣带回[9,16]、背外侧前额叶[9]和海马[17]等)及代谢物(γ-氨基丁酸[9,14-16]、谷氨酸复合物[9]和磷酸肌酸[13]等)进行研究,但所测代谢物主要聚焦在γ-氨基丁酸,而且绝大部分研究应用单体素1H-MRS技术,未能区分左右侧脑区的差异。多体素1H-MRS技术已被证实当小脑结构完整时可以敏感地发现小脑代谢的变化[18]。本研究探索失眠障碍患者小脑中央核多体素1H-MRS特点,同时测定并区分左右侧小脑中央核的代谢状况,并限定研究对象为未经药物治疗者,年龄跨度较小(18~45岁),具有一定的代表性。
本研究结果显示,失眠障碍患者右侧小脑中央核NAA/Cr比值低于睡眠正常者,而左侧小脑中央核NAA/Cr比值与睡眠正常者无统计学差异。NAA/Cr比值可反映1H-MRS所测脑区神经元的密度、完整性和功能状态[8,19-21],因此上述结果提示失眠障碍患者小脑中央核NAA/Cr代谢存在右侧偏侧化紊乱,右侧小脑中央核可能存在神经元受损。其原因可能是本研究纳入的患者均为右利手,其优势半球在左侧。本研究团队前期研究结果显示,失眠障碍患者额叶和海马的代谢同样呈偏侧化紊乱[17]。此外,偏侧化脑区代谢紊乱亦见于重性抑郁障碍[22-23]和广泛性焦虑障碍[24-26]患者的1HMRS研究报道。失眠是重性抑郁障碍患者及广泛性焦虑障碍患者常见的临床症状之一[27-28],因此,半球偏侧化异常有可能是失眠、抑郁和焦虑障碍共同的病理特征之一,后续值得对此进行更深入的研究。

表3 失眠组和对照组MRS所测小脑中央核NAA/Cr和Cho/Cr比值
值得注意的是,本研究中对照组右侧小脑中央核NAA/Cr比值高于左侧,提示睡眠正常的右利手健康受试者存在小脑偏侧化发育及功能偏侧化现象(右侧高于左侧),与国外相关研究报道一致[29-30]。而失眠组两侧小脑中央核之间NAA/Cr比值的差异无统计学意义,提示可能失眠障碍患者右侧小脑中央核神经元受损使其小脑偏侧化发育及功能偏侧化发生改变,与国外关于小脑偏侧化发育在精神分裂症患者中消失的报道相一致[29-30]。
小脑可能通过易化下丘脑神经元活动[31-32],抑制神经元膜过度兴奋[33],调节神经递质和细胞因子释放[34-35]等多个环节参与睡眠—觉醒的调节。小脑损伤可导致动物出现睡眠—觉醒脑电异常和睡眠—觉醒失衡[3],研究亦提示慢性失眠障碍患者小脑灰质密度降低[7]。因此,失眠障碍的发病机制有可能与小脑异常相关。但上述研究未能区分左右侧小脑的作用差异。而结合本研究结果,可以做出以下推测:右侧小脑中央核神经元受损可破坏小脑整体的睡眠—觉醒调节功能,进而导致个体出现失眠症状。此外,本研究结果还提示随着右侧小脑中央核神经元受损程度的加重(NAA/Cr比值下降),相应地受试者主观睡眠质量愈差,客观入睡潜伏期愈长,夜间觉醒次数更多,深睡眠比例降低,佐证了上述推测。
综上,本文通过失眠障碍患者的小脑中央核多体素1H-MRS研究,发现失眠障碍患者小脑中央核代谢呈偏侧化改变,可能存在右侧小脑中央核神经元受损。本研究有可能为失眠障碍神经生物学基础研究提供新的思路和线索。但本研究样本量较少,未进行随访研究,可能无法得出确切的结论。此外,由于检测技术限制,未能细分小脑中央核亚结构的代谢特点,亦未能同时测定小脑中央核γ-氨基丁酸和谷氨酸等代谢物,可能会遗漏一些有价值的信息。
[1]MEDALIEL,CIFU AS.Management of chronic insomnia disorder in adults[J].JAMA,2017,317(7):762-763.
[2]张斌.中国失眠障碍诊断和治疗指南[M].北京:人民卫生出版社,2016,6:10.
[3]DEANDRES I,GARZONM,REINOSO-SUAREZ F.Functional anatomy of non-REM sleep[J].Front Neurol,2011,2:70.
[4]张博爱,贾延劼,董为伟,等.电刺激小脑顶核治疗非器质性失眠症临床观察[J].郑州大学学报(医学版),2009,44(1):156-159.
[5]骆杭丽,吴亦.小脑顶核电刺激对失眠患者睡眠参数的影响[J].浙江中西医结合杂志,2013,23(11):894-896.
[6]DANG-VU TT,SCHABUSM,DESSEILLESM,et al.Spontaneous neural activity duringhuman slow wave sleep[J].Proc Natl Acad Sci USA,2008,105(39):15160-15165.
[7]JOOEY,NOH HJ,KIM JS,et al.Brain gray matter deficits in patientswith chronic primary insomnia[J].Sleep,2013,36:999-1007.
[8]CURRIE S,HADJIVASSILIOU M,CRAVEN IJ,et al.Magnetic resonance spectroscopy of the brain[J].Postgrad Med J,2013,89:94-106.
[9]SPIEGELHALDER K,REGENW,NISSEN C,et al.Magnetic resonance spectroscopy in patients with insomnia:a repeated measurement study[J].PLoSOne,2016,11(6):e0156771.
[10]司天梅,舒良,党卫民,等.简明国际神经精神访谈中文版的临床信效度[J].中国心理卫生杂志,2009,23(7):493-497.
[11]汪向东,王希林,马弘.心理卫生评定量表手册增订版[M].北京:中国心理卫生杂志社,1999:375-378,238-241,191-194.
[12]杨建铭.失眠严重度量表中文版的信、效度研究[J].临床心理学刊,2009,4(2):95-104.
[13]HARPER DG,PLANTE DT,JENSEN JE,et al.Energetic and cell membrane metabolic products in patients with primary insomnia:a 31-phosphorus magnetic resonance spectroscopy study at 4 tesla[J].Sleep,2013,36:493-500.
[14]WINKELMAN JW,BUXTON OM,JENSEN JE,et al.Reduced brain GABA in primary insomnia:preliminary data from 4T proton magnetic resonance spectroscopy (1H-MRS)[J].Sleep,2008,31:1499-1506.
[15]MORGAN PT,PACE-SCHOTT EF,MASON GF,et al.Cortical GABA levels in primary insomnia[J].Sleep,2012,35:807-814.
[16]PLANTE DT,JENSEN JE,SCHOERNING L,et al.Reducedγaminobutyric acid in occipital and anterior cingulate cortices in primary insomnia:a link to major depressive disorder[J].Neuropsychopharmacol,2012,37:1548-1557.
[17]彭博,潘集阳.原发性失眠患者双侧额叶和海马磁共振波谱成像研究.中华医学会第十一次全国精神医学学术会议暨第三届亚洲神经精神药理学术会议论文汇编[C].中华医学会,2013:122-123.
[18]WILKINSON ID,HADJIVASSILIOU M,DICKSON JM,et al.Cerebellar abnormalities on proton MR spectroscopy in gluten ataxia[J].JNeurol Neurosurg Psychiatry,2005,76(7):1011-1013.
[19]BASLOW MH.N-acetylaspartate in the vertebrate brain:metabolism and function[J].Neurochem Res,2003,28:941-953.
[20]SIGNORETTI S,MARMAROU A,TAVAZZI B,et al.N-acetylaspartate reduction as a measure of injury severity and mitochondrial dysfunction following diffuse traumatic brain injury[J].JNeurotrauma,2001,18:977-991.
[21]CLARK JB.N-acetylaspartate:a marker for neuronal loss or mitochondrial dysfunction[J].Dev Neurosci,1998,20:271-276.
[22]MAO N,FANG J,XIE H,et al.Correlation between neurochemical metabolism and memory function in adolescent patients with depression:A multi-voxel1H magnetic resonance spectroscopy study[J].Psychiatry Clin Neurosci,2016,70(4):167-174.
[23]JIAY,ZHONG S,WANG Y,et al.The correlation between biochemical abnormalities in frontal white matter,hippocampus and serum thyroid hormone levels in first-episode patients with major depressive disorder[J].JAffect Disord,2015,180:162-169.
[24]ABDALLAH CG,COPLAN JD,JACKOWSKIA,et al.A pilot study of hippocampal volume and N-acetylaspartate (NAA)as response biomarkers in riluzole-treated patients with GAD[J].Eur Neuropsychopharmacol,2013,23(4):276-284.
[25]ABDALLAH CG,COPLAN JD,JACKOWSKIA,et al.Riluzole effect on occipital cortex:a structural and spectroscopy pilot study[J].Neurosci Lett,2012,530(1):103-107.
[26]MATHEW SJ,MAO X,COPLAN JD,et al.Dorsolateral prefrontal cortical pathology in generalized anxiety disorder:a protonmagnetic resonance spectroscopic imaging study[J].Am J Psychiatry,2004,161(6):1119-1121.
[27]李雪丽,张斌.睡眠障碍与焦虑抑郁障碍的联系[J].中国临床医生杂志,2018,46(2):131-133.
[28]成媛媛,唐茂芹,杨冬林,等.伴抑郁症状的焦虑障碍患者生活质量的研究 [J].中国神经精神疾病杂志,2011,37(4):238-240.
[29]SZESZKO PR,GUNNING DF,ASHTARI M,et al.Reversed cerebellar asymmetry in men with first-episode schizophrenia[J].Bio Psychiatry,2003,53(5):450-459.
[30]PARK HJ,WESTIN CF,KUBICHI M,et al.White matter hemisphere asymmetries in healthy subjects and in schizophrenia:a diffusion tensor MRIstudy[J].Neuroimage,2004,23(1):213-223.
[31]ZHU JN,YUNG WH,CHOW BKC,et al.The cerebellar hypothalamic circuits:potential pathways underlying cerebellar involvement in somatic visceral integration[J].Brain Res Rev,2006,52(1):93.
[32]王建军,蒲咏梅.小脑间位核和顶核对下丘脑外侧区神经元电活动的影响[J].中国科学(C辑),1997,27(3):272-278
[33]GOLANOV EV,REISDJ.Neuroprotective electrical stimulation of cerebellar fastigial nucleus attenuates expression of periinfarction depolarizingwaves(PIDS)and inhibits cortical spreading depression[J].Brain Res,1999,818(2):304-315.
[34]NAGASAWA H,KOGURE K.Correlation between cerebral blood flow and histologic changes in new rat model of middle cerebral artery occlusion[J].Stroke,1989,20(8):1037-1043.
[35]MIURA M,TAKAYAMA K.The site of the origin of the socalled fastigial pressor response[J].Brain Res,1988,473(2):352-358.
