脑梗死患者肠道菌群紊乱与恢复研究☆
2018-06-06游超曾秀丽高徐璇谭楚红何彦周宏伟尹恝
游超 曾秀丽 高徐璇 谭楚红 何彦 周宏伟 尹恝○☆
脑梗死是一种多因素导致的疾病,近年来一系列的研究发现肠道菌群在卒中的发生发展中有重要作用[1-7],是一类新的卒中危险因子。研究表明大动脉粥样硬化性脑卒中/TIA患者肠道菌群显著紊乱[1]。小鼠肠道菌群可通过调节肠道γδT细胞影响小鼠卒中结局,从而在机制上证实了肠道菌群通过免疫途径影响卒中后脑损伤[2]。ALEXANDER等[8]通过显微镜对脑梗死患者的肠道菌群进行动态观察,发现脑梗死患者肠道中的数种常驻菌和机会致病菌在卒中后相继出现改变,并在22 d后逐渐恢复至对照组水平。但该研究采用的方法能观察到的细菌种类较少,不能反映整体的肠道菌群组成和恢复特征。本研究拟通过16S rRNA基因测序的方法,进一步探索脑梗死患者肠道菌群整体的变化和恢复特征。
1 对象与方法
1.1 研究对象连续收集2016年5月至2016年9月在南方医科大学南方燕岭医院神经内科住院的脑梗死患者28例。入组标准:①诊断符合中国急性缺血性脑卒中诊治指南(2014版)诊断标准[9];②年龄大于18岁;③发病48 h内入院;④未行静脉溶栓和(或)血管内治疗;⑤1个月之内无抗生素使用史;⑥1个月之内无益生元和(或)益生菌使用史;⑦患者本人或授权委托人签署知情同意书并配合留取标本。排除标准:①合并肿瘤性疾病;②合并炎症性肠病、消化道大出血或肝硬化;③合并需要使用抗生素的感染;④签署同意书后拒绝提供研究所需粪便样本;⑤正在参与其他干预性研究。同时在本课题组的数据库中根据年龄和性别匹配28例无心脑血管疾病病史的健康体检者作为对照组(healthy control,HC),对照组与疾病组排除标准相同。脑梗死患者中,我们在入组后多次采集患者的粪便样本并根据发病时间到标本采集时间的间隔分为4个组,分别表示为T1组(1~4 d),T2 组(5~7 d),T3 组(8~20 d),T4 组(29~119 d);将28例患者的首个粪便样本命名为脑梗死急性期组(acute ischemic stroke,AIS)。
本研究遵循赫尔辛基宣言,获得了南方医科大学南方医院伦理委员会的批准 (伦理批准号:NFEC-2016-148),征得了参与者本人或授权委托人的同意并签署知情同意书。
1.2 标本采集、粪便总DNA提取、PCR扩增和测序所有新鲜粪便样本在采集后4 h内保存在-80℃的冰箱中。随后采用深圳易瑞生物技术有限公司的粪便样本总DNA磁珠法提取试剂盒提取粪便中的细菌总DNA。通过实时定量PCR扩增细菌16S rRNA的V4可变区。使用EZNA Gel Extraction Kit(Omega,USA)将混合后的PCR产物进行纯化后送广州美格生物科技有限公司进行16S rRNA测序。
1.3 生物信息的获取与统计获取肠道菌群原始数据文件后,在QIIME平台[10]上进行测序序列的质控、去嵌合、菌群指标的具体分析与统计。
α多样性是指单个样本的物种多样性,有数十种度量指标。本研究采取的指标为表示系统发育多样性的系统发育多样性指数(phylogenetic diversity whole tree,PD whole tree)和表示丰富度和均一度的Shannon指数。β多样性反映了不同样本在物种多样性方面存在的差异大小,本研究采用Bray-Curtis距离矩阵表示不同样本之间的β多样性差异,并采用主坐标分析(principal coordinates analysis,PCoA)的方法将距离矩阵降纬展示在可视化的三维立体图形中,样本间距离的远近表示样本间相似性的大小,组间多样性差异的显著性采用Adonis test进行检验决策,检验水准α取0.05。
线性判别效应分析(linear discriminant analysis effect size,LEfSe)[11]是一种高维生物标志物分析的算法,能够找出基因组的特征,描述两个或更多微生物群落之间具体的微生物差异标志物和效应大小。本研究采用LEfSe描述不同组间的菌群差异标志物。
2 结果
2.1 脑梗死患者肠道菌群显著紊乱一般临床检验指标分析显示,相较于HC组,AIS组白细胞计数显著升高而血红蛋白浓度、血清白蛋白、总胆固醇和低密度脂蛋白等显著降低;两组之间空腹血糖、甘油三酯和尿酸等无统计学差异(表1)。菌群α多样性分析显示,相比于HC组,AIS组PD whole tree显著升高(图 1A,P=0.002),Shannon 指数有升高的趋势但差异无统计学意义(图1B)。基于Bray-Curtis的β多样性分析显示,AIS组和HC组之间整体肠道菌群有显著统计学差异(Adonis test,P<0.001,图 1C)。
进一步的LEfSe分析显示两组之间多个分类群有显著差异,当LDA界值取3.5时,和HC组相比,AIS组变形菌门和厚壁菌门显著增加而拟杆菌门显著降低。在更低的分类水平上,AIS组厚壁菌门下的链球菌科、瘤胃球菌属、产芽孢菌属、梭状芽孢杆菌及Blautia相对丰度显著升高,变形菌门下的肠杆菌科、慢生根瘤菌科相对丰度显著升高;拟杆菌属、普氏菌属和梭杆菌属相对丰度显著降低(图 1D)。
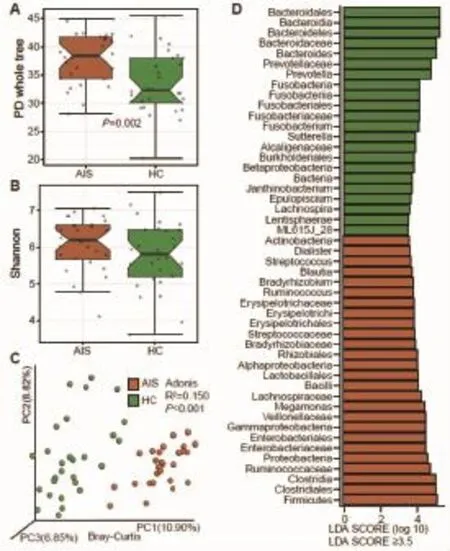

图1 H C组A I S组菌群差异结果比较 (A)系统发育多样性;(B)S h a nnon指数;(C)基于Br a y-Curtis距离的β多样性三维P Co A图,每一个点代表一个样本,坐标轴下的数值代表对差异的解释度;(D)两组LEf S e结果差异分类群及其效应值(只展示L D A≥3.5的分类群)
2.2 脑梗死后肠道菌群动态变化结果显示,HC组和T1、T2及T3组之间PD whole tree和Shannon指数均无显著统计学差异,而T4组PD whole tree和 Shannon指数显著降低 (图 2A-B,Kruskal–Wallis秩和检验)。基于Bray-Curtis距离的β多样性分析表明,HC组和 T1、T2、T3及 T4组之间均有显著统计学差异;T1、T2及T3三组之间无显著统计学差异;T4组和T1、T2及T3组之间有显著统计学差异(图2C-D)。相比于T1、T2和T3组,T4组在PC1轴上及空间距离上更靠近HC组,且差异有统计学意义(图2D)。
在菌群构成比例方面,和HC组相比,3周内的脑梗死患者肠道菌群发生了剧烈的变化,这种变化将维持至少3周的时间(T1、T2及T3三组),在第4周后(T4组)患者的肠道菌群构成和健康对照组相似(图2E-F)。这种变化在门水平上主要表现为变形菌门、厚壁菌门及拟杆菌门相对丰度的波动(图2E)。而在科水平上主要表现为拟杆菌科、毛螺旋菌科、肠杆菌科和普氏菌科等相对丰度的波动(图 2F)。
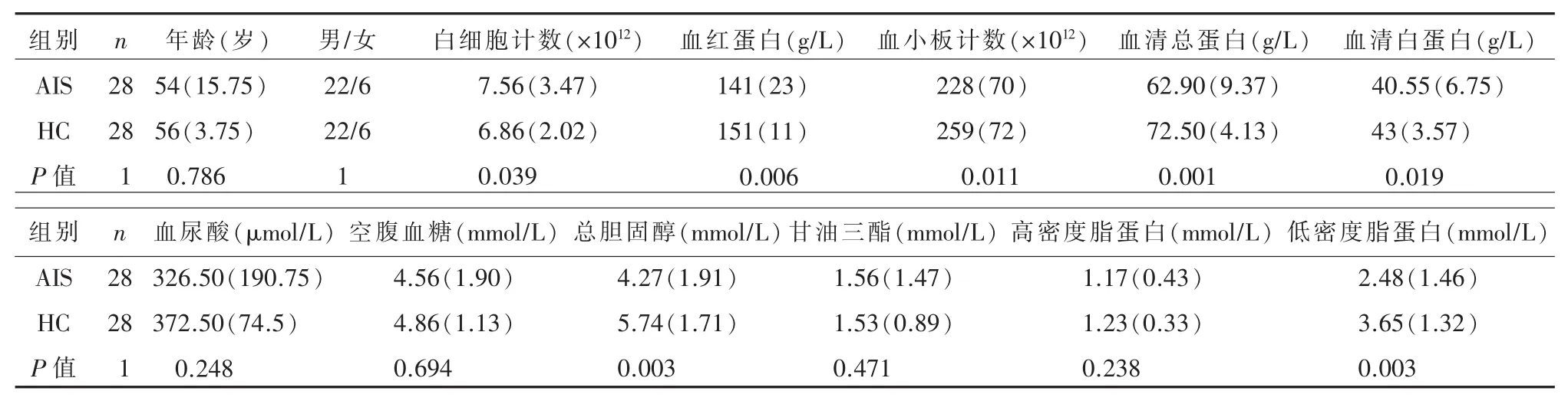
表1 脑梗死患者和对照人群一般资料
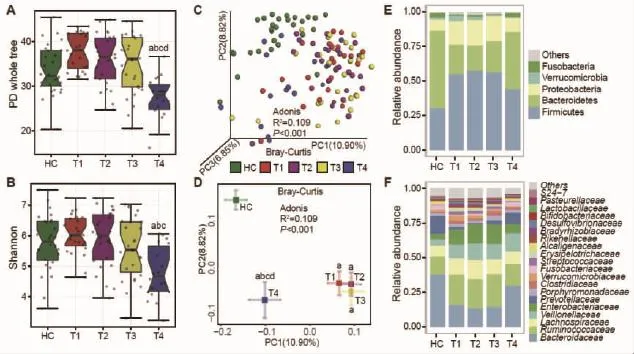
图2五组菌群差异结果比较 (A)系统发育多样性;(B)S h a nnon指数;(C)基于Br a y-Curtis距离的β多样性三维P Co A图,每一个点代表一个样本,坐标轴下的数值代表对差异的解释度;(D)基于Br a y-Curtis距离的β多样性二维P Co A图,“十”表示各组在二维平面上的平均值和标准差;(E)五组菌群门水平构成相对丰度堆积图;(F)五组菌群科水平构成相对丰度堆积图。a:和H C 相比 P<0.05;b:和 T1相比 P<0.05;c:和 T2相比 P<0.05;d:和 T3相比 P<0.05;Krusk a l-W a llis检验
3 讨论
研究结果表明,和健康对照组相比,脑梗死患者肠道菌群出现显著紊乱。其中最为显著的变化是变形菌门和厚壁菌门的相对丰度增加及拟杆菌门的相对丰度降低。拟杆菌门是正常健康成人肠道菌群中最主要的菌门,其下含有大量的有益于宿主或对宿主无害的肠道常驻菌,其相对丰度的降低代表着肠道正常结构的改变[12-13]。健康成人肠道菌群中变形菌门仅占一小部分,但其却是其中最不稳定的菌门[14],变形菌门的增加被认为是肠道菌群紊乱的生物学标志物和潜在的疾病诊断标志物[13]。变形菌门过度增加会导致肠道固有菌群对病原微生物定殖的抵抗力下降,进而促进病原微生物导致的炎症反应和入侵[13];STANLEY等[7]的研究表明小鼠卒中相关性肺炎的细菌来源于肠道;然而在人群研究中,细菌移位可能发生在特定的病理生理条件下,但仍有争议[15]。厚壁菌门也是肠道菌群中另一重要菌门,门下大部分细菌为革兰阳性菌,如毛螺旋菌科、瘤胃球菌科、消化链球菌科等肠道常驻菌。因其具有较厚的细胞壁结构而对外界环境的改变更加耐受,尤其是梭状芽孢杆菌,其在肠道理化环境发生剧烈变化时可产生芽孢而继续存活并进一步繁殖[16]。脑梗死患者肠道菌群中的厚壁菌门及门下细菌相对丰度的增加表明其肠道理化环境发生了剧烈的变化。总的来说,本研究表明急性脑梗死患者肠道菌群出现了显著的紊乱,这种紊乱预示着脑梗死患者肠道环境显著改变,和本课题组之前报道的大动脉粥样硬化性卒中/TIA患者肠道菌群紊乱的研究结果相似[1]。
ALEXANDER等[8]的研究表明卒中患者肠道中的常驻菌浓度在卒中3周后回升至正常水平。在本研究中,我们的结果显示脑梗死患者的肠道菌群在3周内无明显变化,而在4周后其菌群的组成和健康对照相似。两个研究的主要区别是前者采用显微镜计数观察了患者肠道菌群中的几个常驻菌浓度变化,而后者则使用16S rRNA测序的方法评估了患者整个肠道菌群的相对构成变化,研究的侧重点有所不同。但是两个研究的结果都表明脑梗死患者在发病约3~4周后表现出和健康人群相似的肠道菌群构成。然而,本研究还发现T4组肠道菌群的α多样性显著降低,并且β多样性始终和健康对照组之间有显著差异,表明脑梗死后患者的肠道菌群会有一定程度的恢复,但在我们观察的时间范围内(最长119 d)并未完全恢复至健康状态。
关于脑梗死患者肠道菌群在恢复过程中多样性下降的原因目前尚不清楚,可能患者与生活习惯的改变、饮食及药物有关。动物研究表明菌群多样性的降低可能和他汀类降脂药物的长期使用有关。MARTIN等[16]的研究发现阿托伐他汀和普伐他汀连续灌胃12周都可导致小鼠肠道菌群中α多样性显著降低。NOLAN等[17]的研究也表明使用瑞舒伐他汀饲喂1个月可导致小鼠的肠道菌群中的α多样性显著降低。众所周知,他汀类降脂药物是脑卒中一级和二级预防重要组成部分,他汀类降脂药可以降低缺血性脑卒中或TIA的发生率、复发率和死亡率[18]。然而,他汀类药物是否对脑梗死患者肠道菌群产生影响以及脑梗死恢复期患者肠道菌群多样性降低的意义仍需进一步研究。
综上所述,本研究表明脑梗死患者肠道菌群出现显著紊乱,主要表现为机会致病菌的增加和常驻菌的减少,这种紊乱会持续超过3周。4周后患者的肠道菌群结构逐渐恢复并伴随菌群多样性的显著下降。然而,本研究是一个小样本量的观察性研究,研究设计尚有些缺陷,脑梗死患者肠道菌群能否完全恢复至发病前状态以及何时完全恢复、是否和临床预后相关等问题仍需进一步研究。
[1]YIN J,LIAO SX,HE Y,et al.Dysbiosis of GutMicrobiotaWith Reduced Trimethylamine‐N‐Oxide Level in Patients With Large‐Artery Atherosclerotic Stroke or Transient Ischemic Attack[J].JAm Heart Assoc,2015,4(11):e2699.
[2]刘萍,罗本燕.肠道微生态与中枢神经系统疾病的相关性[J].中国神经精神疾病杂志,2016,42(04):251-254.
[3]HOULDEN A,GOLDRICK M,BROUGH D,et al.Brain injury induces specific changes in the caecalmicrobiota ofmice via altered autonomic activity and mucoprotein production[J].Brain Behav Immun,2016,57:10-20.
[4]WINEK K,ENGEL O,KODUAH P,et al.Depletion of Cultivatable Gut Microbiota by Broad-Spectrum Antibiotic PretreatmentWorsens Outcome After Murine Stroke[J].Stroke,2016,47(5):1354-1363.
[5]SADLER R,SINGH V,BENAKIS C,et al.Microbiota differences between commercial breeders impacts the post-stroke immune response[J].Brain Behav Immun,2017,66:23-30.
[6]MALKKIH.Stroke:Gutmicrobiota influence stroke recovery in mice[J].Nat Rev Neurol,2016,12(5):252.
[7]STANLEY D,MASON L J,MACKIN K E,et al.Translocation and dissemination of commensal bacteria in post-stroke infection[J].NatMed,2016,22(11):1277-1284.
[8]SWIDSINSKI A,LOENING-BAUCKE V,KRüGER M,et al.Central Nervous System and the Colonic Bioreactor:Analysis of Colonic Microbiota in Patients with Stroke Unravels Unknown Mechanisms of the Host Defense after Brain Injury[J].Intest Res,2012,10(4):332.
[9]中华医学会神经病学分会,中华医学会神经病学分会脑血管病学组.中国急性缺血性脑卒中诊治指南2014[J].中华神经科杂志,2015,48(4):246-257.
[10]CAPORASO JG,KUCZYNSKI J,STOMBAUGH J,et al.QIIME allows analysis of high-throughput community sequencing data[J].NatMeth,2010,7(5):335-336.
[11]SEGATA N,IZARD J,WALDRON L,et al.Metagenomicbiomarker discovery and explanation[J].Genome Biol,2011,12(6):R60.
[12]BACKHED F.Host-Bacterial Mutualism in the Human Intestine[J].Science,2005,307(5717):1915-1920.
[13]SHIN N,WHON T W,BAE J.Proteobacteria:microbial signature of dysbiosis in gutmicrobiota[J].Trends Biotechnol,2015,33(9):496-503.
[14]FAITH JJ,GURUGE JL,CHARBONNEAU M,et al.The Long-Term Stability of the Human GutMicrobiota[J].Science,2013,341(6141):1237439.
[15]KLINGENSMITH NJ,COOPERSMITH CM.The Gut as the Motor of Multiple Organ Dysfunction in Critical Illness[J].Critical Care Clinics,2016,32(2):203-212.
[16]CAPARROS-MARTIN JA,LAREU RR,RAMSAY JP,et al.Statin therapy causes gut dysbiosis in mice through a PXR-dependentmechanism[J].Microbiome,2017,5(1):95.
[17]NOLAN JA,SKUSE P,GOVINDARAJAN K,et al.The influence of rosuvastatin on the gastrointestinal microbiota and host gene expression profiles[J].Am JPhysiol Gastrointest Liver Physiol,2017,312(5):G488-G497.
[18]中华医学会神经病学分会,中华医学会神经病学分会脑血管病学组.中国缺血性脑卒中和短暂性脑缺血发作二级预防指南2014[J].中华神经科杂志,2015,48(4):258-273.
