局部灌注治疗重症急性胰腺炎感染临床疗效分析
2018-06-05黄进,刘娟
黄 进,刘 娟
(1.成都医学院第一附属医院重症医学科,四川 成都 610500;2.成都市新都区妇幼保健院,四川 成都 610500)
重症急性胰腺炎(Severe acute pancreatitis,SAP)发病急,进展快,病情凶险,若不能获得及时有效的治疗,易危及患者生命[1]。资料显示,在SAP的发病进程中,部分炎性因子可诱发级联瀑布效应,致使患者发生全身炎性反应综合征,甚至多器官功能障碍综合症[2]。此类患者若并发感染,不但可使治疗更为困难,还会增加病死率[3]。为探讨有效治疗SAP感染患者的方法,我院将局部灌注应用于SAP感染患者的临床治疗,疗效满意,现总结如下。
1 资料与方法
1.1一般资料选取2014年7月至2017年6月成都医学院第一附属医院ICU接受治疗的SAP感染患者82例,男49例(59.76%),女33例(40.24%);年龄35~69岁[(48.23±5.31)岁];病程4.90~18.87 h[(8.91±0.94)h];APACH-II评分8.20~18.86分[(14.78±1.54)分];感染部位:呼吸系统43例(52.44%),泌尿系统19例(23.17%),胰腺11例(13.41%),胆道9例(10.98%);类别:非梗阻性胆源性胰腺炎34例(41.46%),酒精性胰腺炎26例(31.71%),暴饮暴食性胰腺炎5例(6.10%),高脂血性胰腺炎8例(9.76%),病因不明者9例(10.98%);合并脏器功能障碍21例(25.61%),未合并脏器功能障碍61例(74.39%)。所有患者均依据中华医学会外科学分会胰腺学组制定的相关标准确诊。纳入标准:符合上述诊断标准患者;发病时间≤24 h患者;未行其他治疗患者;知情同意患者。排除标准:本研究药物过敏患者;内分泌系统及自身免疫性疾病患者;重症肝肾功能损伤患者;肠瘘、肠出血、肠坏死患者;依从性差患者;恶性肿瘤患者。按照随机数字表法将患者分为局部灌注组和全身组各41例,两组一般资料比较差异无统计学意义(P>0.05),见表1。

表1 两组一般资料比较
1.2方法全身组行常规治疗+药物全身治疗。常规治疗:营养支持、胃肠减压、维持水、电解质平衡等。全身治疗:给予醋酸奥曲肽注射液(生产企业:北京四环制药有限公司;国药准字:H20040407;规格:1 ml:0.1 mg)0.6 mg+100 ml葡萄糖注射液(5%);头孢曲松钠[生产企业:上海罗氏制药有限公司;批准文号:国药准字H10983036;规格:1.0 g(按C18 h18 N8O7 S3计)]1.0 g+100 ml生理盐水,静脉滴注,1次/天,7天为1疗程,连续治疗2疗程。
局部灌注组给予常规治疗联合局部灌注治疗。常规治疗同全身组。局部灌注:行腹腔动脉造影,准确掌握胰腺血供及腹腔各血管支配区域,经股动脉插管(以Seldinger技术)至腹腔动脉,于病变区域血管进行置管。病变区域在胰头部于胃十二指肠动脉置管,病变区域在胰体尾部于脾动脉置管,病变区域涉及整个胰腺,则于腹腔干置管,必要时置管于肠系膜上动脉。输液泵24 h持续给药,给药速度20~50 ml/h。灌注药物:醋酸奥曲肽注射液0.6 mg+100 ml葡萄糖注射液(5%),头孢曲松钠1.0 g+100 ml生理盐水。7天为1疗程,连续治疗2疗程。
1.3观察指标观察两组治疗前后血糖、血淀粉酶(AMY)、谷丙转氨酶(ALT)、血肌酐(Scr)、胰高血糖素;血清C反应蛋白(CRP)、肿瘤坏死因子(TNF-α)、血清白介素-6(IL-6)、白介素-1β(IL-1β)等炎性因子;血清CD3+、CD4+、CD8+、CD4+/CD8+等T细胞。以ELISA法检测TNF-α、IL-6、IL-1β;以免疫比浊法检测CRP;以流式细胞仪检测T细胞。上述检测均严格按照各试剂盒要求进行操作。
1.4疗效评价标准依据中华医学会外科学分会胰腺学组制定的相关标准,痊愈:患者临床症状、体征、影像学检查及实验室检查均恢复正常;有效:患者临床症状、体征消失均≥1/2,影像学及实验室检查均基本正常;好转:患者临床症状、体征消失均≥1/4,影像学及实验室检查均较治疗前好转;无效:患者临床症状、体征均消失<1/4或加重,影像学及实验室检查无变化或加重。
1.5统计学方法采用SPSS 19.0统计软件进行数据分析。计量资料比较采用t检验;计数资料比较采用χ2检验。检验水准α=0.05。P<0.05为差异有统计学意义。
2 结果
2.1两组血糖、AMY、ALT、Scr、胰高血糖素比较
治疗前两组血糖、AMY、ALT、Scr、胰高血糖素水平差异无统计学意义(P> 0.05);治疗后两组血糖、AMY、ALT、Scr、胰高血糖素水平均较治疗前降低(P< 0.05);局部灌注组血糖、AMY、ALT、Scr、胰高血糖素水平均低于全身组(P< 0.05),见表2。
2.2两组血清炎性因子比较治疗前两组血清IL-6、IL-1β、TNF-α、CRP水平差异无统计学意义(P> 0.05);治疗后两组血清IL-6、IL-1β、TNF-α、CRP水平均较治疗前降低(P< 0.05);局部灌注组血清IL-6、IL-1β、TNF-α、CRP水平均低于全身组(P< 0.05),见表3。
2.3两组血清T细胞比较治疗前两组血清CD3+、CD4+、CD8+、CD4+/CD8+水平差异无统计学意义(P> 0.05);治疗后两组血清CD3+、CD4+、CD4+/CD8+较治疗前升高,CD8+较治疗前降低(P< 0.05);局部灌注组血清CD3+、CD4+、CD4+/CD8+水平均高于全身组,CD8+低于全身组(P< 0.05),见表4。
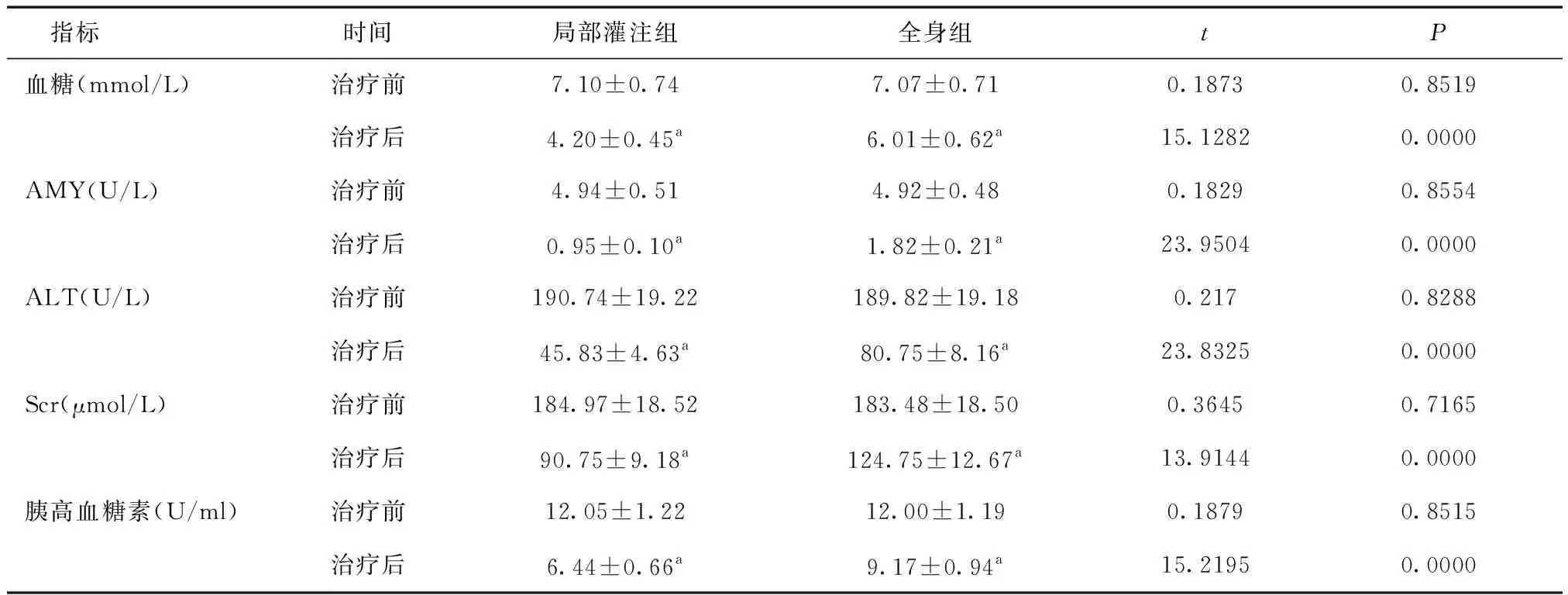
表2 两组血糖、AMY、ALT、Scr、胰高血糖素比较
a与治疗前比较,P< 0.05

表3 两组炎性因子比较
a与治疗前比较,P< 0.05
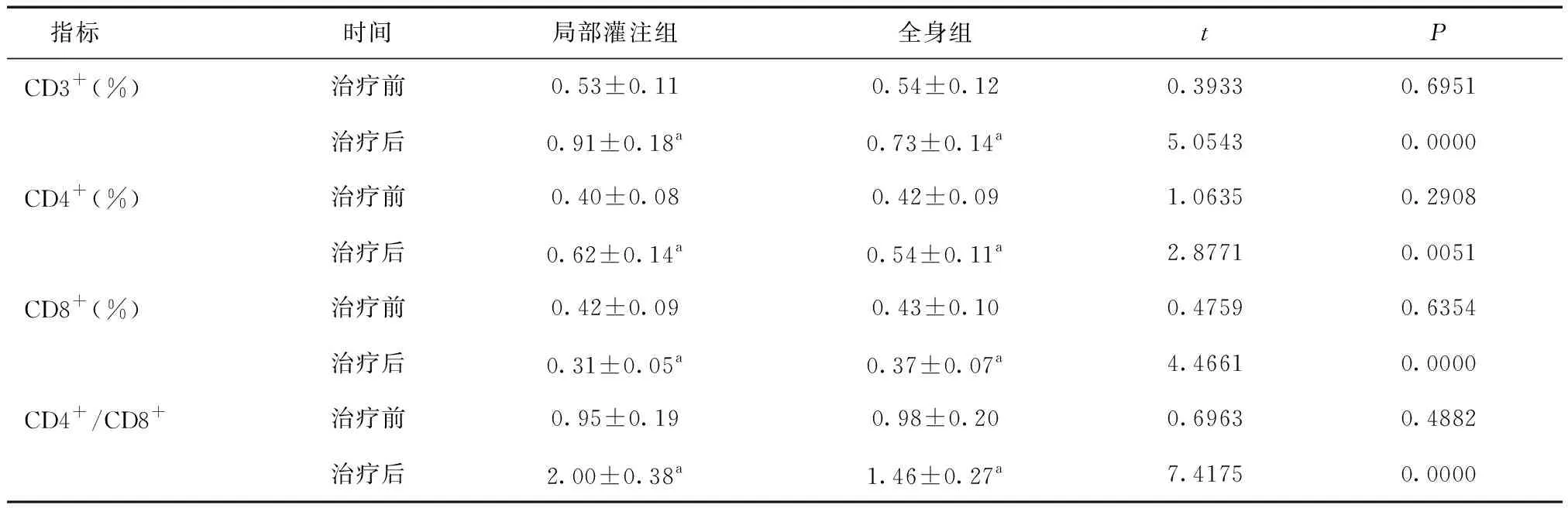
表4 两组血清T细胞比较
a与治疗前比较,P< 0.05
2.4两组临床疗效比较局部灌注组总有效率(97.56%)高于全身组(80.49%),差异有统计学意义(χ2=4.49,P< 0.05)。
3 讨论
炎性反应与胰腺微循环障碍是SAP发生、发展的主要因素原因[5]。发病初期,在损伤因素的刺激下,机体生成大量免疫因子,并经瀑布效应导致机体失控性自我破坏,引发全身炎性反应综合症,若疾病继续进展,可最终导致多器官衰竭[6]。在疾病进展过程中,炎性因子不但能够抑制炎性反应,同时还可抑制机体免疫机制,尤其是细胞免疫,导致免疫失衡,甚至使机体进入无免疫状态,引发继发性胰腺感染以及全身感染,引发菌血症、毒血症,并最终导致患者死亡[7]。胰腺血流量相对较少,其小叶内动脉为终末动脉,故其对缺血极为敏感[8]。炎性反应可抑制胰腺血液灌注,引发微循环障碍,致使静脉给药水平严重降低[9]。缺血还可导致胰腺微血管痉挛及血液流变学改变,进而破坏血胰屏障,引发胰腺坏死[10]。
在SAP的治疗上,既往多通过静脉路径全身给药,但由于该类患者胰腺血液灌注水平较差,血药浓度较低,难以充分发挥作用,且药物可经肝脏代谢,从而进一步减少了局部血药浓度[11]。与全身给药相比较,动脉灌注具有下述优势:①动脉灌注可通过动脉超选择给药的方式直接将药物输入胰腺,有效提高胰腺血药浓度[12];②局部动脉灌注直接供药,不经肝脏代谢,可使药物充分发挥作用[13];③局部灌注还可减少药物使用量,降低药物导致的不良反应[14];④病变区域的新生炎性毛细血管有利于血药分布,提高药物使用效率[15];⑤回流至肝脏的药物经代谢后可再次进入胰腺,可进行二次治疗,有效提高了药物利用率[16]。
感染是导致SAP患者死亡的重要因素,若胰腺坏死合并感染可促进器官衰竭的快速发展,危及患者生命[17]。研究证明,胰周炎性反应程度、胰腺坏死状况、胰腺坏死合并感染及器官衰竭影响SAP患者预后的因素,其中胰腺坏死合并感染是导致患者死亡的重要因素[18]。究其原因,主要是由于炎性反应抑制机体免疫,致使机体进入无免疫状态,此时若并发感染,则感染极难控制,并产生多种并发症,导致患者死亡[19]。在本研究中,治疗后两组肝、肾、胰腺功能指标均大幅好转,炎性因子水平明显降低,T细胞水平显著升高,且局部灌注组各指标改善情况及临床有效率均优于对照组,提示局部灌注治疗SAP较全身给药更具优势。
总之,局部灌注治疗SAP感染可有效降低胰腺炎性反应,快速纠正免疫失衡,彻底杀灭导致感染的病原微生物,改善胰腺及肝肾等脏器功能,提高临床疗效,促进患者转归,值得临床应用。
[1] Huang W,Windsor JA.Fulminant or Early Severe Acute Pancreatitis Is Overlooked by Classifications of Severity[J].Crit Care Med,2017,45(7):e744-e745.
[2] 汪明灯,黄顺伟,姜东辉,等.早期目标指导联合血浆液体复苏对重症急性胰腺炎预后影响[J].中华胰腺病杂志,2014,14(2):115-117.
[3] Mandal AK,Chaudhary S,Shrestha B,et al.Efficacy of Prophylactic use of Ciprofloxacin and Metronidazole in Mild and Moderately Severe Acute Pancreatitis[J].JNMA J Nepal Med Assoc,2017,56(206):207-210.
[4] 中华医学会外科学分会胰腺外科学组.重症急性胰腺炎诊治指南[J].中华外科杂志,2007,45(11):727-729.
[5] 马登超.血必净注射液对重症急性胰腺炎血清炎性细胞因子和血液流变学指标的影响[J].中国中医急症,2015,24(2):353-354.
[6] Rao SA,Kunte AR.Interleukin-6:An Early Predictive Marker for Severity of Acute Pancreatitis[J].Indian J Crit Care Med,2017,21(7):424-428.
[7] 田湘萍,许建民,刘兰霞,等.超声引导下腹腔置管灌洗对重症急性胰腺炎患者脏器功能及炎性因子的影响[J].中华内分泌外科杂志,2015,9(6):516-517.
[8] Li J,Wu Y,Zhang S,et al.Baicalein protect pancreatic injury in rats with severe acute pancreatitis by inhibiting pro-inflammatory cytokines expression[J].Biochem Biophys Res Commun,2015,466(4):664-669.
[9] 高友兵,田少林,刘伟,等.区域动脉灌注治疗对重症急性胰腺炎患者炎性因子的影响[J].中国现代普通外科进展,2015,18(4):285-287.
[10]Rosenberg A,Steensma EA,Napolitano LM,et al.Necrotizing pancreatitis:new definitions and a new era in surgical management[J].Surg Infect (Larchmt),2015,16(1):1-13.
[11]张清,郑宇,李志伟.连续性区域动脉灌注联合中药治疗重症急性胰腺炎的效果[J].中国医药导报,2017,14(11):128-131.
[12]李宝华,王文辉,周怀琪.系统评价区域灌注和全身给药治疗重症急性胰腺炎的效果[J].中国介入影像与治疗学,2013,10(1):19-23.
[13]Deng ZG,Zhou JY,Yin ZY,et al.Continuous regional arterial infusion and laparotomic decompression for severe acute pancreatitis with abdominal compartment syndrome[J].World J Gastroenterol,2011,17(44):4911-4916.
[14]闫国诚,王双全,李强,等.钙拮抗剂联合奥曲肽区域动脉灌注治疗重症急性胰腺炎临床研究[J].海南医学,2012,23(15):31-32.
[15]杜江.区域动脉灌注和静脉注射乌司他丁对重症急性胰腺炎的疗效及对机体炎症应激反应的影响[J].海南医学院学报,2014,20(12):1636-1638.
[16]肖定,游建,金鑫.区域灌注天普洛安治疗重症急性胰腺炎的研究[J].中华实验外科杂志,2015,32(11):2844-2846.
[17]陶福正,陈仁辉,陈英姿.重症急性胰腺炎腹腔感染不同抗菌药物治疗方案的成本-疗效分析[J].中华医院感染学杂志,2015,25(9):2004-2006.
[18]孙燕,杨兴菊.重症急性胰腺炎患者腹腔感染的危险因素分析[J].中华医院感染学杂志,2014,24(5):1217-1219.
[19]Minkov GA,Yovtchev YP,Halacheva KS.Increased Circulating CD4+CD25+CD127low/neg Regulatory T-cells as a Prognostic Biomarker in Acute Pancreatitis[J].Pancreas,2017,46(8):1003-1010.
