肝癌切除患者围手术期应用加速康复外科理念的临床效果观察
2018-06-05余筱卉
张 雯,余筱卉
(四川省医学科学院·四川省人民医院肝胆胰脾外科,细胞移植中心,四川 成都 610072)
近年来,加速康复外科(the EnhancedRecovery after Surgery,ERAS)理念已经得到越来越多临床医生的重视和认可。ERAS理念是指在术前、术中及术后应用各种已证实有效的方法,以减少手术应激及并发症,加速患者术后的康复的方法,它是一系列有效措施的组合,包括:①术前准备方法的改进;②合理的麻醉及手术方案;③强化术后康复治疗等。我科于2016年3月开始在肝癌切除手术患者围手术期中应用ERAS理念管理模式,取得理想效果。现将结果报道如下。
1 资料与方法
1.1一般资料选取2016年3~12月我科收治的100例行择期开腹肝癌切除手术患者。其中男71例(71%),女29例(29%),年龄24~71岁[(52.6±4.1岁)]。纳入标准:①术前诊断原发性肝癌患者需符合2011年卫生部《原发性肝癌诊疗规范》中肝细胞癌临床诊断标准及手术适应症。②肝癌为首次发现且术后病理结果诊断为原发性肝细胞癌。③患者为18岁以上成人,一般情况良好,术前检查未发现合并其他系统严重疾病。④术中失血量小于1500 ml,输血量少于4U(800 ml)。⑤术前未接受免疫抑制剂及抗病毒治疗,未接受抗肿瘤治疗或化疗。⑥术前肝功能Child-Pugh分级为A级或B级。⑦手术均顺利行择期肝脏部分切除术(R0切除),不涉及除胆囊外的其他脏器切除。排除标准:①急诊手术及肝移植;②年龄在16 岁及以下儿童;③继发性肝脏恶性肿瘤患者。将100例患者采用随机的方法分为加速康复外科组和对照组(传统方式组)各50例。两组患者的术前及术中情况资料见表1。差异均无统计学意义(P> 0.05),具有可比性。
1.2方法传统手术组采用常规围手术处理,术前禁食12 h、禁饮4~6 h,留置导尿管、留置鼻胃减压管。单一全麻下手术,术前常规预防性使用抗生素,常规放置腹腔引流管至腹腔引流液少于50 ml/d。术后不刻意限制补液量,术后镇痛采用按需止痛模式,即患者主诉疼痛时,护士对患者进行疼痛评估后,根据评估结果遵医嘱给予肌注呱替啶、曲马多等止痛处理。术后48 h 拔除尿管,肛门排气后拔除胃管、开始流质饮食。术后2~3 天可以下床活动。加速康复外科组的护理措施如下:
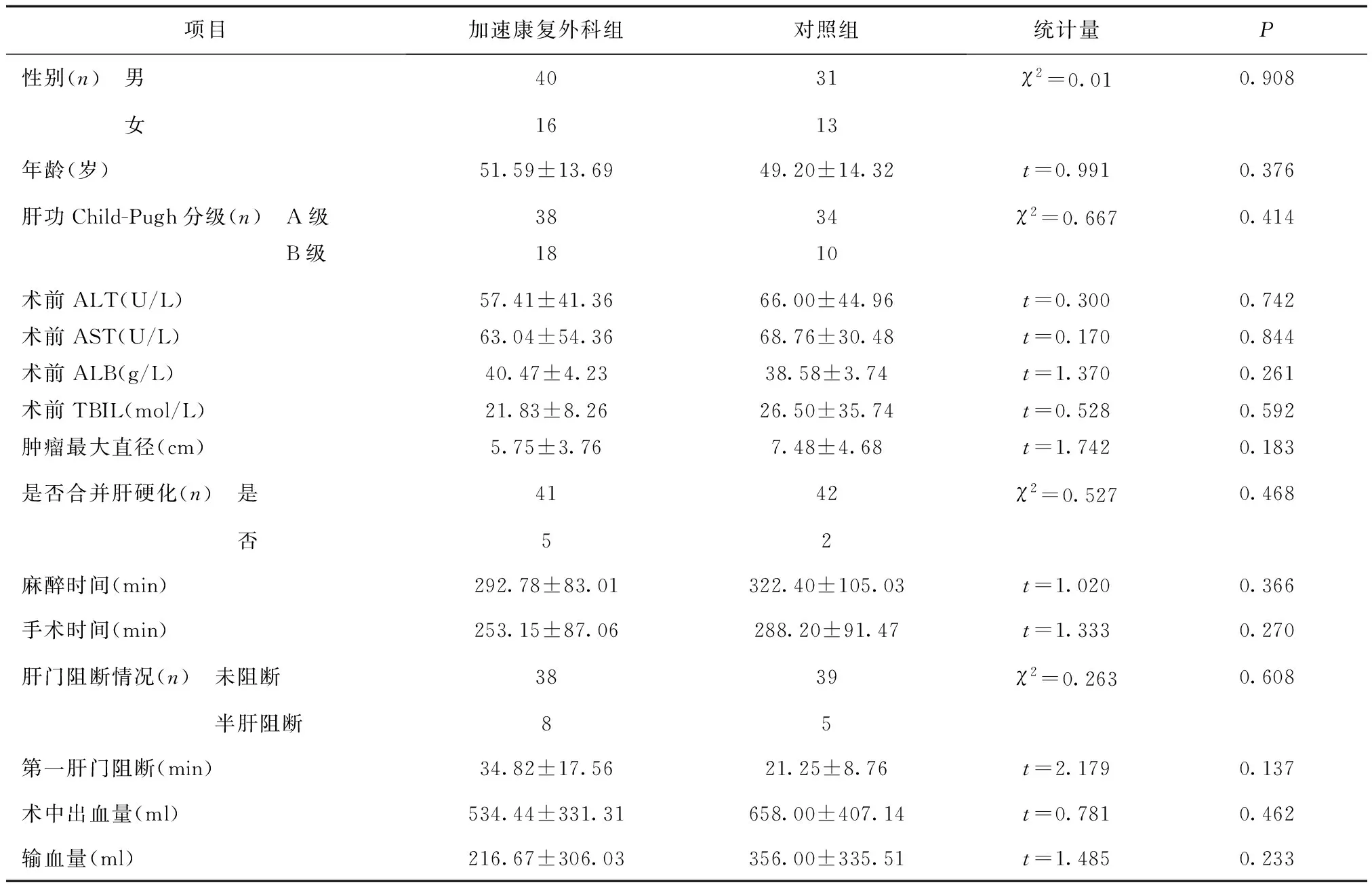
表1 两组患者术前及术中各项临床资料
1.2.1术前准备 ①多模式宣教:利用宣传页、影音、床旁交流、综合评估等手段,减少患者的紧张情绪和心理应激。②术前不行肠道准备。③术前一天建议以流食和半流食为主:蒸鸡蛋、稀饭、果汁、各种清汤等。④手术当日术前禁食6 h,禁水2 h。术前2 h可口服10%葡萄糖注射液 250 ml。⑤切开皮肤前0.5~1 h预防性使用抗生素,手术超过3 h 追加一次。
1.2.2术中操作 ①手术室麻醉后留置导尿管,不常规留置胃管。②全麻前进行中胸段的神经阻滞,使用短效静脉或吸入麻醉剂,术后留置镇痛泵。③防止术中体温过低:调节室温在25 ℃左右,使用保温毯和温液仪,手术结束时用50 ℃生理盐水冲洗腹腔。④术中彻底止血,不常规使用腹腔引流管,肝创面大可选择性放置腹腔引流管,观察24~48 h无出血及时拔除。
1.2.3术后康复指导 ①术后当天生命体征平稳可早期床上活动,如有效咳嗽、抬臀抬腿运动、握拳抬臂运动,术后第一天在医护人员床旁指导和家属帮助下可下床活动2 h,第2、3 天可下床活动2-4 h以上;无前列腺肥大的患者,术后1天尽早拔除尿管。②疼痛控制:采用规范化疼痛管理模式,手术前通过护士宣讲、宣传栏、宣传手册等多种形式进行疼痛相关知识的学习。一般患者采用数字分级法(NRS),而针对高龄和文盲患者使用面部表情疼痛评分法(FPS-R)进行疼痛评估。根据对患者的疼痛评估,采用超前镇痛、按时止痛、多模式镇痛相结合的止痛措施,目标是控制疼痛评分<4分;③肺部感染的预防:术前开始进行吹气球等深呼吸锻炼,术后采用雾化吸入、辅助咳痰和早期下床锻炼。④防治深静脉血栓形成:深静脉血栓评估后,按照三级预防措施,给予防治。⑤术后控制输液量,一般输液量控制在40 ml/(kg·d)左右;⑥术后的饮水进食计划:手术当天全麻清醒6 h后,开始进温开水、嚼口香糖等,促进胃肠功能恢复;术后第一天米汤20 ml/30 min,无腹胀恶心呕吐,24 h总量约500 ml;术后第二天:半流质100~200 ml/2 h,无腹胀恶心呕吐,24 h总量约1000 ml;术后第三天开始逐渐恢复至进食固体食物。⑦出院标准:可进食半固体饮食,每日经口进食量大于1500 ml;每天自主下床活动超过6小时;恢复排气排便;体温正常,血液化验正常;切口愈合良好。
1.3观察指标记录两组患者术后离床活动、肛门排气时间、住院时间、住院总费用以及疼痛控制满意度等。使用我科室自制的满意度调查表,评价患者对护理的满意度。其中评分10分为很满意,8~9分为满意,6~7分为基本满意,≤5分为不满意。满意度=(很满意例数+满意例数+基本满意例数)/总例数×100%。
1.4统计学方法应用SPSS 13.0 统计学软件进行数据分析。计量资料以均数±标准差表示,组间比较采用t检验。计数资料以百分率表示,组间比较采用χ2检验。P< 0.05为差异有统计学意义。
2 结果
2.1两组围手术期相关指标ERAS组术后离床活动时间、肛门排气时间、住院时间、住院总费用均较对照组显著缩短,差异有统计学意义(P< 0.05),见表2。

表2 两组患者离床活动、肛门排气及住院时间、住院总费用比较
2.2两组患者疼痛控制满意度ERAS组患者疼痛控制满意度(98.0%)明显高于对照组(78.0%),差异有统计学意义(χ2=7.67,P< 0.05),见表3。

表3 两组患者满意度调查比较 [n(%)]
3 讨论
ERAS早期的倡导者及实践者是Kehlet[1,2],他最早提出快速康复外科(fast treatsurgery,FTS)的理念,并在许多病种的手术患者中积极探索其临床可行性及优越性,取得了很大成功。
肝切除术是肝脏各种原发性及继发性肿瘤的主要治疗方法,也是一种术后恢复慢、并发症多、病死率较高的大手术。随着外科技术水平的提高和围手术期管理的强化,肝切除手术病死率已低于5%[3],但并发症发生率仍高达15%~48%,术后平均住院时间为10 d[4]。肝切除术后并发症包括出血、胆瘘、腹腔脓肿形成、肝功能衰竭、胸腔积液、肾功能不全、肺部感染、切口感染等。加强围手术期管理,减轻围手术期患者的应激、降低术后并发症是肝切除术后快速康复的重点。本组研究结果显示,ERAS的应用可缩短术后离床活动、肛门排气、住院时间。传统的术前准备包括禁食12 h、禁饮4~6 h,术前留置尿管及胃管及肠道准备等,然而过长时间的禁食会增加患者饥饿感、降低手术耐受力,同时可诱发低血糖及术后胰岛素抵抗,增加围手术期补液量,加重应激反应。研究证实,术前晚及术前2 ~ 4 h 进食一定量的流质不仅不会增加麻醉风险,反而可缓解患者的焦虑和饥饿感,提高手术耐受力,减轻术后胰岛素抵抗等[5]。我们术前6 h 让患者禁食固体食物,术前2~3 h 让患者饮10%GS 250 ml,麻醉后留置导尿管,不常规留置鼻胃减压管,使患者处于更合适的合成代谢状态,有利于患者耐受手术,促进术后康复。
由于传统模式组术后切口疼痛明显,各种引流管不方便离床,往往不能早期下床活动,一般要在术后30 多个小时才能坚持下床活动,胃肠功能恢复慢,住院时间长。而ERAS 组患者术后胃肠功能恢复早,术后6 h 患者就开始进食流质,有利于胃肠血液灌注,从而增加肝门脉血流灌注,促进肝功能恢复。ERAS组的术后住院时间明显缩短,表明ERAS在缩短住院时间方面存在明显的优势;首次排气时间是评价肠道功能恢复的一个重要指标,排气时间的提前表明ERAS可加速术后肠道功能的恢复,有利于患者尽早经口进食,早期进食不仅为机体提供营养物质,还能对肠黏膜有滋养作用,从而减轻肠道黏膜的损伤,减少肠道菌群易位,降低术后并发症的发生率,加速患者康复[6]。在住院费用方面ERAS也表现出明显的优势。
肝脏外科手术不仅涉及肝脏、胆道两大器官,也常涉及胃肠、脾脏、血管等,又影响消化、循环、免疫等重要系统功能。ERAS的实质就是对传统围手术期的各种常规治疗措施加以改良并重新优化。ERAS的内容涉及到多个学科领域,并非外科学的独立分支,而是对传统外科学的重要补充和完善[7]。ERAS是一种为了减轻炎症反应和加速患者康复的多学科合作模式[8],其主要的措施是针对阻碍患者术后恢复以及诱发术后并发症的高危因素进行干预,从而减少手术应激,加速患者康复。同时,保存术前良好而完善的组织和器官功能也是保证其成功的重要前提,它是多个技术的结合,这些技术包括硬膜外或局部麻醉,微创技术,最佳的疼痛控制和积极的术后康复,这是一个多学科协作的过程。我们的经验是应用ERAS围手术管理实施肝切除术能促进患者胃肠功能恢复、住院时间明显缩短、住院费用明显减少、加快患者康复。
[1] Wilmore DW,Kehlet H.Management of patients in fast track surgery[J].Bmj Clin Res,2001,322(7284):473-476.
[2] Henrik K,Wilmore DW.Multimodal strategies to improve surgical outcome[J].Am J Surg,2002,183(6):630-641.
[3] Palavecino M,Kishi Y,Chun Y,et al.Two-surgeon technique of parenchymal transection contributes to reduced transfusion rate in patients undergoing major hepatectomy:analysis of 1557 consecutive liver resections[J].Surgery,2010,147(1):40-48.
[4] Jones C,Kelliher L,Dickinsonet M,et al.Randomized clinical trialon enhanced recovery versus standard care following open liver resection[J].Br J Surg,2013,100(8):1015-1024.
[5] 廖萍,张红菊,冯毅,等.加速康复外科护理对直肠癌患者术后康复与营养状况的影响[J].中国肿瘤临床与康复,2017,24(2):231-234.
[6] 黎介寿.营养支持治疗与加速康复外科[J].肠外与肠内营养,2015,22(2):65-67.
[7] 周志刚,李平.加速康复外科理念下肠内营养支持在胃癌患者围手术期的应用[J].实用医院临床杂志,2017,14(5):177-179.
[8] 车国卫,刘伦旭,石应康.加速康复外科临床应用现状与思考[J].中国胸心血管外科临床杂志,2016,23(3):211-215.
