慢性肾脏病3~5期患者血清25-羟维生素D3水平的影响因素分析
2018-06-05李小莉
李小莉
(湖北医药学院附属襄阳市第一人民医院肾病内科,湖北 襄阳 441000)
近年来,慢性肾脏病(chronic kidney disease,CKD)已逐渐成为危害我国广大居民身体健康的主要疾病之一[1]。CKD患者普遍存在维生素D缺乏的情况,且随着维生素D缺乏的加重,患者病情也加重[2]。维生素D是人体内主要的微量元素之一,25-羟维生素D-3[25(OH)D3]是维生素D在肝脏中经25-羟化酶作用下发生羟化作用形成的,无生物活性,是反映人体内维生素D水平的主要指标[3,4]。研究CKD不同分期患者的25(OH)D3缺乏情况,分析影响患者血清25(OH)D3水平的相关因素,有助于CKD患者提高临床疗效和改善生活质量[5,6]。本研究分析影响患者血清25(OH)D3水平的相关因素,以期为临床治疗提供一定的数据参考。
1 资料与方法
1.1一般资料我院2014年11月至2017年11月收治的172例CKD 3~5期患者,均符合美国肾脏病基金会制定的关于CKD的诊断标准[7]:患者肾脏损伤或者肾小球滤过率<60 ml/min持续时间≥3个月;经肾脏病理学检查结果显示肾脏异常或肾损害的实验室指标发生异常。男98例,女74例;年龄17~84岁[(56.38±8.32)岁];其中慢性肾小球肾炎82例,高血压肾病43例,糖尿病肾病27例,多囊肾7例,尿酸性肾病6例,其他7例。本研究患者及家属均自愿签署知情同意书,并经我院伦理委员会批准。排除标准:入选前近1个月内采用降钙素、维生素D类药物、双磷酸盐类药物等治疗的患者;严重心、肝功能障碍患者;恶性肿瘤患者;甲状旁腺切除术患者;急性感染期患者。
1.2方法收集患者性别、年龄、糖尿病病史、血压、高血压病史、抽烟饮酒史、体重指数等指标。采集患者清晨空腹静脉血,常规检查血常规、白蛋白(albumin,Alb)、血红白蛋(hemoglobin,Hb)、总胆固醇(total cholesterol,TC)、血钙、血磷、全段甲状旁腺激素(intact parathyroid hormone,iPTH)、血肌酐(Scr)等实验室指标,计算患者的估算肾小球滤过率。利用日本东亚公司Sysmex XE-2100对患者的血常规进行检测,采用德国西门子公司 Dimension RxL MAX生化分析仪对患者的生化指标进行检查;iPTH检查采用德国西门子公司的IMMULIFE 2000进行检测,25(OH)D3水平采用美国罗氏公司的Roche Cobas E411进行检测。将25(OH)D3水平≤15 ng/ml的患者作为缺乏组,>15 ng/ml的患者作为非缺乏组。患者估算肾小球滤过率(estimated glomerularfiltration rate,eGFR)采用CKD-EPI公式[8],男性:①当Scr≤0.9 mg/dl,eGFR=144×(Scr/0.9)-0.411×0.993年龄;②当Scr>0.9 mg/dl,eGFR=144×(Scr/0.9)-1.209×0.993年龄。女性:①当Scr≤0.7 mg/dl,eGFR=144×(Scr/0.7)-0.329×0.993年龄;②当Scr>0.7 mg/dl,eGFR=144×(Scr/0.7)-1.209×0.993年龄。
1.3统计学方法采用SPSS 21.0统计学软件和Excel软件对所得数据进行统计分析。计数资料比较采用卡方检验;计量资料以均数±标准差表示,组间比较采用t检验;影响因素分析采用多元线性回归分析。P< 0.05为差异有统计学意义。
2 结果
本研究非缺乏组25(OH)D3水平为(22.3±6.3)ng/ml,缺乏组25(OH)D3水平为(7.1±2.4)ng/ml,差异有统计学意义(t=22.728,P< 0.05)。
2.1两组临床资料比较缺乏组Hb、ALP、eGFR、iPTH水平低于非缺乏组;Alb、TC、SBP水平高于非缺乏组(P< 0.05),且缺乏组CKD5期所占比例高于非缺乏组(P< 0.05),见表1。
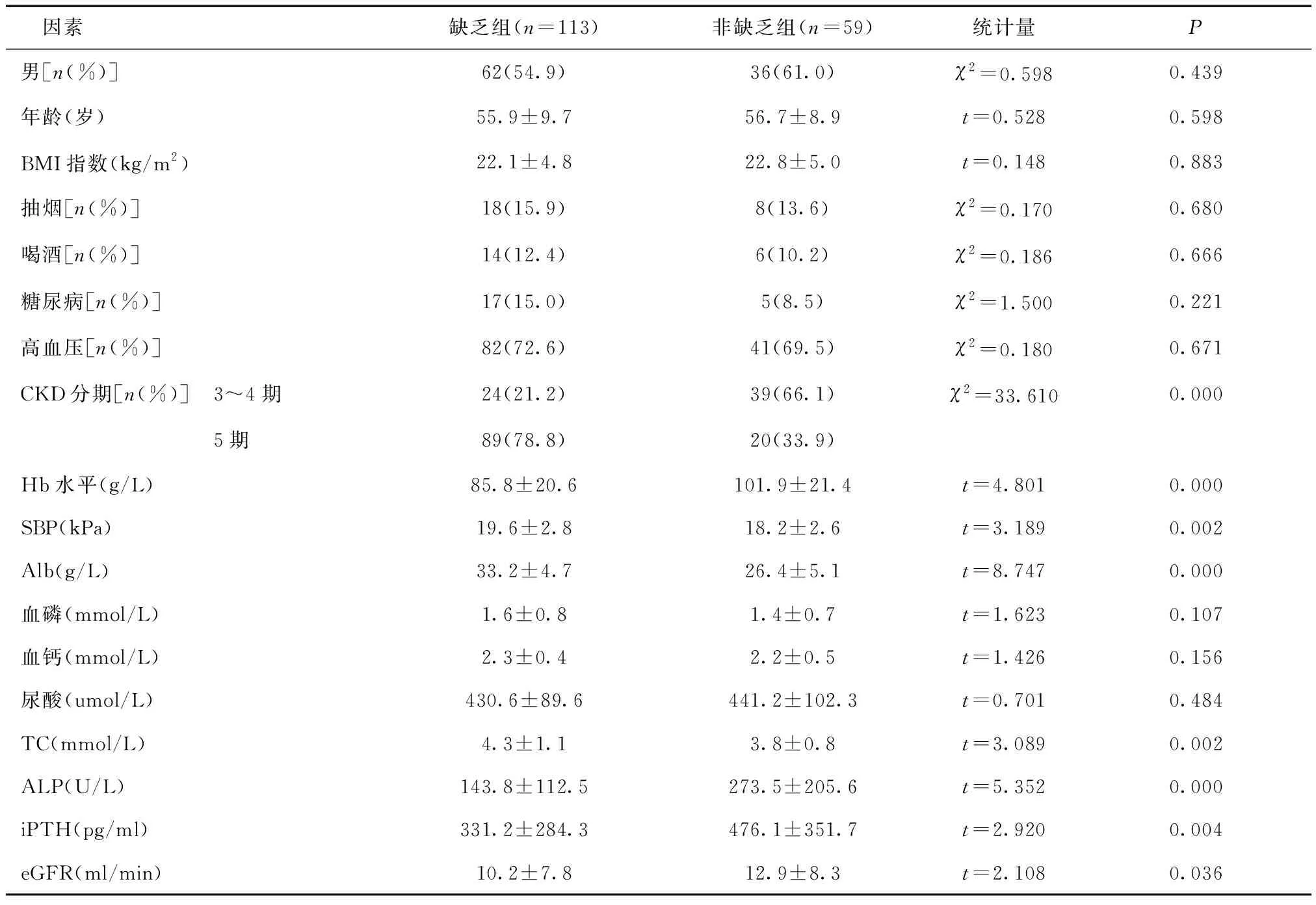
表1 两组临床资料比较
2.2患者25(OH)D3水平的影响因素分析多元线性回归分析显示,患者体内ALP、Alb和TC水平变化是导致发生25(OH)D3缺乏的独立危险因素(P< 0.05),见表2。

表2 患者25(OH)D3水平的影响因素分析
3 讨论
CKD患者在临床治疗过程中预后效果较差,且多数患者伴随有心脑血管疾病,导致其死亡率较高,同时该病临床治疗过程中费用较高,对患者及其家庭带来沉重的经济负担和精神负担[8]。研究表明,维生素D是影响人体健康的重要元素,且对肿瘤、糖尿病、心血管疾病、代谢综合征等疾病的发生、发展存在较大的影响[9,10]。对于CKD患儿而言,维生素D可以通过调节机体内钙磷水平参与骨代谢,同时可以通过抑制机体的信号通路的激活,减轻对细胞的损伤;或者通过抑制肾素的转录,有效降低RASS系统的活性,以抑制蛋白尿;或者通过对体内的细胞免疫产生调节作用,有效抑制炎性反应的发生,进而抑制肾小球硬化[11,12]。有研究指出,维生素D水平的高低有助于延缓CKD患者疾病的发展,且与患者的预后效果存在密切联系[13,14]。25(OH)D3水平是维生素D在体内的主要循环形式,且其半衰期较长,在血清中稳定性良好[15]。因此,分析探讨CKD患者血清25(OH)D3水平及其相关影响因素,有助于临床诊断和预后效果评估。本研究结果显示,CKD 3~5期患者发生25(OH)D3缺乏的比例高达65.70%(113/172)。缺乏组和非缺乏组Hb、Alb、ALP、TC、SBP、eGFR及iPTH等水平比较差异有统计学意义,且缺乏组CKD分期主要为CKD5期。多元线性回归分析结果显示,ALP、Alb和TC水平变化是导致CKD患者发生25(OH)D3缺乏的独立危险因素。CKD患者的临床表现之一为贫血和蛋白尿,而Alb水平下降表示患者的营养状况较差,且缺乏户外活动。因此,通过改善CKD患者的营养状况,提高Alb水平可能有利于改善患者的预后效果。ALP水平可以直接反应机体内骨转运情况,CKD患者生活质量下降与其体内矿物质代谢和骨代谢紊乱相关。因此,通过改善患者维生素D水平,改善机体的骨代谢和矿物质代谢有助于提高患者的生活质量,减少致残率。
综上所述,CKD患者多数存在25(OH)D3缺乏情况,通过改善CKD患者的营养状况,改善脂质代谢和骨代谢紊乱情况可以有效纠正25(OH)D3缺乏,抑制疾病的发展,进而提高患者的生活质量,降低死亡率。
[1] 李培贵,蔡震川,陈亭宇,等.广汉市慢性代谢性疾病与慢性肾脏病患病情况调查[J].实用医院临床杂志,2014,11(1):81-83.
[2] Ng YM,Lim SK,Kang PS,et al.Association between serum 25-hydroxyvitamin D levels and carotid atherosclerosis in chronic kidney disease patients[J].BMC Nephrol,2016,17(1):151.
[3] Lim LL,Ng YM,Kang PS,et al.Association between serum 25-hydroxyvitamin D and glycated hemoglobin levels in type 2 diabetes patients with chronic kidney disease[J].J Diabetes Investig,2017,9 (2):375-382.
[4] 曾玉红,潘明明,张银萍,等.骨质疏松症患者血清25-羟维生素D水平的研究[J].中国骨质疏松杂志,2014,20(11):1343-1346.
[5] Wetmore JB,Kimber C,Mahnken JD,et al.Cholecalciferol v.ergocalciferol for 25-hydroxyvitamin D (25(OH)D) repletion in chronic kidney disease:a randomised clinical trial[J].Br J Nutr,2016,116(12):2074-2081.
[6] 陈小香,谭新,邓伟民.骨质疏松症患者骨密度与血清25羟维生素D的相关性研究[J].中国骨质疏松杂志,2017,23(7):851-855.
[7] 杨华昱,陈海平.关于老年慢性肾脏病诊断标准的争议[J].中华老年多器官疾病杂志,2011,10(6):573-576.
[8] 宋佳,姚瀚鑫,孙淑艳.2012年新发表 CKD-EPI 方程与其他两个方程的适用性比较[J].中国实验诊断学,2016,20(2):255-259.
[9] Kaptein EM,Yi SS,Endres DB,et al.Serum 25-hydroxyvitamin D deficiency;a risk factor for chronic kidney disease in ambulatory indigent patients[J].EndocrPract,2014,20(3):236-243.
[10]陈莹,王玉美,陈丹丹,等.2554例住院患儿血清25-羟维生素D水平分析[J].江苏医药,2017,43(21):1553-1555.
[11] Kumar J,Mcdermott K,Abraham AG,et al.Prevalence and correlates of 25-hydroxyvitamin D deficiency in the Chronic Kidney Disease in Children (CKiD) cohort[J].Pediat Nephrol,2016,31(1):121-129.
[12] 禤文婷,黄秋霞.2型糖尿病患者血清25-羟维生素D水平与微血管病变的相关性[J].广东医学,2015,36(8):1229-1231.
[13] Grant WB.Differences in 25-hydroxyvitamin D concentrations may explain the black-white differences in chronic kidney disease and risk of renal cell carcinoma[J].Epidemiology,2015,26(4):e48-e49.
[14] 刘宁,叶小珍,卢斌,等.初诊2型糖尿病患者血清25-羟维生素D水平与胰岛α细胞及β细胞功能的相关性[J].医学研究生学报,2016,29(1):57-61.
[15] Ennis JL,Worcester EM,Coe FL,et al.Current recommended 25-hydroxyvitamin D targets for chronic kidney disease management may be too low[J].J Nephrol,2016,29(1):63-70.
