重型斑秃患者外周血和头皮细胞因子的检测
2018-06-05巩毓刚
罗 莉,巩毓刚,李 灵,
(1.西南医科大学临床医学院,四川 泸州 646000;2.四川省医学科学院·四川省人民医院皮肤病性病研究所,四川 成都 610072)
斑秃(alopecia areata,AA)是由一系列细胞和细胞因子介导的慢性炎性免疫性疾病[1,2],组织病理以生长期毛囊周围CD4+、CD8+T细胞浸润为特征[3]。本病致病机理至今未明,大部分学者认为与毛囊免疫豁免状态解除有关[4]。T细胞是AA发病的关键,CD4+T细胞通过分泌细胞因子,吸引其他炎症细胞聚集、局部炎症破坏和导致毛囊退行性变,而CD8+T 细胞可直接攻击和破坏毛囊,导致毛囊退行性改变[5,6]。CD4+T细胞通常分为Th1、Th2、Th17、Treg细胞。Th1细胞分泌干扰素-γ(IFN-γ)、白介素2(IL-2)和白介素12(IL-12),主要介导细胞免疫;Th2细胞分泌白介素4(IL-4)、白介素5(IL-5)、白介素10(IL-10)和肿瘤坏死因子-α(TNF-α),主要介导体液免疫。Th1和Th2型细胞因子的平衡在AA发病中举足轻重[7],代表性细胞因子的相对变化已被用作反映Th1型和Th2型免疫应答之间平衡的指标。局部或循环中的Thl/Th2细胞因子表达状态是调控CD4+T细胞分化的关键因素[8],探讨AA发病时局部和全身存在的细胞因子水平将有助于了解AA发病机制。目前国内对AA细胞因子的检测多采用外周血,头皮皮损处细胞因子表达水平的研究少见。本研究我们通过检测重型AA患者外周血及头皮细胞因子的表达水平,并与正常对照组比较,从而将外周血和局部皮损结合起来,以进一步探讨细胞因子在AA发病中的作用。
1 资料与方法
1.1一般资料2015年12月至2017年10月就诊于四川省人民医院的33例重型AA患者,男18例,女15例,年龄9.3~61.7岁[(25.1±12.3)岁],发病年龄5.4~60.2岁[(19.7±14.5)]岁,病程0.4~26年[(5.9±3.5)年]。纳入标准:脱发面积大于头皮面积的1/3或病程超过1年仍无好转的AA[9]。AA的诊断参照临床皮肤病学的诊断标准[10]。排除标准:①1月内使用系统性糖皮质激素、免疫抑制剂及免疫调节剂治疗;②1周内有外用药物史;③1周内有吸烟、饮酒;④脱发区存在明显炎症反应;⑤先天性脱发、静止期脱发、药物性脱发及拔毛癖、头癣、二期梅毒、系统性红斑狼疮、甲亢等疾病所致脱发;⑥伴有炎症性疾病及严重内科疾病;⑦孕妇、哺乳期妇女。征集健康体检者20例作为正常对照组,年龄及性别与重型AA组差异无统计学意义。本研究通过四川省人民医院伦理委员会批准,实验前均签署知情同意书。
1.2酶联免疫吸附试验法收集33例重型AA患者及20例健康体检者外周血标本10 ml,采用双位点夹心酶联免疫吸附法(ELISA)检测外周血血清IFN-γ、IL-2、IL-4、IL-5、IL-10及IL-12表达水平(美国R&D公司试剂盒),具体实验步骤按照试剂盒说明书操作,测定样品中细胞因子的水平。
1.3荧光半定量RT-PCR采用荧光半定量RT-PCR的方法检测33例重型AA患者头皮皮损及20例健康体检者头皮正常组织处IFN-γ、IL-2、IL-4、IL-5、IL-10、IL-12 mRNA表达水平。重型AA组头皮标本取自活动性皮损边缘约1 cm,包括皮损及边缘的正常毛发头皮,正常对照组头皮标本来自于外科头皮手术如皮肤良性肿瘤或色素痣切除术边缘正常头皮组织。本实验采用SYBR Green I实时定量RT-PCR技术,使用仪器为Bio-Rad iQ5,采用管家基因(β-actin)作为内参照基因测定目的基因相对表达量。使用2-△△Ct方法计算结果,ΔCt为重型AA患者及正常对照者样本目的基因Ct值减去各自标本内参照β-actin的Ct值,ΔΔCt为重型AA患者ΔCt平均值与正常对照者ΔCt平均值的差值。
1.4统计学方法数据输入SPSS 17.0软件,计量资料先进行正态性检测,符合正态分布采用t检验,不符合正态分布采用非参数秩和检验。P< 0.05为差异有统计学意义。
2 结果
2.1外周血中细胞因子的表达水平重型AA组血清IFN-γ和IL-12的表达水平显著高于正常对照组,差异有统计学意义(P< 0.01),IL-5的表达水平显著低于正常对照组,差异有统计学意义(P< 0.01),IL-2、IL-4、IL-10表达水平较正常对照组比较,差异无统计学意义(P> 0.05)。见表1。

表1 比较重型AA组及正常对照组血清中细胞因子的表达水平 (ng/ml)
2.2头皮处细胞因子的表达水平重型AA组IFN-γ、IL-12 mRNA表达水平显著高于正常对照组,IL-4 mRNA表达水平显著低于正常对照组,差异有统计学意义(P< 0.01),IL-2 、IL-5、IL-10 mRNA表达水平较正常对照组比较,差异无统计学意义(P> 0.05)。见表2。
3 讨论
AA是一种常见的脱发性疾病,在皮肤病中的发生率为0.7%~3%[11]。目前尚缺乏特效的治疗,可能与其确切的发病机制仍不明确有关。近年来越来越多学者致力于探索AA的发病机制,大部分研究认为本病的发生可能与自身免疫(生长期特异性毛囊抗原、毛囊黑素细胞抗原)相关,且多种细胞因子参与了AA的发病过程[12,13]。
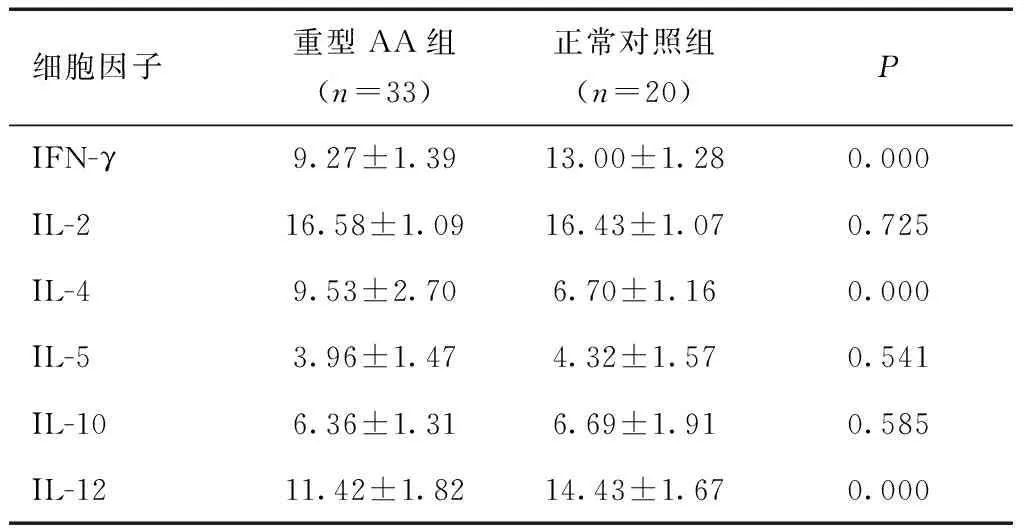
表2 比较重型AA组及正常对照组头皮细胞因子的表达水平
目前外周血细胞因子的报道相对多见,Sadeghi等[14]检测了20例AA患者外周血细胞因子的表达水平,与正常对照组比较,T-bet和IFN-γmRNA的表达显著上调,GATA-3和IL-4 mRNA的表达显著下调,T-bet和IFN-γ、GATA-3和IL-4显著正相关,证实AA患者外周血中Th1/Th2平衡状态发生了漂移。王博等[15]对AA患者的Th1/Th2/TH17型细胞因子的表达水平进行检测,结果表明AA患者血清中IFN-γ表达显著高于正常对照组,且在重型、活动期、病程长患者中最高,提示重型AA患者血清中Th1型细胞因子占优势,且Th2细胞对Th1细胞有一定的拮抗作用。本研究对血清中多种细胞因子进行检测,发现重型AA患者外周血IFN-γ、IL-12表达显著上调,IL-5表达显著下调,提示重型AA患者体内中确实存在Th1/Th2免疫失衡,即Th1亢进而Th2抑制。
目前AA患者局部皮损免疫状况的研究尚存在争议。在Zhang等[16]的研究中,与正常对照组相比,AA患者头皮皮损处真皮浅层的TNF-α mRNA表达升高,IFN-γmRNA表达降低,真皮深层的IL-2、IL-8、IL-5、IL-10 mRNA表达升高,表明AA患者皮损真皮处Th1、Th2细胞因子均呈高表达状态,他们认为IFN-γ表达低于或等于正常对照组,可能与头皮皮肤部分耐受相关。蔡泽明等[17]的研究则表明,与正常对照组相比,AA患者头皮皮损浅层IFN-γ、IL-12 mRNA表达升高,IL-10 mRNA表达降低,皮损深层IL-12 mRNA表达显著升高,结果表明AA患者局部皮损处Thl类因子升高,Th2类因子降低,这种变化可能为浅层炎症所触发。我们使用RT-PCR方法检测了重型AA患者局部头皮Th1/Th2型细胞因子的表达水平,结果亦表明重型AA患者头皮皮损处IFN-γ、IL-12 mRNA的表达升高,IL-4 mRNA表达降低,证实了重型AA患者局部头皮存在Th1和Th2的免疫失衡,且局部头皮与外周血的改变一致。
Th1、Th2细胞由Th0细胞分化而来,细胞因子的种类和细胞因子之间的平衡是调控Th0细胞分化的主要影响因素,如IL-12、IFN-γ促进Th0向分化Th1细胞,Th2的细胞分化依赖IL-4,转录因子T-bet和GATA-3是调控Th0分化、Th1/Th2转换的关键因子[18]。机体处于正常状态时,Th1/Th2细胞因子处于平衡状态,Th1细胞和Th2细胞相互抑制、相互转化,以维持细胞免疫及体液免疫的平衡。当受到抗原、病毒刺激时,Th1/Th2细胞的动态平衡被破坏,机体就可能发生Th1优势漂移介导AA免疫应答[19]。在毛发生长初期,TGF-β1、ACTH、α-MSH、IGF-1具有强烈免疫抑制作用,毛囊MHCⅠ类分子仅少量表达,毛囊自身抗原不会被CD8+T细胞识别,毛囊处于免疫豁免状态[5]。既往研究认为升高的Th1类细胞因子如IFN-γ、IL-12可通过诱导附近毛囊HLA-A、B、C,HLA-DR,MHCⅠ,MHCⅡ类分子和粘附因子ICAM-1表达升高,导致毛囊的免疫赦免丧失,局部自身抗原暴露,被抗原提呈细胞提呈引起CD4+及CD8+T淋巴细胞活化,在Th1细胞因子作用下进一步刺激Th1细胞因子分泌并激活NK细胞、CD8+T淋巴细胞发挥细胞毒作用,杀伤靶细胞,导致AA的发病[20,21]。IL-4及IL-5同为Th2型细胞因子,二者具有协同作用。IL-4被认为是Th2分化的关键细胞因子,也是IgE合成过程中最重要因子,可抑制Thl型细胞的免疫应答,抑制IFN-γmRNA的转录[22]。IL-5能促进T细胞和嗜酸性粒细胞的增值、活化及分化,主要介导Th2细胞反应,在哮喘和变应性鼻炎等变态反应性疾病中发挥重要作用。目前Il-5关于AA的报道相对少见。在我们的实验中分别检测到了血清中IL-4和头皮处IL-5 的下调,提示重型AA患者Th2状态受到抑制,Th2功能的降低导致对Th1抑制水平的降低可能亦是AA发生的原因。
本研究检测了重型AA患者和正常对照组外周血清和局部头皮皮损处细胞因子的表达水平,进一步探讨了Th1和Th2细胞因子在重型AA发病过程中的作用,细胞因子无论是在蛋白水平的外周血还是在分子水平的局部头皮皮损,二者的结果均表现为Th1占优势而Th2抑制。
[1] Estefan J,Ribeiro M,Abad E,et al.Alopecia areata-Part II:diagnosis and pathology[J].Skinmed,2015,13(2):121-126.
[2] Trüeb RM,Dias MFRG.Alopecia Areata:a Comprehensive Review of Pathogenesis and Management[J].Clin Rev Allergy Immunol,2018,54(1):68-87.
[3] Strazzulla LC,Wang E,Avila L,et al.Alopecia areata:Disease characteristics,clinical evaluation,and new perspectives on pathogenesis[J].J Am Acad Dermatol,2018,78(1):1-12.
[4] Ito T.Recent Advances in the Pathogenesis of Autoimmune Hair Loss Disease Alopecia Areata[J].Clin Dev Immunol,2013,2013(1):348546.
[5] Rossi A,Cantisani C,Carlesimo M,et al.Serum concentrations of IL-2,IL-6,IL-12 and TNF-α in patients with alopecia areata[J].Int J Immunopathol Pharmacol,2012,25(3):781-788.
[6] Tembhre MK,Sharma VK.T-helper and regulatory T-cell cytokines in the peripheral blood of patients with active alopecia areata[J].Br
[1] J Dermatol,2013,169(3):543-548.
[7] Ma X,Chen S,Jin W,et al.Th1/Th2 PB balance and CD200 expression of patients with active severe alopecia areata[J].Exp Ther Med,2017,13(6):2883-2887.
[8] 周静.T细胞因子在斑秃免疫学发病机制中作用的初步研究[D].复旦大学,2007.
[9] 刘小丽,朱琳瑜.中西医结合疗法治疗重型斑秃的疗效观察[J].保健医学研究与实践,2016,13(3):30-33.
[10]赵辨.中国临床皮肤病学[M].江苏科学技术出版社,2010.
[11]Perera E,Yip L,Sinclair R.Alopecia Areata[J].Curr Probl Dermatol,2015,47(5):238-241.
[12]Dainichi T,Kabashima K.Alopecia areata:What’s new in epidemiology,pathogenesis,diagnosis,and therapeutic options?[J].J of Der Science,2016,86(1):3-12.
[13]Pratt CH,King LE Jr.Messenger AG,et al.Alopecia areata[J].Nat Rev Primers,2017,3:17011.
[14]Sadeghi S,Sanati MH,Taghizadeh M,et al.Study of Th1/Th2 balance in peripheral blood mononuclear cells of patients with alopecia areata[J].Acta Microbiol Immunol Hung,2015,62(3):275-285.
[15]王博,杨淑霞.斑秃患者血清中部分细胞因子研究[J].临床皮肤科杂志,2011,40(6):332-334.
[16]Zhang X,Zhao Y,Ye Y,et al.Lesional infiltration of mast cells,Langerhans cells,T cells and local cytokine profiles in alopecia areata[J].Arch Dermatol Res,2015,307(4):319-331.
[17]蔡泽明,赵莹,张斌,等.早期斑秃皮损处炎症细胞因子及凋亡因子的异常表达[J].中华皮肤科杂志,2015,48(2):128-131.
[18]Colantonio L,Recalde H,Sinigaglia F,et al.Modulation of chemokine receptor expression and chemotactic responsiveness during differentiation of human naive T cells into Th1 or Th2 cells[J].Eur J Immunol,2002,32(5):1264-1273.
[19]蔡晓伟.Th1/Th2型细胞因子与斑秃关系的初步研究[D].重庆医科大学,2005.
[20]D′Ovidio R.Alopecia Areata:news on diagnosis,pathogenesis and treatment[J].G Ital Dermatol Venereol,2014,149(1):25-45.
[21]周静,丁杨峰,杨勤萍,等.T细胞因子在斑秃发病中的作用[J].中国皮肤性病学杂志,2010,24(1):23-26.
[22]Attia EA,Shennawy D,Sefin A.Serum Interleukin-4 and Total Immunoglobulin E in Nonatopic Alopecia Areata Patients and HLA-DRB1 Typing[J].Dermatol Res Pract,2010,2010:503-587.
