白花龙胆提取物对大鼠急性咽炎模型作用研究
2018-06-05邱建平曾明辉
刘 红,邱建平,何 琴,曾明辉
(四川省邛崃市医疗中心医院药学部,四川 成都 611530)
急性咽炎是咽部黏膜及黏膜下组织的急性炎症,多累及咽部淋巴组织,是耳鼻咽喉科常见病及多发病。急性咽炎的主要临床表现为咽部干燥、灼热、疼痛,严重者可出现发热、头痛、四肢酸痛等全身症状,治疗不得当甚至可引起鼻窦炎、中耳炎、支气管炎等其他急性炎症,严重影响人们的正常生活和工作[1]。白花龙胆为常用藏药药材,始载于8世纪中期的《月王药诊》[2],历部藏医学典籍及本草均有记载。不同的藏药专著对白花龙胆的来源存在不同认识[3~6]。经全国第四次中药资源普查对该品种进行的考证,确定其基原植物应为大花龙胆Gentiana szechenyii、岷县龙胆G.purdomii、高山龙胆G.algida,主流药材为大花龙胆Gentiana szechenyii[7]。该药是现行部颁标准藏药制剂三味龙胆花丸、十五味龙胆花丸等制剂的君药[8]。白花龙胆提取物性寒,味苦,寒。清肝胆,除湿热,健胃。用于流行性脑脊髓膜炎、目赤、咽喉痛、肺热咳嗽、胃脘痛胀、淋证、泻肝胆实火及清湿热等症[9]。之前有文献报道过用龙胆花治疗慢性咽炎效果良好,但没有对其机理深入研究。本实验参考相关文献建立实验方案[10~13],通过血液生化指标、组织病理检测等方法,进一步探讨研究其对急性咽喉炎的作用。
1 对象与方法
1.1实验动物健康SD大鼠,清洁级,雄性,体质量(180~220)g,共50只,由四川省医学科学院·四川省人民医院实验动物研究所提供,实验动物生产许可证号:SCXK(川)2013-015,生产合格证号:0006303。所有大鼠均正常饲养,自由饮水、进食,饲养温度24~26 ℃,相对湿度40%~60%。用随机数字表将SD大鼠分为空白组、模型组、阳性对照组、白花龙胆提取物高剂量组、白花龙胆提取物低剂量组各10只。
1.2仪器与试药半自动酶标仪ST-360(上海科华实验系统有限公司)、全自动血球分析仪BC-6800(迈瑞医疗国际有限公司)、切片机(徕卡-2015,德国);TSJ-Q型全自动封闭式组织脱水机、BMJ-Ⅲ型包埋机、PHY-Ⅲ型病理组织漂烘仪(均为常州市中威电子医疗仪器有限公司产品);Motic BA400病理摄像系统(麦克奥迪,德国)。白花龙胆提取物(相当于0.6 g/ml生药,批号:20151108,来源于四川省人民医院制剂室);阳性对照品:蒲地蓝消炎片(0.6 g/片,批号:20150306,广东心宝制药有限公司);阴性对照品:蒸馏水(自制);氨水(AR级,批号:YBZ01152010,成都市科龙化工试剂厂)。
1.3方法
1.3.1急性咽炎动物造模 将大鼠口腔扩开,除空白组喉头喷雾生理盐水外,其余各组用喉头喷雾器喷25%氨水,每天两次,每次3掀,共造模3天。操作中确保无液滴流入气管。
1.3.2给药方法 空白组与模型组给予蒸馏水,阳性对照组给予蒲地蓝消炎片0.75 g/(kg·d),白花龙胆提取物高剂量组给予白花龙胆提取物2 g/(kg·d),白花龙胆提取物低剂量组给予白花龙胆提取物1 g/(kg·d)。
1.4观察指标
1.4.1大鼠一般状态观察 观察记录大鼠造模3天和给药3天时大鼠的体重,并全程观察其饮食、活动等情况。
1.4.2大鼠血清制备及测定 各组大鼠于末次给药后24 h,取其腹主动脉血2 ml抗凝,用于白细胞计数,剩余血液于4 ℃、3000 r/min离心10 min后分离血清,至-70 ℃冰箱保存备用,采用酶联免疫吸附法(ELISA)测定血清中IL-1β、IL-6和TNF-α水平,操作依据试剂盒说明进行。
1.4.3大鼠咽部病理样本的制备与观察 各组大鼠于末次给药后24 h,取其腹主动脉血后处死。摘取咽部组织,在10%甲醛溶液中固定,次日将固定后的咽部组织进行常规脱水、石蜡包埋、切片、HE染色后在光学显微镜下观察咽部黏膜鳞状上皮、黏膜下结缔组织的增生情况和血管的充/出血情况及炎性细胞浸润情况。基本无增生标记为(-),稍有增生标记为(+),增生明显标记为(++);基本无充/出血标记为(-),有充/出血标记为(+);无炎性细胞浸润标记为(-),少量炎性细胞浸润标记为(+),明显炎性细胞浸润标记为(++),大量炎性细胞浸润标记为(+++)。
1.5统计学方法采用SPSS 18.0统计软件进行分析数据。计量资料以均数±标准差表示,符合正态性分布选择单因素方差分析,如不符合正态性分布则用非参数检验,P< 0.05为差异有统计学意义。
2 结果
2.1大鼠一般状态观察各组造模中,大部分大鼠逐渐出现饮食减少、饮水频繁及搔抓口部的现象,并在造模的最后一天表现最为明显。造模第3天末及给药第3天末各组大鼠体重变化情况见表1。造模第3天末,与空白对照组相比,氨水造模各组大鼠体重明显降低。给药第3天末,各组大鼠体重均有增加,但是增加幅度组间无明显差异。由于实验操作原因,造模期间氨水造模各组均有1只大鼠死亡,给药期间白花龙胆提取物低剂量组有1只大鼠死亡。
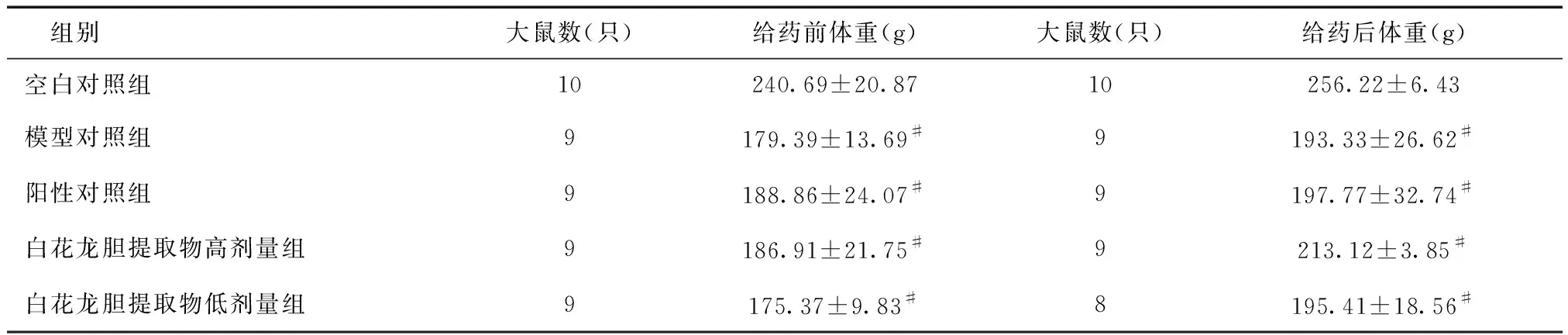
表1 各组大鼠造模后和给药后体重变化情况
#与空白对照组比较,P< 0.01
2.2各组白细胞分类与计数比较给药3天后各组大鼠的白细胞分类与计数见表2。与空白对照组相比,各组中性粒细胞数差异均有统计学意义(P<0.05);与模型对照组相比,阳性对照组、白花龙胆提取物高剂量组和低剂量组淋巴细胞数、单核细胞数差异均无统计学意义(P>0.05)。

表2 各组大鼠白细胞分类与计数情况 (109/L)
与空白对照组比较,#P< 0.05,##P< 0.01
2.3大鼠血清中IL-1β、IL-6和TNF-α含量比较
给药后,各组大鼠血清中IL-1β、IL-6和TNF-α含量见表3。与模型组相比,白花龙胆提取物高剂量组TNF-α、IL-1β、IL-6水平差异有统计学意义(P<0.05),白花龙胆提取物低剂量组差异无统计学意义(P>0.05)。

表3 各组大鼠血清中IL-1β、IL-6和TNF-α情况 (pg/ml)
*与模型对照组比较,P<0.05
2.4大鼠咽部组织病理检测情况给药后,各组大鼠咽部组织病理切片情况如图1所示,显微检测情况见表4。空白组大鼠咽部黏膜鳞状上皮、黏膜下结缔组织和血管及黏膜下腺均正常,未见炎性细胞浸润;模型组大鼠咽部黏膜鳞状上皮、黏膜下结缔组织见明显增生和充血现象,并伴有大量炎性细胞浸润;阳性对照组和白花龙胆提取物高剂量组大鼠咽部黏膜鳞状上皮、黏膜下结缔组织稍有增生,无明显充血,炎性细胞浸润明显减少;白花龙胆提取物低剂量组大鼠咽部黏膜鳞状上皮、黏膜结缔组织增生明显减轻,无明显充血,炎性细胞浸润有所减少。
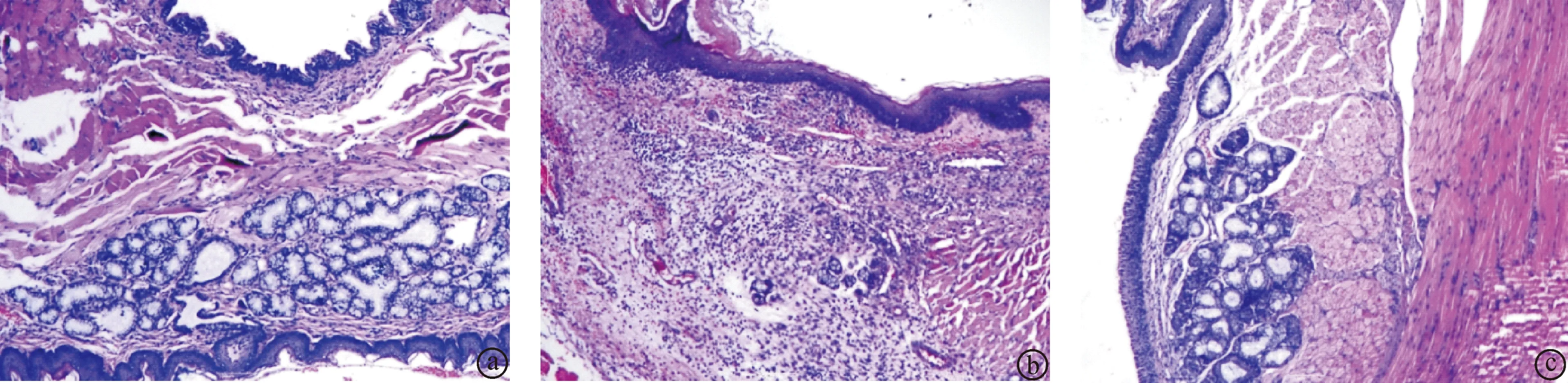
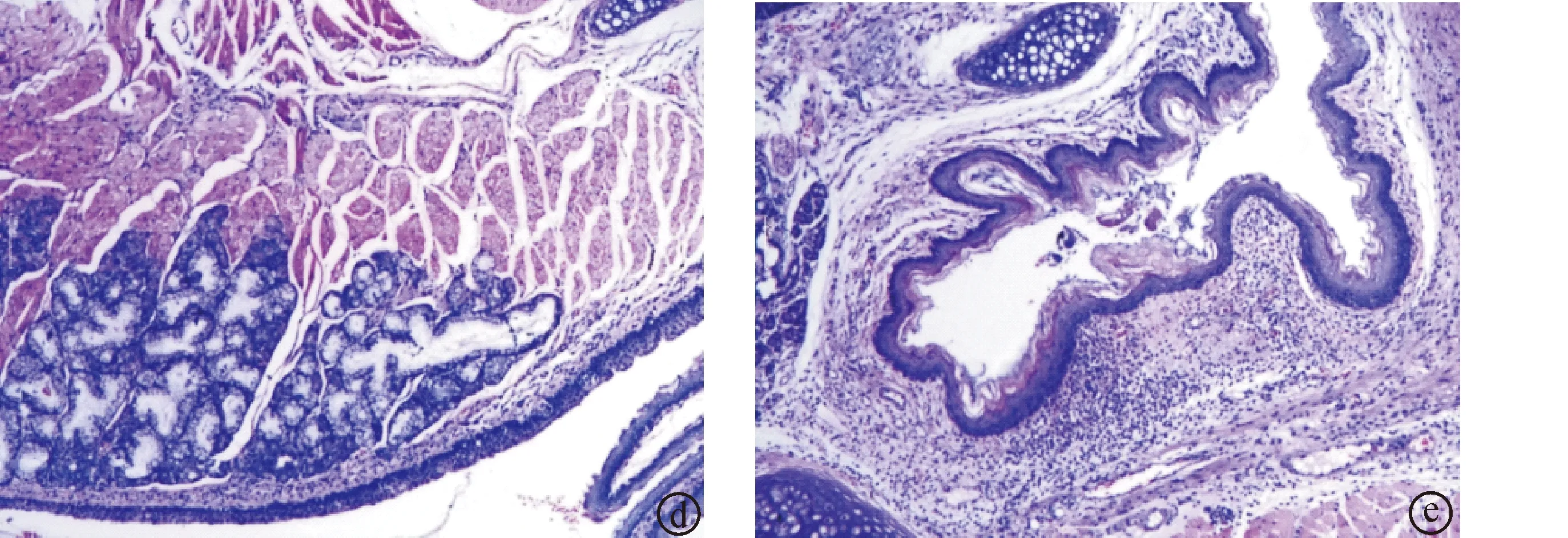
图1大鼠咽部组织病理切片(HE染色,放大100倍数) a.空白对照组,b.模型对照组,c.阳性对照组,d.白花龙胆提取物高剂量组,e.白花龙胆提取物低剂量组
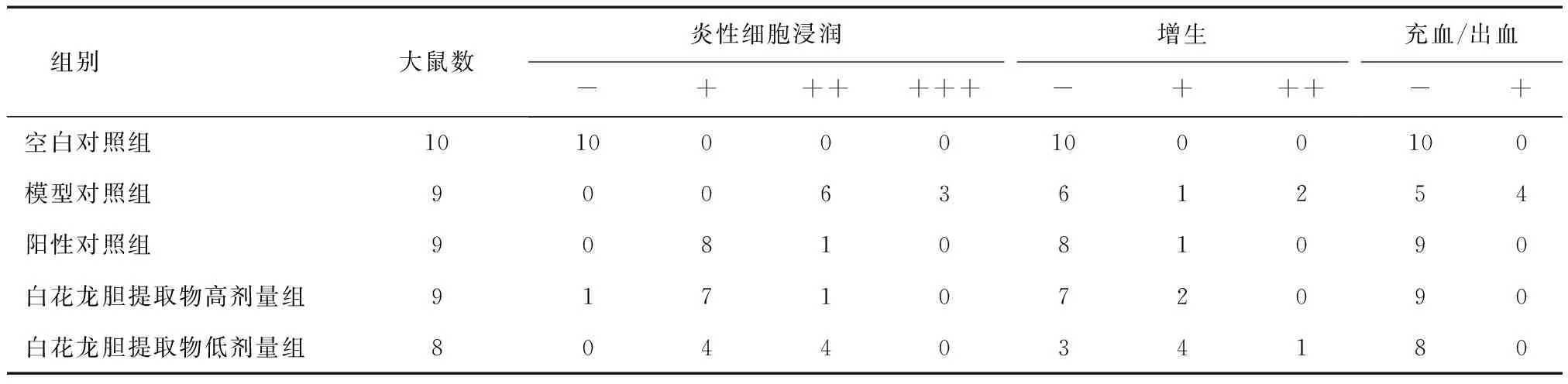
表4 各组大鼠咽部组织病理显微检测情况 (n)
3 讨论
本研究采用大鼠急性咽炎动物模型,初步揭示了白花龙胆治疗急性咽炎的作用机理。体重变化研究中,各组大鼠在给药后体重有所增加,可能与缓解了大鼠的炎性症状,使其饮食得以恢复有关。虽与模型组比较,白花龙胆提取物高剂量组和低剂量组统计结果无明显差异,但从体重增加的直观结果来看,白花龙胆提取物对急性咽炎还是有效的。
白细胞分类与计数分析中,与模型对照组相比,白花龙胆提取物高剂量组和低剂量组虽然在白细胞总数上无明显差异,但在改变中性粒细胞、淋巴细胞和单核细胞的比例分配上是有区别的,从另一个角度解释了白花龙胆提取物治疗急性咽炎的作用机制。
TNF-α作为活化单核-巨噬细胞产生的一种重要细胞因子,在感染性疾病和炎症方面,能刺激血管内皮细胞分泌黏附分子,刺激单核-巨噬细胞和其他细胞分泌趋化性细胞因子,引起白细胞在炎症部位聚集,促进炎症反应。正常水平的TNF-α可抑制病毒复制,保护机体细胞,但当机体发生炎症反应后,TNF-α水平显著升高[14]。IL-1β被称为“前炎性因子”,作为上游炎性因子能介导多种炎性因子表达上调,从而影响炎症反应[15]。在大鼠血清中IL-1β、IL-6和TNF-α变化研究中,造模后的模型对照组都处于异常增高水平,可能反映了局部过度炎症反应。与模型对照组比较,白花龙胆提取物高剂量组的血清TNF-α、IL-1β、IL-6水平均有显著差异,其中,血清TNF-α的降低幅度最大,接近于空白对照组的指标。该结果在一定程度上揭示了白花龙胆提取物治疗急性咽炎可能的主要作用机制。
大鼠咽部组织病理检测观察中,与空白对照组相比,模型对照组咽部黏膜鳞状上皮、黏膜下结缔组织见明显增生和充血现象,并伴有大量炎性细胞浸润,说明氨水造模引起的大鼠咽部组织病理改变是很明显的,有效模拟了急性咽炎的组织病理改变情况。与模型对照组比较,白花龙胆提取物高剂量组和低剂量组中黏膜鳞状上皮、黏膜下结缔组织增生和充血明显改善,炎性细胞浸润也得到抑制,且高剂量组效果略优于低剂量组,说明白花龙胆提取物对急性咽炎的治疗是有效的,且与给药剂量有一定相关性。
从整个研究结果来看,白花龙胆提取物对急性咽喉炎具有一定治疗效果,其主要作用机理与下调前炎症细胞因子,减轻和消除炎症损伤,抑制炎症发展有关。部分实验结果不够理性可能与药材品质欠佳及白花龙胆提取物抗炎有效成分富集不足有一定关系,需要后期进一步研究确认白花龙胆抗炎的有效成分,并建立合理有效白花龙胆药材质量标准。
[1] 胡蓉,王丽华,张珺珺,等.疏风解毒胶囊治疗急性咽炎风热证的临床观察[J].药物评价研究,2014,37(5):460-462.
[2] 毛继祖,马世林.月王药诊[M].上海:上海科学技术出版社,2012:67.
[3] 国家中医药管理局中华本草编委会.中华本草·藏药卷[M].上海:上海科学技术出版社,2002:283.
[4] 中国科学院中国植物志编辑委员会.中国植物志(第62卷)[M].北京:科学出版社,1988:109.
[5] 西藏自治区革命委员会卫生局,西藏军区后勤部卫生局.西藏常用中草药[M].拉萨:西藏人民出版社,1973:153.
[6] 中国科学院西北高原生物研究所.藏药志[M].西宁:青海人民出版社,1991:186.
[7] 钟世红,古锐,马羚,等.藏药白花龙胆品种考证与使用现状调查[J].中国中药杂志,2014,39(13):2450-2455.
[8] 中华人民共和国卫生部药典委员会.中华人民共和国卫生部药品标准·藏药(第一册)[M].北京:人民卫生出版社,1995:198.
[9] 杨书彬,王承.龙胆化学成分和药理作用研究进展[J].中医药学报,2005,33(6):54-56.
[10]杨晶凡,吴明侠,张贵君.金莲花及其药效组分对实验性急性咽炎药效作用研究[C].长沙:第三届中国中药商品学术年会暨首届中药葛根国际产业发展研讨会论文集,2012:167-171.
[11]章晨峰,曹亮,衡晴晴,等.胆木叶片抗大鼠急性咽炎作用研究[J].中国实验方剂学杂志,2015,21(23):97-100.
[12]刘岩,刘志洋.罗汉果水提液对于急性咽炎模型大鼠的治疗作用[J].中国实验方剂学杂志,2014,20(19):159-162.
[13]黎同明,邓敏贞.麻杏甘石汤对急性咽炎大鼠的镇咳、抗炎镇痛作用[J].山西中医学院学报,2012,13(3):33-34.
[14]谭红梅,谭春梅,冯晓丽,等.血必净联合局部微波治疗对肺炎血清中白介素-6及肿瘤坏死因子-α表达水平的影响[J].实用医院临床杂志,2017,14(6):148-150.
[15]张海清,孔庆霞.白介素1β单克隆抗体对癫痫致大鼠海马组织炎症反应的影响[J].中风与神经疾病杂志,2015,32(2):126-129.
