叉头框蛋白E1对肝癌细胞侵袭及迁移能力的影响
2018-06-05姚豫桐
张 雯 姚豫桐
(四川省医学科学院 四川省人民医院肝胆胰脾&细胞移植中心,四川 成都 610072)
超过80%的肝癌患者在确诊时已经处于癌症晚期,治疗后5年内生存率低于3%〔1,2〕。肝癌易转移、易复发是肝癌致死的重要原因,探究肝癌的发病机制,寻找有效方法提高肝癌患者的生存期是重中之重〔3〕。叉头框蛋白(FOX)E1属于FOX家族的成员,在胚胎发育、分化等过程中发挥关键作用,研究报道,FOXE1在基底细胞癌、甲状腺癌、皮肤鳞癌等中异常表达,并且在癌细胞的发展和转移中发挥决定性作用〔4~6〕。FOXE1在肝癌中表达异常下调,而对于其在肝癌细胞侵袭和迁移中的作用尚不清楚〔7〕。本实验对FOXE1在体外肝癌细胞侵袭和迁移中的作用进行初步探讨。
1 材料与方法
1.1材料 肝癌细胞SMCC7721、HepG2、HCCLM3和正常肝细胞HL7702购自中科院细胞库;FOXE1 pcDNA3.1购自美国OriGene;FOXE1、β-actin引物均由上海生工合成;二喹啉甲酸(BCA)蛋白定量试剂盒购自美国Pierce;电化学发光(ECL)试剂盒购自美国Amersham Biosceiences;胎牛血清购自美国Biochrom;DMEM购自美国Sigma;FOXE1抗体购自美国Bioworld;反转录试剂盒购自大连TaKaRa;qRT-PCR试剂盒购自南京Vazyme;Lipofectamine2000购自美国 invitrogen;基质金属蛋白酶(MMP)-2抗体、神经钙黏素(N-cadherin)抗体、波形蛋白(Vimentin)抗体、上皮钙黏附素(E-cadherin)抗体购自美国CTS。
1.2qRT-PCR测定FOXE1在肝癌细胞和正常肝细胞中的表达 取人肝癌细胞SMCC7721、HepG2、HCCLM3和人正常肝细胞HL7702,提取细胞中的RNA,用核酸蛋白仪分析A260/A280的比值1.8~2.0。逆转录合成cDNA,合成产物保存在-20℃。qRT-PCR测定FOXE1水平。引物:FOXE1-正义链:5′-GACCACGGTGGACTTCTAGCG-3′,FOXE1-反义链:5′-CCCTAC-GCTGGCTCACAT-3′。β-actin-正义链:5′-TTGTTACAGGAAGTCCCTTGCC-3′,β-actin-反义链:5′-ATGCTATCACCTCCCCTGTGTG-3′。以β-actin为内参,根据PCR反应曲线得出阈值循环数,分析Ct值,用2-△△Ct法计算目的基因的相对表达水平。
1.3Western印迹测定FOXE1在肝癌细胞和正常肝细胞中的表达 取人肝癌细胞SMCC7721、HepG2、HCCLM3和人正常肝细胞HL7702,在冰上提取细胞蛋白,步骤参照细胞蛋白提取试剂盒。用BCA法对蛋白定量。按照每组40 μg蛋白样品进行蛋白电泳。在上样前,将蛋白样品与上样缓冲液混合煮沸5 min后,放在冰上备用。30 mA电流电泳,观察染料进入到分离胶和浓缩胶的交界处以后,把电流调整到20 mA,直到染料进入到分离胶的底部以后,将凝胶取出,进行转膜(转膜电泳用250 mA,转膜时间为2 h)、封闭(5%脱脂奶粉,室温,封闭1 h)。取出膜,与按照1∶800稀释的FOXE1一抗在4℃过夜以后,再与1∶2 000稀释的二抗在室温反应2 h。用ECL显色,曝光后,用Image J分析条带的灰度值。FOXE1蛋白水平=FOXE1灰度值/β-actin灰度值。
1.4细胞转染和分组 用Lipofectamine2000将FOXE1 pcDNA3.1和空载体pcDNA3.1转染到HCCLM3细胞中,步骤参照Lipofectamine2000转染试剂说明书,将转染后的细胞依次命名为FOXE1组和Vector组,并且以不做转染的细胞命名为WT组,在转染后的24 h,分别用qRT-PCR和Western印迹测定各组细胞中的FOXE1转录和表达水平,步骤同上。
1.5细胞划痕实验测定细胞迁移 WT、FOXE1、Vector组细胞在转染后,用细胞培养液把细胞浓度调整为每毫升含有1×106个细胞,接种到6孔板中,每孔中添加1 ml的细胞悬液,培养过夜以后,观察细胞长满底部以后,用无菌的移液枪枪头在底部划出一条细痕,用PBS把划下的细胞去除以后,每孔添加2 ml的细胞悬浮液,继续培养24 h。测量0 h和24 h细胞划痕的宽度,计算细胞迁移率。迁移率=100%×(0 h细胞划痕的宽度-24 h细胞划痕的宽度)/0 h细胞划痕的宽度。
1.6Transwell小室测定细胞侵袭 WT、FOXE1、Vector细胞在转染后用Transwell小室测定细胞侵袭能力。用不含血清的培养液把各组细胞制成单细胞悬浮液,密度为1×106个/ml。在侵袭实验前30 min,用基质胶湿化Transwell小室。把上述100 μl细胞悬浮液加入到Transwell小室的上室,在下室中添加600 μl的含10%胎牛血清的细胞培养液。孵育24 h以后,用甲醇固定10 min,结晶紫染色20 min,在显微镜下观察细胞侵袭个数。
1.7Western印迹测定MMP-2、N-cadherin、Vimentin、E-cadherin蛋白水平 WT、FOXE1、Vector细胞在转染后继续培养24 h,Western印迹方法测定细胞中MMP-2、N-cadherin、Vimentin、E-cadherin蛋白水平,步骤同上。
1.8统计学分析 采用SPSS21.0软件进行单因素方差分析、SNK-q检验。
2 结 果
2.1FOXE1在肝癌细胞和正常肝细胞中的表达 肝癌细胞SMCC7721、HepG2、HCCLM3中FOXE1 mRNA和蛋白水平均明显低于正常肝细胞HL7702,差异具有统计学意义(P<0.05)。HCCLM3细胞中的FOXE1 mRNA和蛋白水平明显低于HepG2细胞和SMCC7721细胞,差异具有统计学意义(P<0.05)。FOXE1在肝癌细胞中低表达,且在HCCLM3细胞中的表达水平最低,选用HCCLM3细胞做后续实验。见图1和表1。

图1 Western印迹测定肝癌细胞SMCC7721、HepG2、HCCLM3和正常肝细胞HL7702中FOXE1蛋白水平
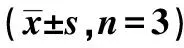
表1 肝癌细胞SMCC7721、HepG2、HCCLM3和正常肝细胞HL7702中FOXE1 mRNA和蛋白表达水平比较
与HL7702相比:1)P<0.05;与HCCLM3相比:2)P<0.05
2.2FOXE1在转染后细胞中的表达 FOXE1组FOXE1 mRNA和蛋白水平均明显高于WT组,差异具有统计学意义(P<0.05)。Vector组FOXE1 mRNA和蛋白水平与WT相比差异无统计学意义(P>0.05)。FOXE1过表达载体可以促进肝癌细胞中的FOXE1的转录和表达。见图2和表2。

图2 Western印迹测定转染后的HCCLM3细胞中FOXE1蛋白水平
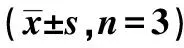
表2 各组细胞中FOXE1 mRNA和蛋白表达水平比较
与WT相比:1)P<0.05,下表同
2.3FOXE1对肝癌细胞侵袭及迁移影响 FOXE1组细胞迁移率和侵袭细胞数目均明显低于WT组,差异具有统计学意义(P<0.05)。Vector组细胞迁移率和侵袭细胞数目与WT组相比差异无统计学意义(P>0.05)。FOXE1过表达载体可以降低肝癌细胞的侵袭和迁移能力。见表3。
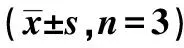
表3 各组细胞迁移率和侵袭细胞数目比较
2.4FOXE1对肝癌细胞中MMP-2、N-cadherin、Vimentin、E-cadherin蛋白表达影响 FOXE1组MMP-2、N-cadherin、Vimentin蛋白水平均明显低于WT组,而E-cadherin水平明显高于WT组,差异具有统计学意义(P<0.05)。Vector组MMP-2、N-cadherin、Vimentin、E-cadherin蛋白水平与WT组相比差异无统计学意义(P>0.05)。FOXE1过表达载体可以促进肝癌细胞中E-cadherin表达,抑制细胞中MMP-2、N-cadherin、Vimentin蛋白表达。见图3和表4。

图3 Western印迹测定MMP-2、N-cadherin、Vimentin、E-cadherin蛋白表达
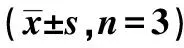
表4 各组细胞中MMP-2、N-cadherin、Vimentin、E-cadherin蛋白水平比较
3 讨 论
叉头框家族是一个十分庞大的转录因子家族,其成员都含有一个典型的叉头区域,该蛋白家族能够影响细胞的生长、分化等多种生物学功能,与肿瘤的转移有关〔8〕。FOXE1是叉头框家族成员之一,最初发现其可以调控甲状腺的生长,是一种重要的甲状腺转录因子,能够影响甲状腺滤泡细胞的生长〔9〕。研究表明,FOXE1在肿瘤中表达异常,并且与肿瘤的恶性程度有关,目前发现的与FOXE1有关的恶性肿瘤主要有结直肠癌、胰腺癌、白血病、大肠癌等〔10~13〕。在大肠癌中提高FOXE1的表达后,大肠癌细胞的恶性程度降低,细胞侵袭能力下降〔13〕。周宇帆〔7〕检测了肝癌细胞中FOXE1 mRNA水平发现,FOXE1 mRNA在肝癌中低表达,并且其表达水平的高低与肝癌血管侵犯、包膜侵犯等有关。
肿瘤转移大致分为4步:首先肿瘤从原发部位脱落以后穿过基底膜进入到间质中;其次,肿瘤细胞通过在间质中的移行到达脉管周围;第三,肿瘤穿过血管内皮组织进入到血液中;第四,肿瘤细胞穿过血管,进入到新的组织中,增殖形成新的病灶〔14~16〕。在肿瘤转移过程中,肿瘤细胞降解细胞外基质是关键步骤,细胞外基质的主要成分为Ⅳ型胶原酶,因此,Ⅳ型胶原酶也是阻碍肿瘤细胞转移的重要屏障。MMPs是细胞外基质降解的主要蛋白酶,其中MMP-2是目前发现的降解Ⅳ型胶原酶的主要蛋白酶,其可以打破外基质的降解平衡,诱导肿瘤细胞穿过组织屏障向邻近组织转移〔17,18〕。肿瘤细胞转移过程中其上皮细胞特征逐渐减弱,间质细胞特征逐渐明显,这被称之为上皮间质转化(EMT),E-cadherin是上皮细胞的标志物,而N-cadherin、Vimentin是间质细胞的标志物,其在肝癌中异常表达〔19,20〕。
本实验说明FOXE1在肝癌细胞中表达降低,FOXE1可以降低肝癌细胞降解细胞外基质的能力,降低肝癌细胞的侵袭和迁移能力,抑制肝癌细胞EMT,FOXE1可能在肝癌中发挥抑癌基因的作用。
FOXE1在多种肿瘤中异常表达,并且可以影响肿瘤细胞的多种生物学特性,而本实验证明,FOXE1可能作为一种抑癌基因参与肝癌转移,FOXE1可以降低肝癌细胞的侵袭和迁移能力,抑制肝癌细胞EMT,其具体的作用机制需要在以后的实验中进行探讨,这对于今后研究肝癌的发病机制具有重要意义。
4 参考文献
1Kudo M,Matsui O,Izumi N,etal.JSH consensus-based clinical practice guidelines for the management of hepatocellular carcinoma:2014 update by the liver cancer study group of Japan〔J〕.Liver Cancer,2014;3(3-4):458-68.
2Yoshimoto S,Loo TM,Atarashi K,etal.Obesity-induced gut microbial metabolite promotes liver cancer through senescence secretome〔J〕.Nature,2013;499(7456):97-101.
3Pediconi N,Lupacchini L,Salerno D,etal.SAT-424-EZH2 methyltransferase and JMJD3/UTX demethylases are involved in hepatocytic differentiation and liver cancer cells plasticity〔J〕.J Hepatol,2017;66(1):S644-5.
4Tomaz RA,Sousa I,Silva JG,etal.FOXE1 polymorphisms are associated with familial and sporadic nonmedullary thyroid cancer susceptibility〔J〕.Clin Endocrinol,2012;77(6):926-33.
5Eichberger T,Regl G,Ikram MS,etal.FOXE1,a new transcriptional target of GLI2 is expressed in human epidermis and basal cell carcinoma〔J〕.J Invest Dermatol,2004;122(5):1180-7.
6Venza I,Visalli M,Tripodo B,etal.FOXE1 is a target for aberrant methylation in cutaneous squamous cell carcinoma〔J〕.Br J Dermatol,2010;162(5):1093-7.
7周宇帆.FOXC2 和 FOXEl 在原发性肝细胞癌中的表达及临床意义〔D〕.长沙:中南大学,2013.
8张锦锦,唐 慧.叉头框 Q1 基因调控肿瘤发生和发展的研究进展〔J〕.肿瘤,2017;37(2):177-83.
9Jiang W,Zheng L,Xu L,etal.Association between FOXP3,FOXE1 gene polymorphisms and risk of differentiated thyroid cancer in Chinese Han population〔J〕.Mol Biol,2015;4(3):1-5.
10龙亚东.FOXE-1 甲基化与表达的关联分析及其与结直肠癌的相关性研究〔D〕.上海:复旦大学,2013.
11Sato N,Fukushima N,Maitra A,etal.Discovery of novel targets for aberrant methylation in pancreatic carcinoma using high-throughput microarrays〔J〕.Cancer Res,2003;63(13):3735-42.
12Rush LJ,Raval A,Funchain P,etal.Epigenetic profiling in chronic lymphocytic leukemia reveals novel methylation targets〔J〕.Cancer Res,2004;64(7):2424-33.
13黄钟庭.FOXE1在大肠癌中的表达及其功能研究〔D〕.杭州:浙江大学,2014.
14胡伟国,林金叶,宋启斌.炎症小体与肿瘤转移关系的研究进展〔J〕.肿瘤学杂志,2016;22(2):99-105.
15刘 华,杨贵义,钦传辉.槐耳清膏对手术切除结肠癌后肿瘤复发及转移的影响及其机制研究〔J〕.现代中西医结合杂志,2016;25(9):968-70.
16Zhuang HH,Xue W,Ping W.Transcription factor cAMP response element binding protein mediates tumor metastasis and the related molecular mechanism〔J〕.Acta Anat Sin,2015;46(1):138-44.
17Shi F,Xiao F,Ding P,etal.Long noncoding RNA highly up-regulated in liver cancer predicts unfavorable outcome and regulates metastasis by MMPs in triple-negative breast cancer〔J〕.Arch Med Res,2016;47(6):446-53.
18Li X,Wu JF.Recent developments in patent anti-cancer agents targeting the matrix metalloproteinases (MMPs)〔J〕.Recent Pat Anticancer Drug Discov,2010;5(2):109-41.
19Zhang J,Guo Y.The expression of N-cadherin and vimentin in rectum adenocarcinoma and their clinical value〔J〕.Chongqing Med,2014;43(8):935-4.
20Bhat FA,Sharmila G,Balakrishnan S,etal.Quercetin reverses EGF-induced epithelial to mesenchymal transition and invasiveness in prostate cancer (PC-3) cell line via EGFR/PI3K/Akt pathway〔J〕.J Nutr Biochem,2014;25(11):1132-9.
