整合素连接激酶在大鼠烧伤创面中的表达及对创面愈合的影响
2018-06-05姜海刘宇徐刚
姜 海 刘 宇 徐 刚
(唐山市工人医院烧伤整形二科,河北 唐山 063000)
创面是指在热力、外力、低温、电流、化学物质、手术等外界致伤因子以及局部血液供应障碍等机体内在因素的作用下引起正常皮肤组织的丢失或出现皮肤完整性的中断,并伴有皮肤功能损伤。皮肤受伤后发生一系列炎症反应,真皮组织细胞分泌纤维连接蛋白和胶原等进行真皮组织重建和上皮组织再生〔1〕。整合素连接激酶(ILK)是丝氨酸-苏氨酸蛋白激酶的一种,激活的ILK参与生长因子和整合素信号通路,对细胞凋亡、细胞迁移、细胞增生等多种细胞功能有调节作用,可以介导细胞外基质和细胞的相互作用〔2,3〕。研究发现ILK在心肌、肝脏、皮肤、神经纤维等组织器官损伤后的修复过程中发挥重要作用〔4,5〕。本文通过分析烧伤大鼠创面中ILK的表达水平及大鼠烧伤创面转染ILK过表达慢病毒后对创伤愈合的影响,探讨ILK在烧伤创面愈合中的作用。
1 材料与方法
1.1材料 Wistar大鼠购自首都医科大学实验动物部,二氨基联苯胺(DAB)显色试剂盒、SP试剂盒、兔抗鼠ILK单克隆抗体(美国Sigma公司),重组慢病毒载体(包含重组绿色荧光蛋白编码基因和大鼠型ILK的cDNA片段)和不含ILK基因片段的空载慢病毒(上海吉凯基因公司构建)等。
1.2实验方法
1.2.1大鼠皮肤烧伤模型建立 将Wistar大鼠经戊巴比妥钠腹腔麻醉成功后固定在烫伤仪上,将背部皮毛剔除,消毒背部皮肤,将80℃圆柱形烫头垂直接触Wistar大鼠背部两侧对称皮肤致伤8 s建立大鼠烧伤模型;对照组大鼠不做任何处理。术后观察创面的愈合情况。
1.2.2大鼠烧伤创面愈合过程中ILK表达测定 分别在烧伤后1、2、3 w随机取7只烧伤模型大鼠,切取背部全层创面皮肤,对照组切取背部正常皮肤,用甲醛固定,石蜡包埋,切厚5 μm的切片,进行SP法免疫组化染色,以兔抗鼠ILK单克隆抗体为一抗,阴性对照以磷酸盐缓冲液(PBS)代替一抗,具体步骤按照试剂盒说明书进行。结果分析,每个标本取7张切片,每张切片取7个高倍视野,采用Axio Vision显微图像采集系统拍摄图片,采用Image-Proplus图像分析软件计算每个视野阳性表达的光密度值(平均光密度值=视野阳性表达积分光密度值/视野总面积),蛋白表达强度和平均光密度值呈正比,平均光密度值越高蛋白水平越高。
1.2.3ILK质粒转染293T细胞 取生长良好的293T细胞用胰蛋白酶进行消化,制成细胞悬液接种到24孔板上放回培养箱中培养,培养至细胞达85%融合时进行质粒转染,具体转染步骤按照转染试剂说明书操作,并检测质粒转染率。
1.2.4大鼠的分组和处理 取烧伤大鼠随机分为ILK转染组、阴性对照组和空白对照组,ILK转染组大鼠在烧伤后第2天于创面周围及基底注射ILK过表达慢病毒液100 μl;阴性对照组大鼠在烧伤后第2天于创面周围及基底注射空质粒慢病毒液100 μl;空白对照组大鼠于烧伤后第2天于创面周围及基底注射等量生理盐水。
1.2.5慢病毒转染大鼠后组织绿色荧光检测 烧伤后2 w,分别取ILK转染组、阴性对照组大鼠各7只,处死后取相同部位背部创面皮肤,苦味酸标记处将创面组织切为厚10 μmol/L的切片,470 nm绿色激光下对创面组织的绿色荧光进行检测。
1.2.6慢病毒转染大鼠后ILK表达的检测 分别取ILK转染组、阴性对照组和空白对照组大鼠各21只,分别于烧伤后1、2、3 w每组各处死7只大鼠,取背部创面组织,采用免疫组化法测定组织ILK蛋白的平均光密度值,方法同上。
1.2.7ILK对大鼠烧伤创面愈合时间和愈合率的影响 分别取ILK转染组、阴性对照组和空白对照组大鼠各7只观察大鼠烧伤创面愈合时间和愈合率的影响,在烧伤后第1、2、3周对创面进行拍照,记录创面愈合时间,采用Image J软件分析各组大鼠创面面积,计算各组大鼠的创面愈合率,创面愈合率=(1-残余创面面积)/原始创面面积×100。
1.3统计学方法 采用SPSS20.0软件,多组均数比较采用方差分析,组内两两比较采用LSD检验。
2 结 果
2.1烧伤创面愈合情况 烧伤后第3天创面开始收缩,1 w时坏死组织脱离,2 w时形成大量皮岛,3 w时创面基本痊愈,所有大鼠创面愈合过程平稳,未见感染征象。
2.2大鼠烧伤创面愈合过程中ILK的表达情况 烧伤组烧伤后1 w(0.046±0.014)和2 w(0.057±0.020)烧伤创面ILK的光密度值高于对照组(0.012±0.003)(P<0.05),烧伤后3 w(0.014±0.007)烧伤创面ILK光密度值和对照组比较差异无统计学意义(P>0.05)。
2.3ILK质粒转染293T细胞结果鉴定 目的基因质粒转染293T细胞后24 h可以观察到绿色荧光蛋白表达,转染率为86.6%,表明ILK基因质粒转染成功。见图1。
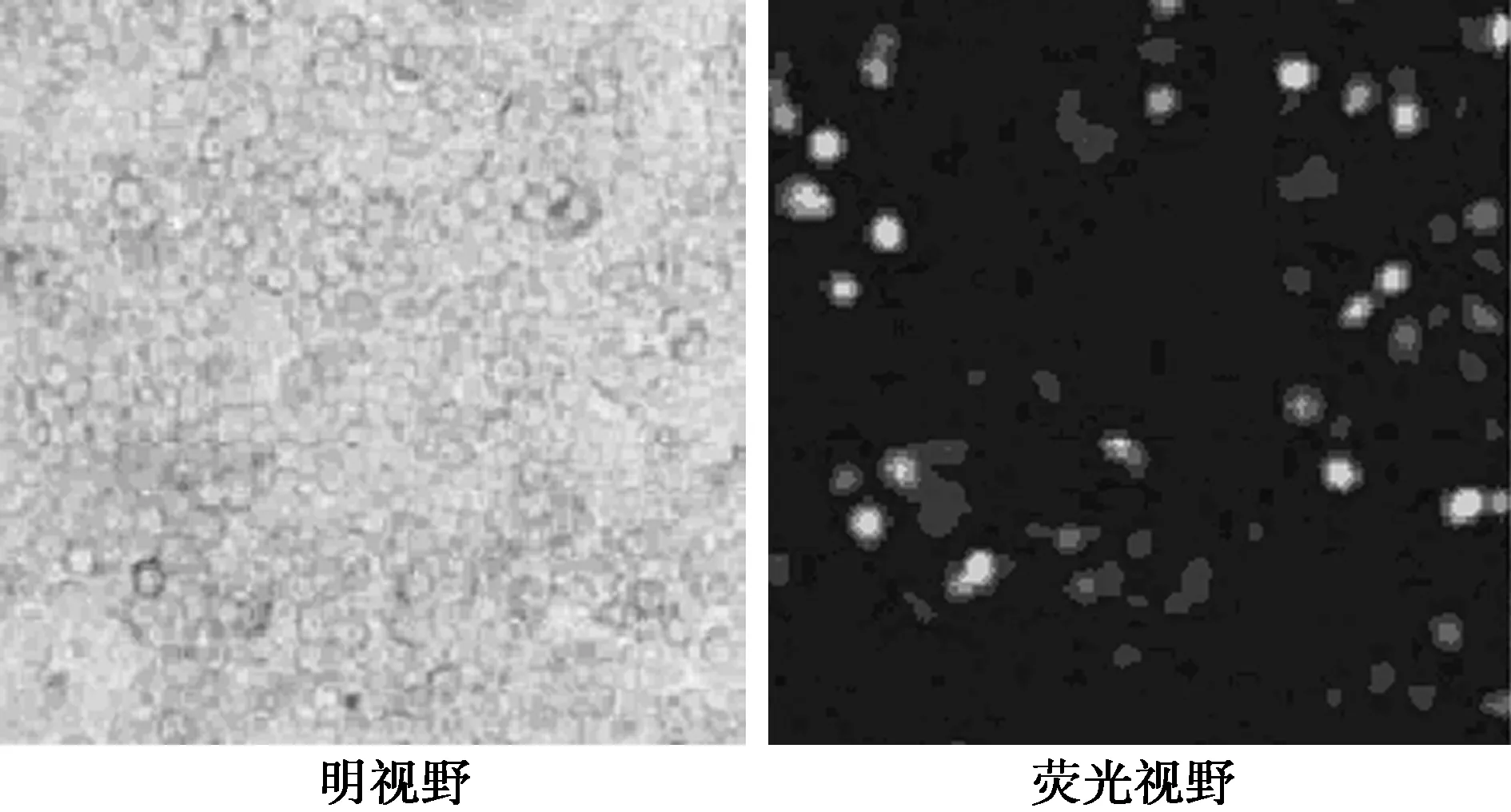
图1 ILK基因质粒转染293T细胞(×100)
2.4慢病毒活体转染后的表达情况 荧光显微镜下见创面冰冻切片中有绿色荧光蛋白表达,绿色荧光蛋白主要在皮肤基底层表达,部分毛囊中也可见绿色荧光蛋白表达。见图2。

图2 慢病毒转染后创面荧光情况(×10)
2.5慢病毒转染后各组大鼠创面组织ILK光密度值比较 烧伤后1、2 w,ILK转染组创面组织ILK光密度值高于空白对照组和阴性对照组(P<0.05);烧伤后3 w,三组创面组织ILK光密度值比较差异无统计学意义(P>0.05)。见表1。
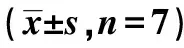
表1 慢病毒转染后各组大鼠创面组织ILK光密度值比较
与ILK转染组比较:1)P<0.05
2.6ILK转染后各组大鼠创面愈合率和愈合时间比较 烧伤后1、2 w,ILK转染组创面愈合率高于空白对照组和阴性对照组(P<0.05);烧伤后3 w,三组创面愈合率比较差异无统计学意义(P>0.05)。ILK转染组创面愈合时间〔(14.54±0.34)d〕短于空白对照组〔(17.98±0.46)d〕和阴性对照组〔(18.24±0.51)d〕(F=223.454,P<0.05)。见表2。
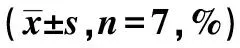
表2 ILK转染后各组大鼠创面愈合率比较
与ILK转染组比较:1)P<0.05
3 讨 论
创面的愈合实质为受损组织完整性的重建,创面愈合包括炎性反应期、肉芽组织增殖期和细胞外基质重塑期,炎性反应期主要表现为炎症介质的释放和血管收缩;肉芽组织增殖期主要为血管生成、表皮细胞再生、纤维组织增生、纤维蛋白凝固;细胞外基质重塑期主要为皮肤组织弹性和抗拉强度的再形成和恢复〔6,7〕。整合素在创面愈合过程中发挥重要作用,其介导的信号通路对细胞周期、细胞增殖、细胞分化、细胞死亡等具有调控作用〔8〕;ILK在整合素介导的信号通路中发挥关键性的作用,在生长因子信号通路中,ILK也发挥重要作用,整合素和生长因子受体胞内信号通路胞内结构可以激活ILK,ILK被激活后通过多种途径发挥激酶活性,参与细胞的调控〔9,10〕。ILK在肿瘤的发生和转移、组织纤维化、组织损伤后修复等过程中发挥重要作用〔11,12〕。
ILK对细胞凋亡有抑制作用,其对细胞凋亡的抑制作用在肿瘤的发生发展中具有重要作用〔13〕,创面的愈合需要细胞的大量增殖,促进细胞增殖可以促进创面的愈合。本文结果发现,ILK在烧伤创面的愈合中发挥一定作用,ILK水平升高有利于促进烧伤创面的愈合。创面的修复包括真皮重构和表皮再生,真皮重构需要纤维细胞大量增生,纤维细胞分泌胶原等细胞外基质,从而完成真皮的重建;表皮再生过程中,汗腺、毛囊、基底层等处表皮干细胞首先出现增生,然后分化为表皮细胞,从而完成表皮的再生过程。ILK可能通过整合素信号通路调节烧伤创面细胞的增生,并在细胞外基质和细胞的相互作用中发挥作用,ILK表达水平升高促进细胞增殖、生长和分化,促进血管新生,从而促进创面的愈合〔14,15〕。
4 参考文献
1Maquart FX,Monboisse JC.Extracellular matrix and wound healing〔J〕.Pathol Biol(Paris),2014;62(2):91-5.
2Zheng G,Zhang J,Zhao H,etal.α3 Integrin of cell-cell contact mediates kidney fibrosis by integrin-linked kinase in proximal tubular E-Cadherin deficient mice〔J〕.Am J Pathol,2016;186(7):1847-60.
3张奕霞,杨 炜,邱明磊,等.整合素连接激酶对人视网膜色素上皮细胞增殖的影响〔J〕.眼科新进展,2012;32(9):831-3,840.
4Gil D,Cioczyk-Wierzbicka D,Dulińska-Litewka J,etal.Integrin-linked kinase regulates cadherin switch in bladder cancer〔J〕.Tumour Biol,2016;37(11):15185-91.
5幸 宇,邓世雄,齐 进,等.RNA干扰Tb人舌癌细胞整合素连接激酶基因表达可抑制移植瘤生长〔J〕.基础医学与临床,2015;35(3):289-94.
6Teng M,Huang Y,Zhang H.Application of stems cells in wound healing--an update〔J〕.Wound Repair Regen,2014;22(2):151-60.
7Chattopadhyay S,Raines RT.Review collagen-based biomaterials for wound healing〔J〕.Biopolymers,2014;101(8):821-33.
8Song H,Liang W,Xu S,etal.A novel role for integrin-linked kinase in periodic mechanical stress-mediated ERK1/2 mitogenic signaling in rat chondrocytes〔J〕.Cell Biol Int,2016;40(7):832-9.
9Bhushan B,Edwards G,Desai A,etal.Liver-specific deletion of integrin-linked kinase in mice attenuates hepatotoxicity and improves liver regeneration after acetaminophen overdose〔J〕.Gene Expr,2016;17(1):35-45.
10Kudryashova TV,Goncharov DA,Pena A,etal.HIPPO-integrin-linked kinase cross-talk controls self-sustaining proliferation and survival in pulmonary hypertension〔J〕.Am J Respir Crit Care Med,2016;194(7):866-77.
11Pang MF,Siedlik MJ,Han S,etal.Tissue stiffness and hypoxia modulate the integrin-linked kinase ILK to control breast cancer stem-like cells〔J〕.Cancer Res,2016;76(18):5277-87.
12张书俊.整合素连接激酶、醌氧化还原酶-1和增殖细胞核抗原在肝细胞癌中的表达及意义〔J〕.中国老年学杂志,2014;34(6):1511-3.
13Shen H,Ma JL,Zhang Y,etal.Integrin-linked kinase overexpression promotes epithelial-mesenchymal transition via nuclear factor-κB signaling in colorectal cancer cells〔J〕.World J Gastroenterol,2016;22(15):3969-77.
14Morgner J,Wickström SA.The weakest link:a new paradigm for stabilizing the integrin-actin connection〔J〕.Cell Cycle,2013;12(18):2929-30.
15周日兴,李叶扬,李 罡,等.整合素连接激酶信号通路在糖尿病大鼠皮肤病变及创面愈合中的作用〔J〕.中华烧伤杂志,2016;32(4):216-23.
