弱激光促进糖尿病大鼠皮肤创伤愈合及对PI3K/Akt-HIF-1α信号系统的影响
2018-06-05农庆文李顺堂刘达恩吴亚军
农庆文 李顺堂 刘达恩 吴亚军
(广西医科大学第一附属医院烧伤整形科,广西 南宁 530021)
糖尿病(DM)常伴随血管病变,包括大血管和微血管病变。其中大血管病变常引起下肢疼痛和间歇性跛行,严重者导致肢体坏疽,多与大血管病变引起皮肤缺血性病变,引发溃疡和感染相关。如何预防和治疗DM相关的大血管病变是DM治疗的重要内容〔1,2〕。弱激光对于创伤的治疗自20世纪60年代开始至今,其疗效饱受争议,与弱激光的治疗机制不明密切相关〔3〕。磷脂酰肌醇3 激酶(PI3K)、蛋白激酶B(Akt)和缺氧诱导因子(HIF)-1α是具有多种功能的信号通路,功能包括细胞新陈代谢、大分子合成、细胞代谢(生长、增殖和凋亡)等〔4〕。研究显示PI3K/Akt-HIF-1α信号系统可能参与2型DM创伤愈合相关〔5〕。本课题分析PI3K/Akt-HIF-1α信号系统在DM大鼠皮肤创伤愈合过程的表达,并分析不同剂量弱激光对于DM大鼠皮肤创伤愈合的作用和对其可能影响。
1 资料与方法
1.1受试动物 SD雄性大鼠100只,体重180~220 g,3~4月龄,广西实验动物中心提供,实验动物生产许可证证号:SCXK2014-0002。
1.2仪器和设备 血糖仪及配套血糖试纸(上海玉研科学仪器有限公司);GL21M型高速低温离心机(湖南凯达科学仪器有限公司)。
1.3DM大鼠皮肤创伤模型制备 2%的链脲佐菌素50 mg/kg腹腔注射,72 h后尾静脉取血,测血糖值,血糖≥16.8 mmol/L提示DM大鼠制备成功。大鼠采用水合氯醛麻醉,刮净背部,常规消毒术野,以无菌手术剪在背部在脊柱左右对称地剪开1 cm半径的圆形皮肤创口,手术全程保持自然暴露。
1.4分组与给药 将100只SD大鼠随机分为5组:正常组、非DM皮肤创伤组、DM皮肤创伤组、弱激光低剂量组和弱激光高剂量组,20只/组。除正常组和非DM皮肤创伤组,其余组造模处理,非DM皮肤创伤组不制备DM模型,给予创伤处理。造模第2天给药,正常组、非DM皮肤创伤组和DM皮肤创伤组不给予任何干预,弱激光低剂量组接受1.2 g·cm-2·6 min-1的弱激光照射,弱激光高剂量组接受3.6 g·cm-2·6 min-1的弱激光照射,连续照射7 d,创伤口以外部位避光处理。
1.5指标检测 ①记录创伤后1、3、7 d的创伤面积,分析各组创伤愈合情况。②记录各组创伤后1、3、7 d的体重及随机血糖。③HE染色。第8天,处死大鼠,沿窗口取边缘约1.0 cm×1.0 cm的皮肤组织,浸泡在40.0%甲醛溶液固定,常规石蜡切片,行HE染色。④Western印迹测定PI3K/Akt/HIF-1α信号通路蛋白。取约15 g皮肤匀浆裂解溶液,经十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳后,将蛋白转到聚偏二氟乙烯膜,用封闭液 5%牛血清白蛋白的Tween-20 Tris盐酸缓冲液(TBST)在室温封闭2 h,用TBST 1/1 000稀释兔抗鼠 PI3K、Akt、HIF-1α和β-actin一抗,将膜置于一抗溶液中 4℃过夜。再将膜取出洗涤后置于TBST1/5 000辣根过氧化物酶(HRP)的二抗溶液中,4℃反应 2 h。洗膜、曝光,以β-actin蛋白为内参。
1.6统计学方法 采用SPSS13.0 统计软件进行分析,计量资料采用方差分析,计数资料采用χ2检验。
2 结 果
2.1各组不同时间皮肤创伤面积比较 随着时间的延长,各组均有不同程度的愈合;与非DM皮肤创伤组比,DM皮肤创伤组愈合最慢(P<0.05);与DM皮肤创伤组比,弱激光低剂量组创伤后7 d和高剂量组创伤后1、3、7 d愈合明显(P<0.05),见表1。
2.2各组不同时间体重和随机血糖的比较 随着时间的延长,各组体重具有不同程度的增高。对照组和非DM皮肤创伤组不同时间的体重和随机血糖差异无统计学意义(P>0.05);DM皮肤创伤组、弱激光低和高剂量组不同时间的体重和随机血糖差异无统计学意义(P>0.05);与对照组和非DM皮肤创伤组比,DM皮肤创伤组、弱激光低和高剂量组的体重明显降低(P<0.05),随机血糖明显增高(P<0.05),见表2。

表1 各组不同时间皮肤创伤面积比较
与对照组比较:1)P<0.05,与非DM皮肤创伤组比较:2)P<0.05,与DM皮肤创伤组比较:3)P<0.05;下表同

表2 各组不同时间体重和随机血糖的比较
2.3各组皮肤HE染色 对照组皮肤肌细胞排列整齐,非DM皮肤创伤组、DM皮肤创伤组和弱激光低剂量组均存在不同程度的横纹肌坏死、肌纤维断裂和明显的嗜中性粒细胞浸润,其中DM皮肤创伤组最严重,其次非DM皮肤创伤组和弱激光低剂量组,弱激光高剂量组恢复较好,仅存少量肌纤维断裂。见图1。
2.4各组皮肤PI3K/Akt/HIF-1α信号通路蛋白表达 对照组和DM皮肤创伤组PI3K、 Akt和 HIF-1α均呈弱表达,非DM皮肤创伤组PI3K、 Akt和 HIF-1α均呈强表达,与DM皮肤创伤组比,弱激光低和高剂量组PI3K、 Akt和 HIF-1α的表达均较强(P<0.05),见图2和表3。
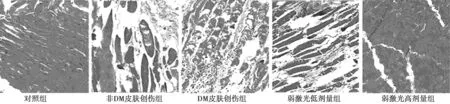
图1 各组皮肤HE染色(×100)

1.对照组,2.非DM皮肤创伤组,3.DM皮肤创伤组,4.弱激光低剂量组,5.弱激光高剂量组 图2 各组皮肤 PI3K/Akt-HIF-1α信号通路蛋白表达
表3 各组皮肤 PI3K/Akt /HIF-1α信号通路蛋白表达
3 讨 论
PI3K由一个调节亚基p85和一个催化亚基p110组成,主要功能使磷酸酰肌醇4,5-二磷酸磷酸化成第二信使磷脂酰肌醇3,4,5-三磷酸。在生长因素和(或)营养信号刺激下,PI3K作为上游激酶,磷酸化 Akt 位点,被激活的Akt 可抑制周期蛋白 D1降解,加快细胞周期G1/S1转换,促进增殖相关基因mRNA转录。PI3K/Akt 信号通路激活可促进血管内皮祖细胞归巢至缺血组织,促进血管再生,Akt敲除动物模型心血管系统因缺乏周细胞募集可导致层黏连蛋白沉积减少,血管基底膜变薄及血管成熟度降低。类似地,PI3K/AKT信号通路也可被PI3K抑制剂、ATP拮抗剂及二甲双胍等阻断,进而影响细胞增殖、扩散和血管生成等过程。本研究结果提示DM创伤皮肤的PI3K/Akt 信号通路处于受抑制状态,血管内皮祖细胞难以运送至缺血组织,血管再生困难,该结果与文献报道类似〔6~8〕。
PI3K/Akt 信号通路激活可活化HIF-1α表达相关的mRNA翻译活化,上调HIF-1α表达。血管生成或再生是创面愈合的关键因素,血管可输送营养与氧气至创面,同时携带炎症细胞与干细胞至创面。血管生成主要由低氧诱导,HIF-1α在调节细胞对低氧的反应,创面血管新生中起关键作用,包括内皮细胞活化、迁移和扩增,血管平滑肌细胞迁移和扩增,骨髓源性的成血管细胞动员、分化和扩增及基质重塑;调节特定的干细胞效应器。因为DM的创面微循环明显受损,连带内皮细胞的功能也受损〔8,9〕。
激光照射到皮肤组织,在皮肤组织内发生散射和吸收。本课题提示弱激光对血糖无明显作用。但大鼠皮肤的PI3K、Akt和HIF-1α蛋白表达均有明显提高,该结果与皮肤愈合、HE病理数据相吻合,且存在剂量依赖性关系,提示弱激光对DM性创伤有促进愈合的作用,其作用机制与激活PI3K/Akt-HIF-1α信号系统密切相关。文献也显示弱激光的作用靶点较多〔10~12〕:①能够明显减轻创伤的炎症反应,加快成纤维细胞的增殖,促进胶原蛋白合成;②促进上皮细胞及毛细血管再生;③调整整体免疫系统,提高酶活性,增强脂质过氧化作用。上述促进愈合的机制均与激活PI3K/Akt-HIF-1α信号通路存在直接或间接的关联。
4 参考文献
1Meyers T.Prevention of heel pressure injuries and plantar flexion contractures with use of a heel protector in high-risk neurotrauma,medical,and surgical intensive care units:a randomized controlled trial〔J〕.J Wound Ostomy Continence Nurs,2017;44(5):429-33.
2高林英,任文霞,冯永亮.2型糖尿病下肢血管病变的临床流行病学分析〔J〕.中华疾病控制杂志,2014;18(4):308-11.
3陈洪丽,王 宏,王 超,等.635nm/808nm双波长低能量激光对人成纤维细胞氧化应激反应的研究〔J〕.激光与光电子学进展,2015;52(8):253-9.
4Courtnay R,Ngo DC,Malik N,etal.Cancer metabolism and the Warburg effect: the role of HIF-1 and PI3K〔J〕.Mol Biol Rep,2015;42(4):841-51.
5Pouriran R,Piryaei A,Mostafavinia A,etal.The effect of combined pulsed wave low-level laser therapy and human bone marrow mesenchymal stem cell-conditioned medium on open skin wound healing in diabetic rats〔J〕.Photomed Laser Surg,2016;34(8):345-54.
6Li G,Li YY,Sun JE,etal.ILK-PI3K/AKT pathway participates in cutaneous wound contraction by regulating fibroblast migration and differentiation to myofibroblast〔J〕.Lab Invest,2016;96(7):741-51.
7Peng Y,Huang S,Wu Y,etal.Platelet rich plasma clot releasate preconditioning induced PI3K/AKT/NFκB signaling enhances survival and regenerative function of rat bone marrow mesenchymal stem cells in hostile microenvironments〔J〕.Stem Cells Dev,2013;22(24):3236-51.
8Shen K,Ji L,Gong C,etal.Notoginsenoside Ft1 promotes angiogenesis via HIF-1α mediated VEGF secretion and the regulation of PI3K/AKT and Raf/MEK/ERK signaling pathways〔J〕.Biochem Pharmacol,2012;84(6):784-92.
9Takhtfooladi HA,Asghari A,Amirkamali S,etal.Evaluation of low-level laser therapy on skeletal muscle ischemia-reperfusion in streptozotocin-induced diabetic rats by assaying biochemical markers and histological changes〔J〕.Lasers Med Sci,2016;31(6):1211-7.
10陈洪丽.低能量激光在组织修复中的应用研究〔D〕.北京:北京协和医学院,2016.
11孙 娜.弱激光照射对大鼠正畸移动牙牙周破骨细胞分化及PI3K/Akt通路影响的研究〔D〕.青岛:青岛大学,2015.
12马 慧.弱激光促进糖尿病大鼠模型皮肤创伤愈合的实验研究〔D〕.天津:天津医科大学,2012.
