血清钙、游离脂肪酸与社区老年代谢综合征的相关性分析
2018-06-04朱文奎
朱文奎, 徐 绮, 陈 晋
(1.上海市浦东新区沪东社区卫生服务中心,上海 200129;2.同济大学附属上海市肺科医院,上海 200092)
代谢综合征(metabolic syndrome,MS)是以糖代谢异常(糖尿病或糖代谢调节受损)、高血压、血脂异常、中心性肥胖等多种主要疾病或危险因素在个体中聚集为特征的一组临床症候群[1]。近年来,MS成为国内外共同关注的热点,但其发病机制仍未明确[2]。有研究显示,MS患者体内血钙(calcium,Ca)水平升高,其与MS的组分血糖、高血压和肥胖相关[3]。另外,MS患者体内由于出现胰岛素抵抗,所以常伴随游离脂肪酸(free fatty acid,FFA)水平升高[4]。因此,FFA在胰岛素抵抗中的作用也备受临床关注。目前,大部分研究针对血清FFA和MS的关系进行探讨,而探讨血清Ca水平与MS及其组分的关系的报道较少。本研究通过检测老年MS患者血清Ca、FFA及MS组分,探讨老年MS患者血清Ca、FFA与MS组分的相关性,旨在为社区老年MS的防治提供理论依据。
1 材料和方法
1.1 研究对象
选取2016年5—8月在上海市浦东新区沪东社区卫生服务中心进行体检的社区65岁及以上老年人,经询问病史及心电图等辅助检查剔除冠心病、感染性疾病、恶性肿瘤和免疫性疾病患者,共有217名老年人入选,根据是否患有MS分为2组:(1)MS组104例,其中男40例(38.4%)、女64例(61.6%),年龄(73.2±5.9)岁;(2)正常对照组113名,其中男65名(57.5%)、女48名(42.5%),年龄(71.9±5.7)岁,体检均无异常。所有研究对象均签署知情同意书。
1.2 MS诊断标准
MS诊断参照中华中医药学会糖尿病分会在国际糖尿病联盟(the International Diabetes Federation,IDF)2005年MS诊断标准的基础上制定的符合中国人群的诊断标准[5]:在具备必备指标的条件下,至少包括其他指标中的任意2项,可被诊断为MS。
必备指标:中心性肥胖(推荐的中国人腰围切点为男性≥90 cm、女性≥80 cm)。
其他指标:(1)空腹血糖(fasting plasma glucose,FPG)水平升高(≥5.6 mmol/L)或已被明确诊断为2型糖尿病;(2)甘油三酯(triglyceride,TG)水平升高(>1.7 mmol/L)或已经接受过针对性治疗;(3)高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)水平降低(男性<0.9 mmol/L,女性<1.1 mmol/L)或已经接受过针对性治疗;(4)血压升高[收缩压(systolic blood pressure,SBP)≥17.29 kPa(130 mmHg)或舒张压(diastolic blood pressure,DBP)≥11.31 kPa(85 mmHg)]或已接受降压治疗,或此前已经被明确诊断为高血压。
1.3 仪器与试剂
FPG、TG、HDL-C、Ca、FFA和HDL-C采用cobas 6000 c501全自动生化分析仪(瑞士罗氏公司)及配套试剂、c.f.a.s校准品测定,质控品由上海市临床检验中心提供。
1.4 方法
采集所有研究对象空腹8 h以上的静脉血3 mL,不抗凝,2 700×g离心15 min,分离血清,检测FPG、TG、HDL-C、Ca、FFA和HDL-C水平。同时收集所有研究对象腰围、血压等一般临床资料。
1.5 统计学方法
采用SPSS 20.0软件进行统计分析。呈正态分布的计量数据以表示,组间比较采用t检验。Ca、FFA与MS各组分之间的相关性采用多重线性回归分析和Pearson相关分析。以p<0.05为差异有统计学意义。
2 结果
2.1 MS组与正常对照组各项指标的比较
MS组腰围、TG、SBP、FPG、Ca、FFA水平均高于正常对照组(p<0.01),HDL-C水平低于正常对照组(p<0.01),而年龄、DBP 2个组之间差异均无统计学意义(P>0.05)。见表1。
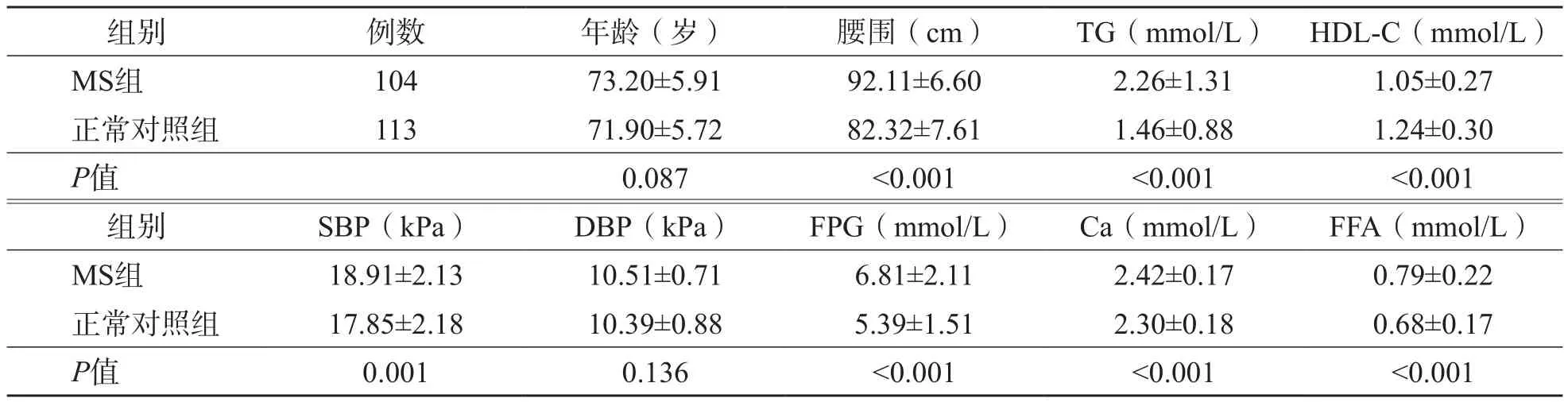
表1 MS组和正常对照组各项指标的比较
2.2 Ca、FFA与MS各组分的相关性分析
多重线性回归分析显示,MS各组分受年龄、性别及血清Ca、FFA水平的影响。见表2。
在排除年龄和性别的影响后采用Pearson相关分析评估Ca、FFA与MS各组分的相关性。结果显示Ca与腰围、TG、SBP、FPG均呈正相关(r值分别为0.182、0.367、0.173、0.361,p<0.01),与HDL-C呈负相关(r=-0.358,p<0.01);FFA与TG、FPG均呈正相关(r值分别为0.324和0.215,p<0.01)。见表3。
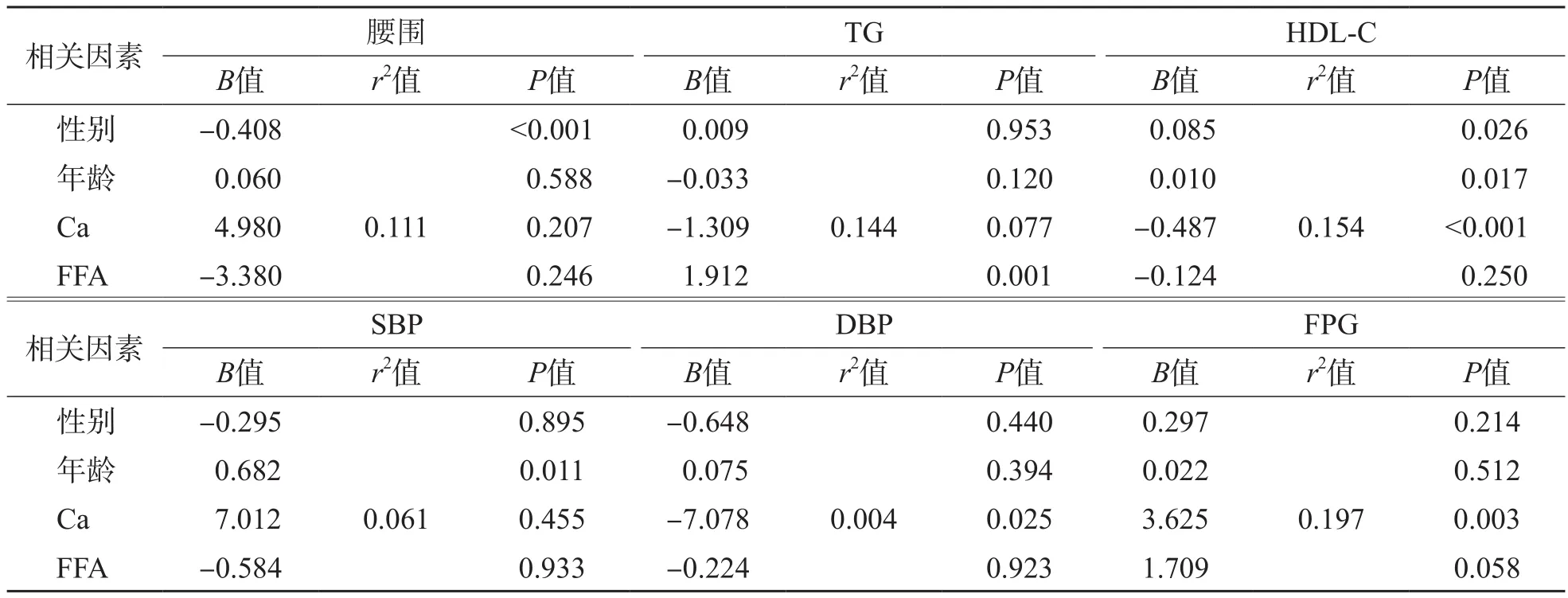
表2 MS患者性别、年龄、Ca、FFA与MS各组分的多重线性回归分析

表3 血清Ca、FFA与MS各组分的相关性分析
3 讨论
MS是以胰岛素抵抗为基础的一系列代谢组分异常的聚集状态,包括中心性肥胖、血糖升高、血脂异常和血压升高。目前,心血管疾病已成为全世界范围内严重危害人类健康的疾病。有研究发现,MS患者心脑血管疾病的发生风险比非MS者高3倍以上[6]。因此,研究MS的发病机制对预防MS和心脑血管疾病的发生有十分重要的意义。本研究通过测定社区老年MS患者血清Ca和FFA水平,并分析其与MS组分的相关性,为MS的发病机制研究提供依据。
Ca是人体必需的常量元素之一。目前,有关血清Ca水平与MS相关性的研究并不多见。NAKASHIMA等[7]研究发现,MS患者体内胰岛素抵抗增强引起1α-羟化酶活性降低,影响了1,25-羟基维生素D3的生成,导致肾脏对Ca、磷的重吸收减少,血Ca水平降低[7]。血Ca水平降低可反馈性引起甲状旁腺激素升高,从而增加骨质分解代谢,导致血Ca水平升高[8]。本研究结果显示,MS组血清Ca水平高于正常对照组(p<0.01),提示血清Ca水平与MS之间存在内在联系。多重线性回归分析发现,MS各组分受年龄、性别及血清Ca、FFA水平的影响。在排除年龄和性别的影响后进行相关性分析,结果显示Ca与腰围、TG、SBP、FPG均呈正相关(r值分别为0.182、0.367、0.173、0.361,p<0.01),与HDL-C呈负相关(r=-0.358,p<0.01)。Ca有参与血压调节的作用,其主要通过调节血管平滑肌的舒缩来调节血压。糖代谢异常患者由于胰岛素相对或绝对缺乏,影响了骨胶原的形成,导致骨盐沉着减少、骨蛋白分解增加,Ca、磷从尿液中排出增多。为维持血液中Ca、磷的平衡,代偿性地引起甲状旁腺素分泌增加、降钙素分泌减少[9]。胰岛β细胞分泌胰岛素,对肌肉、脂肪及肝脏等组织进行调节,从而影响糖、脂的代谢,因此机体糖代谢异常易并发血脂代谢紊乱,低密度脂蛋白胆固醇、TG水平的升高尤为明显,并随着血糖水平的升高,血脂紊乱进一步加重,TG水平越高,胰岛素抵抗越明显,进而导致血清Ca水平明显升高[10]。罗楠等[11]研究发现,膳食高Ca虽对高脂诱导大鼠肥胖的形成有一定的干预作用,但与正常的饲料喂养比较,仍有较高的成脂作用,即高水平Ca不能完全抑制高脂对肥胖形成的促进。由此提示老年MS患者要防止Ca的过量摄入。
正常人的血清FFA水平极低,因此FFA可作为人体内脂质代谢活跃程度的指标。本研究结果显示,老年MS组血清FFA水平高于正常对照组(p<0.01),提示血清FFA与老年MS的发生有一定的联系。相关性分析显示FFA与TG、FPG均呈正相关(r值分别为0.324和0.215,p<0.01)。FFA可通过多种方式干扰胰岛素的作用,影响葡萄糖代谢。高水平的FFA可影响胰岛素的许多功能,如肝糖异生和糖原分解。FFA长期高水平还可损伤胰岛β细胞功能,引起胰岛素抵抗,导致MS的发生。另外,体内FFA过多可刺激机体反应氧自由基产生增多,从而诱发细胞发生氧化应激反应。氧化应激是糖尿病发生的重要原因。体内过多的反应氧自由基引起的氧化应激反应可导致胰岛β细胞受损,引起胰岛素抵抗[12],促进MS的发生、发展。许银银等[13]的研究显示,血中FFA水平与MS组分中的腹型肥胖、TG水平呈正相关,其机制可能是由于体脂量增多,脂肪细胞体积变大,导致释放出来的FFA增多,而FFA利用并没有相应增加,因此导致 FFA水平升高。血清FFA水平升高可引起炎性反应、氧化应激反应和血管反应性异常变化,这些异常反应均可导致胰岛素抵抗的发生,促使MS发生。
综上所述,本研究分析了社区老年MS患者血清Ca和FFA与MS各组分之间的相关性。血清Ca水平升高与社区老年MS相关,社区老年MS患者应限制Ca的过量摄入;血清FFA水平升高主要与社区老年MS患者糖脂代谢异常有关。本研究仅探讨了社区老年MS患者与非MS者各项指标的差异,但老年MS患者和非老年MS患者之间相关指标是否存在差异还未见相关报道,有待于进一步研究。
[1]PANIAGUA J A. Nutrition, insulin resistance and dysfunctional adipose tissue determine the different components of metabolic syndrome[J].World J Diabetes,2016,7(19):483-514.
[2]RUDERMAN N B,CARLING D,PRENTKI M,et al. AMPK,insulin resistance,and the metabolic syndrome[J]. J Clin Invest,2013,123(7):2764-2772.
[3]蔡奕琪,吕全,阮希成,等.血清钙水平对老年2型糖尿病患者血糖控制状况的影响[J].中国老年学杂志,2015,35(18):5163-5164.
[4]陈效琴,任静. 游离脂肪酸、胰岛素抵抗与代谢综合征相关因素的关系[J]. 检验医学,2016,31(7):553-558.
[5]中华中医药学会糖尿病分会. 糖尿病合并代谢综合征中医诊疗标准[J]. 世界中西医结合杂志,2011,6(2): 177-179.
[6]ISOMAA B,ALMGREN P,TUOMI T,et al.Cardiovascular morbidity and mortality associated with the metabolic syndrome[J]. Diabetes Care,2001,24(4): 683-689.
[7]NAKASHIMA A,YOKOYAMA K,YOKOO T, et al. Role of vitamin D in diabetes mellitus and chronic kidney disease[J]. World J Diabetes,2016,7(5):89-100.
[8]王珊珊,陈莉明,常宝成,等.2型糖尿病患者血清钙与糖代谢的相关关系[J].中华内分泌代谢杂志,2014,30(1):26-30.
[9]倪光臻,沈守祥,于永红. 糖尿病患者钙、磷代谢及相关激素变化研究[J]. 山东医药,2001,41(5): 29-30.
[10]易云平,张思伟,潘虹. 老年2型糖尿病骨质疏松相关因素分析[J]. 中国骨质疏松杂志,2017,23(1):59-61.
[11]罗楠,秦锐.膳食钙对高脂饮食大鼠肥胖形成的影响[J].江苏医药,2007,33(2):162-164.
[12]胡彩虹,韦锦涛,郭东亮. 游离脂肪酸检测在2型糖尿病胰岛素抵抗临床应用[J]. 糖尿病新世界,2017,20(4):61-62.
[13]许银银,刘北忠.血清游离脂肪酸、同型半胱氨酸与代谢综合征的相关性研究[J].检验医学与临床,2015,12(21):3131-3132.
