MDS-RA/RARS/RCMD患者外周血循环CD34+细胞计数的临床价值
2018-06-04董海波张启国袁翠英
董海波, 曾 慧, 张启国, 周 敏, 袁翠英, 陈 兵
(南京大学医学院附属鼓楼医院血液科,江苏 南京 210008 )
CD34+抗原是唾液酸黏蛋白样Ⅰ型跨膜磷酸糖蛋白,是一种高度糖基化分子,该抗原在人类造血干细胞、祖细胞表面选择表达[1]。如果造血功能稳定,造血干细胞很少在骨髓与外周血循环间交换,但有许多因素可导致骨髓CD34+细胞向外周血循环迁移[1-2]。已有研究结果表明,急性白血病、骨髓纤维化等恶性血液病患者外周血循环CD34+细胞计数存在异常增加现象[3-5]。另有研究结果表明,骨髓增生异常综合征(myelodysplastic syndrome,MDS)患者外周血循环CD34+细胞计数不仅存在异常增加现象,而且与疾病危险度分组、染色体核型、国际预后积分系统(the International Prognostic Scoring System,IPSS)预后积分等指标相关。随着研究工作的深入,有学者发现即使疾病在低危阶段,即难治性贫血(refractory anemia,RA)/难治性贫血伴环形铁粒幼细胞增多(refractory anemia with ring sideroblasts,RARS)/难治性贫血伴多系异常(refractory cytopenia with multilineage dysplasia,RCMD)阶段,MDS患者外周血循环CD34+细胞计数亦可出现增加的情况[6-8]。
1 材料和方法
1.1 研究对象
选取2009年2月—2015年6月于南京大学医学院附属鼓楼医院血液科就诊的52例MDS患者(男30例、女22例),年龄15~84岁。根据世界卫生组织(World Health Organization,WHO)MDS诊断标准,所有患者均为MDS-RA/RARS/RCMD。另选取19名造血干细胞供者(男11名、女8名)为正常对照者,年龄22~38岁。
1.2 方法
1.2.1 外周血循环CD34+细胞计数检测 采用FACSCalibur流式细胞仪(美国BD公司)进行检测。鞘液使用ISOTON Ⅲ血细胞稀释液(美国Beckman公司)。使用ProCOUNT 试剂盒(美国BD公司,批号为340498),该试剂盒配有核酸染料、藻红蛋白(phycoerythrin,PE)标记的CD34单抗(抗HPCA22),多甲藻黄素-叶绿素-蛋白质复合物(peridinin-chlorophyllprotein complex,PerCP)标记的CD45 单抗(抗HLe2l),PE标记的同型对照IgG1。抽取患者、正常对照者静脉血2 mL,运用乙二胺四乙酸管进行抗凝处理。取含有定量荧光微球的TruCOUNT管2支,分别标记为测定(test,T)管、对照(control,C)管。T管中加入核酸染料/CD34 2PE/CD45 2PerCP试剂20 μL,C管中加入核酸染料/IgG1 2PE/CD45 2PerCP试剂20 μL。采用反向加样法,分别加入标本50 μL(应预先对加入标本进行处理,将其有核细胞水平调整为15×109/L左右),混匀,室温、避光染色15 min。加溶血素450 μL,室温、避光放置30 min,旋涡混合器混匀5 s,上机检测,运用ProCOUNT软件分析数据。
1.2.2 染色体检测 取肝素抗凝骨髓5 mL,采用直接法、24 h培养法和同步法制备染色体。采用R带技术显带,描述核型。根据IPSS预后积分,对MDS-RA/RARS/RCMD患者染色体核型进行分组。染色体良好核型组包括正常染色体核型、-Y、5q-、20q-;染色体不良核型组包括复杂染色体核型异常(异常≥3种)、7号染色体核型异常;染色体中间核型组包括除上述2类以外的其他染色体核型异常。
1.2.3 其他检查 所有患者均接受血常规检查、骨髓涂片检查和骨髓活检。
1.3 IPSS预后积分及疾病危险度分组
根据骨髓原始细胞百分比、骨髓造血细胞染色体核型和外周血细胞减少系列数进行计分。0分计为低危,0.5~1.0分计为中危Ⅰ,1.5~2.0分计为中危Ⅱ,≥2.5分计为高危。
1.4 WHO分型预后积分系统(WHO-Based Prognostic Scoring System,WPSS)预后积分及疾病危险度分组
根据WHO亚型、骨髓造血细胞染色体核型和有无输血依赖进行计分。0分计为极低危,1分计为低危,2分计为中危,3~4分计为高危,5~6分计为极高危。
1.5 统计学方法
使用SPSS 17.0软件进行统计分析。采用Pearson χ2检验以及 Fisher精确检验进行统计分析。以p<0.05为差异有统计学意义。
2 结果
2.1 MDS-RA/RARS/RCMD患者与正常对照者外周血循环CD34+细胞表达
正常对照者外周血循环CD34+细胞百分比和计数[中位数(范围)]分别为0.04%(0.01%~0.14%)、[1.75(0.90~4.69)]×106/L,MDS-RA/RARS/RCMD患者外周血循环CD34+细胞百分比和计数[中位数(范围)]分别为0.14%(0.01%~7.35%)、[3.01(0.17~208.00)]×106/L。MDS-RA/RARS/RCMD患者外周血循环CD34+细胞百分比和计数均高于正常对照者(p<0.01)。所有正常对照者外周血循环CD34+细胞计数均<10.00×106/L。见图1、图2。
2.2 MDS-RA/RARS/RCMD患者外周血循环CD34+细胞计数与临床特点
MDS-RA/RARS/RCMD患者外周血循环CD34+细胞计数与性别、年龄、外周血血细胞减少程度、白细胞计数下降、幼稚前体细胞异常定位(abnormal localization of immature precursor,ALIP)现象均无相关性(r<0.625,P>0.05),而与染色体核型异常、IPSS预后积分、WPSS预后积分、骨髓纤维化相关(r>0.995,p<0.01)。外周血循环CD34+细胞计数>10.00×106/L的 MDSRA/RARS/RCMD患者共有16例,其余36例外周血循环CD34+细胞计数<10.00×106/L。
外周血循环CD34+细胞计数>10.00×106/L的16例MDS-RA/RARS/RCMD患者中,有12例伴有复杂染色体核型异常(异常≥3种),其中10例伴有7号染色体核型异常;有12例IPSS预后积分为中危Ⅱ;有13例WPSS预后积分为高危; 9例伴有骨髓纤维化。
36例外周血循环CD34+细胞计数<10.00×106/ L的MDS-RA/RARS/RCMD患者均不伴有复杂染色体核型异常及7号染色体核型异常;所有患者IPSS预后积分均为低危或中危Ⅰ;除1例患者WPSS预后积分为高危外,其余患者的WPSS预后积分均为极低危、低危或中危;除1例患者伴有骨髓纤维化外,其余患者均不伴有骨髓纤维化。见图3。
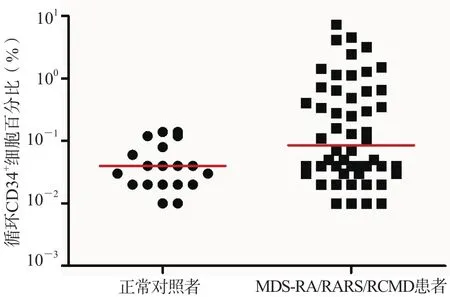
图1 正常对照者与MDS-RA/RARS/RCMD患者外周血循环CD34+细胞百分比
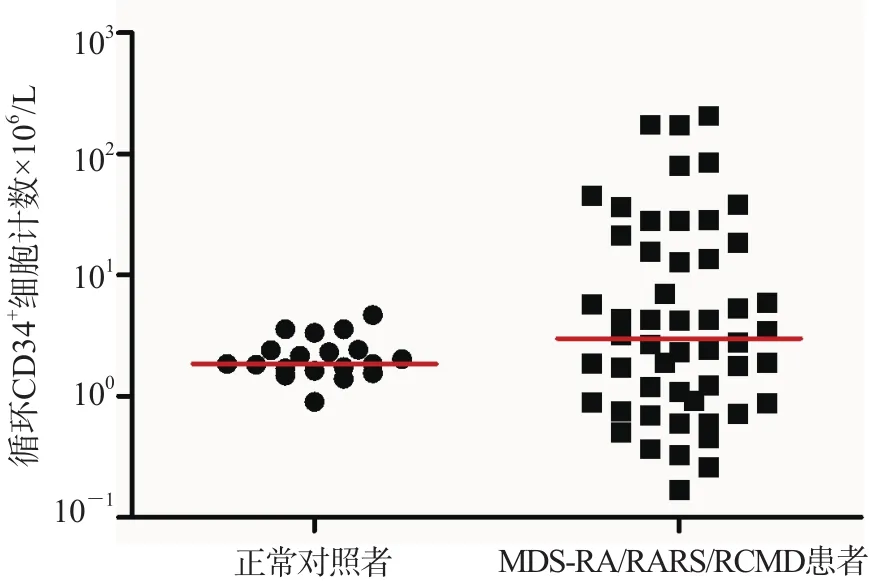
图2 正常对照者与MDS-RA/RARS/RCMD患者外周血循环CD34+细胞计数
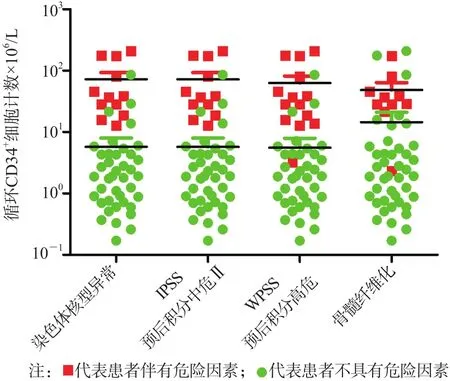
图3 外周血循环CD34+细胞计数与MDS-RA/RARS/RCMD患者临床特点示意图
3 讨论
CD34+抗原主要在人类造血干细胞、祖细胞阶段呈特异性表达。随着造血细胞的不断成熟,CD34+抗原表达逐渐减弱,直至消失。在稳定的造血情况下,该抗原在有核循环血细胞上表达极低,约占未经动员外周血单个核细胞的0.2%[9]。药物诱导的干细胞动员、急性白血病、骨髓纤维化等均可导致骨髓CD34+细胞向外周血循环迁移[10]。
国内外研究工作已证实MDS患者外周血循环CD34+细胞计数存在异常增加现象,而且与疾病危险度分组、不良细胞遗传的出现、白血病相关生存率、IPSS预后积分等具有相关性,是急性白血病的早期信号。当患者处于RA/RARS/RCMD阶段,即“低危”阶段时,其外周血循环CD34+细胞计数往往<10.00×106/L,而大多数“高危” 难治性贫血伴原始细胞增多(refractory anemia with excess blast,RAEB)阶段的MDS患者外周血循环CD34+细胞计数>10.00×106/L,且随着疾病危险度的升高,外周血循环CD34+细胞计数亦逐渐增加。当对疾病状态、预后分组进行判断时,外周血循环CD34+细胞计数较CD34+细胞百分比更敏感。KNIPP等[11]研究使用10.00×106/L作为初诊MDS患者外周血循环CD34+细胞计数的临界值,可较好地鉴别疾病“低危”“高危”状态。
对急性白血病,尤其是对急性早幼粒细胞白血病的研究发现,急性早幼粒细胞白血病患者外周血循环CD34+细胞计数均<10.00×106/L。随着研究工作的深入,有学者发现,部分急性早幼粒细胞白血病患者外周血循环CD34+细胞计数亦可出现>10.00×106/L的情况,此类患者往往具有一种或多种诸如复杂染色体核型异常、FLT3-ITD基因阳性突变、PML/RARa融合基因复杂融合、高白细胞计数的不良预后因素。当把MDS限定在RA/RARS/RCMD“低危”阶段时,多数MDS患者外周血循环CD34+细胞计数符合既往研究规律,即<10.00×106/L。部分急性早幼粒细胞白血病RA/RARS/RCMD阶段患者外周血循环CD34+细胞计数可>10.00×106/L。进一步研究发现该细胞计数的多少与患者性别、年龄、外周血细胞减少程度、白细胞计数下降、ALIP现象均无相关性,而与染色体核型异常、IPSS预后积分、WPSS预后积分、骨髓纤维化等不良预后因素有关[6-8]。
克隆性染色体核型异常是MDS最主要的克隆性造血证据,不仅是MDS的确诊条件之一,还是MDS患者的独立预后因素,不同染色体核型预后分组是确定不同治疗方案的主要依据。复杂染色体核型异常尤其是7号染色体核型异常是MDS的高危预后因素。具有上述染色体核型异常的MDS患者,疾病更易进展,并易向急性白血病转化,常规治疗方案效果差,临床需采取更为积极的治疗策略[12-13]。本研究发现,外周血循环CD34+细胞计数>10.00×106/L的MDS-RA/RARS/RCMD患者,有75.0%(12/16)伴有复杂染色体核型异常(异常≥3种),并且其中83.3%(10/12)的患者为7号染色体核型异常,并伴有其他染色体核型异常。这一结果表明,MDSRA/RARS/RCMD患者外周血循环CD34+细胞计数>10.00×106/L提示患者可能具有不良染色体核型,疾病转化为白血病的可能性较大,患者中位生存期短,预后不良。然而,外周血循环CD34+细胞计数未>10.00×106/L的MDS-RA/RARS/RCMD患者,不伴有复杂染色体核型异常。
近年来,常用IPSS及WPSS对疾病危险度进行分组,并为MDS治疗提供了准确的指导方向。随着预后积分的升高,患者中位生存期及疾病向白血病转化的时间缩短。IPSS预后积分为中危Ⅱ和高危的MDS患者与WPSS预后积分为高危和极高危的MDS患者,往往疾病恶性程度高、预后不良,临床医师应采用更为行之有效的化疗方案[14]。本研究发现外周血循环CD34+细胞计数>10.00×106/L的MDS-RA/RARS/RCMD患者中分别有75.0%(12/16)及81.3%(13/16)的患者IPSS预后积分为中危Ⅱ及WPSS预后积分为高危,而外周血循环CD34+细胞计数未 >10.00×106/L的MDS-RA/RARS/RCMD患者IPSS预后积分均为低危或中危Ⅰ,除1例WPSS预后积分为高危外,其余患者的WPSS预后积分均为极低危、低危或中危。
MDS患者除了有骨髓病态造血的情况外,还可能伴有骨髓纤维化。MDS伴有骨髓纤维化是疾病的独立不良预后因素[15]。本研究发现52例MDS-RA/RARS/RCMD患者10例伴有骨髓纤维化,其中9例患者外周血循环CD34+细胞计数 >10.00×106/L,而外周血循环CD34+细胞计数未>10.00×106/L的患者仅有1例伴有骨髓纤维化。
综上所述,MDS-RA/RARS/RCMD患者外周血循环CD34+细胞计数可出现异常增加,外周血循环CD34+细胞计数>10.00×106/L的患者多伴有复杂染色体核型异常,疾病危险度高,预后不良。外周血循环CD34+细胞计数检测方便、简单,患者痛苦小,有助于对MDS患者疾病危险度的进一步分层,具有一定的临床实用价值。
[1]WAGNER-SOUZA K,DIAMOND H R,ORNELLAS M H,et al. Rhodamine 123 efflux in human subpopulations of hematopoietic stem cells:comparison between bone marrow,umbilical cord blood and mobilized peripheral blood CD34+ cells[J].Int J Mol Med,2008,22 (2):237-242.
[2]CHICHA L,FEKI A,BONI A,et al. Human pluripotent stem cells differentiated in fully defined medium generate hematopoietic CD34- and CD34+progenitors with distinct characteristics[J]. PLoS One, 2011,25 (6):14733.
[3]ALCHALBY H,LIOZNOV M,FRITZSCHEFRIEDLAND U,et al. Circulating CD34(+) cells as prognostic and follow-up marker in patients with myelofibrosis undergoing allo-SCT[J]. Bone Marrow Transplant,2012,47(1):143-145.
[4]关朝阳,张启国,欧阳建,等. 骨髓增生异常综合征和急性白血病患者外周血中CD34+水平的研究[J]. 南京医科大学学报(自然科学版),2010,30(6):847-849.
[5]曾慧,张启国,欧阳建,等. 骨髓增殖性肿瘤患者外周血CD34+细胞水平及临床意义[J]. 江苏医药,2014,40(13):1550-1552.
[6]CESANA C,KLERSY C,BRANDO B,et al.Prognostic value of circulating CD34+ cells in myelodysplastic syndromes[J]. Leuk Res,2008,32(11):1715-1723.
[7]FUCHIGAMI K,MORI H,MATSUO T,et al.Absolute number of circulating CD34+ cells is abnormally low in refractory anemias and extremely high in RAEB and RAEB-t;novel pathologic features of myelodysplastic syndromes identified by highly sensitive flow cytometry[J].Leuk Res,2000,24(2):163-174.
[8]曾慧,张启国,欧阳建,等. 骨髓增生异常综合征患者外周血循环CD34+细胞计数的临床研究[J]. 临床肿瘤学杂志,2012,17(9): 832-835.
[9]PONCHIO L,EAVES C,HOGGE D,et al. Both cycling and noncycling primitive progenitors continue to be mobilized into the circulation during the leukapheresis of patients pretreated with chemotherapy and G-CSF[J].Br J Haematol,1997,99(2): 394-402.
[10]曾慧,张启国,欧阳建,等. 全血细胞减少患者外周血循环CD34+细胞计数的临床意义[J]. 中华临床医师杂志(电子版),2013,7(11):5071-5073.
[11]KNIPP S,STRUPP C,GATTERMANN N,et al.Presence of peripheral blasts in refractory anemia and refractory cytopenia with multilineage dysplasia predicts an unfavourable outcome[J]. Leuk Res,2008,32(1):33-37.
[12]KAWANKAR N,VUNDINTI B R. Cytogenetic abnormalities in myelodysplastic syndrome: an overview[J]. Hematology,2011,16(3): 131-138.
[13]HUSSAIN F T,NGUYEN E P,RAZA S,et al. Sole abnormalities of chromosome 7 in myeloid malignancies: spectrum,histopathologic correlates,and prognostic implications[J]. Am J Hematol,2012,87(7): 684 -686.
[14]JONAS B A,GREENBERG P L. MDS prognostic scoring systems-past, present, and future[J]. Best Pract Res Clin Haematol, 2015,28(1) :3-13.
[15]江凤,王元元,岑建农,等. 骨髓增生异常综合征中CD34(+)细胞自噬活性及临床意义[J]. 中国实验血液学杂志,2016,24(3):779-783.
