姜黄素对高尿酸血症大鼠肾组织中TGF-β1、NF-κB表达的影响
2018-05-30陈亚利欧阳军孟晶茜张文吉崔琴琴赵瑛瑛
陈亚利,欧阳军,孟晶茜,刘 丁,张文吉,崔琴琴,赵瑛瑛
1)郑州大学第二附属医院肾内科 郑州 450014 2)郑州大学医药科学研究院内分泌实验室 郑州 450052
高尿酸血症(hyperuricemia,HUA)是一种尿酸合成增加和(或)尿酸排泄减少所引起的代谢性疾病。近年来,随着人们生活水平提高及饮食结构的改变,HUA发病率逐年上升,且呈年轻化趋势,HUA可通过炎症反应、氧化应激等途径引起肾小球硬化及肾间质肾纤维化[1]。研究[2-3]表明,转录生长因子-β1(transforming growth factor-β1,TGF-β1)高表达是导致HUA肾损害的重要环节,HUA可诱导上调TGF-β1的表达,趋化炎症细胞诱导上皮间充质转变(epithelial-mesenchymal transition,EMT)。核转录因子-κB(nuclear factor-kappa B, NF-κB)是一种具有多向性调节作用的核转录因子,通过调控一些细胞因子、趋化因子和蛋白基因的表达,参与HUA肾损害的炎症反应、氧化应激、免疫反应及细胞增殖等过程[4-6]。姜黄素是一种从姜黄提取出来的植物多酚,具有强大的抗炎、抗氧化作用。研究[7]发现,在糖尿病肾病等慢性肾脏病的发生发展中,姜黄素可通过减轻氧化应激、炎症反应等过程发挥肾脏保护作用。但目前关于姜黄素对HUA肾脏保护作用的研究较少,本研究拟通过建立HUA大鼠模型,观察姜黄素对HUA大鼠肾脏组织中TGF-β1及NF-κB表达的影响,探讨姜黄素肾脏保护作用的可能机制。
1 对象与方法
1.1实验动物和试剂SPF级雄性SD大鼠36只,200~250 g,购自湖南斯莱克景达实验动物有限公司,动物合格证书编号:43004700032287。每笼4只,予12 h光照、12 h黑暗交替,温度(22±2)℃,相对湿度控制在50%~60%,自由饮水及进食。氧嗪酸钾、羧甲基纤维素钠和姜黄素(美国Sigma公司),兔抗鼠TGF-β1抗体(英国Abcam公司),兔抗鼠NF-κB 抗体(北京博奥森生物技术有限公司)。
1.2HUA模型制备及处理方法大鼠适应性喂养1周后,采用随机数字表法将大鼠分为对照组、氧嗪酸钾组、氧嗪酸钾+姜黄素(联合)组,每组12只。氧嗪酸钾组及联合组给予750 mg/kg氧嗪酸钾灌胃[溶于5 g/L羧甲基纤维素钠(CMC-Na)中]4周,制备HUA模型[8]。模型成功后,联合组给予姜黄素200 mg/kg, 1次/d灌胃,进行8周,对照组及氧嗪酸钾组给予等量的10 g/L CMC-Na混悬液灌胃,实验共进行12周。
1.3检测项目及方法实验0、4、12周称体重,12周将大鼠放入代谢笼留24 h尿量,期间自由进食,自由饮水,将收集的尿液3 000 r/min离心5 min后取上清液,用日立全自动生化仪检测24 h尿蛋白定量;采眶静脉血1.5 mL,4 500 r/min离心10 min,取血清,用日立全自动生化仪检测血清尿酸(UA)、尿素氮(BUN)、肌酐(Scr)、胱抑素C(Cys-C)。
1.4肾脏病理学检查和肾脏组织中TGF-β1、NF-κB蛋白检测于第12周水合氯醛腹腔注射麻醉后处死大鼠,心脏取血后迅速分离双侧肾脏,置于40 g/L多聚甲醛固定液固定24 h,石蜡包埋后切片,厚度3 μm,行HE染色及Masson染色,光镜下观察肾脏组织病理变化,并行TGF-β1、NF-κB免疫组织化学染色,阳性信号为棕黄色着色,在高倍镜视野下选取10个不重叠的视野,用Image-pro-plus version 6.0图像分析软件测定TGF-β1、NF-κB在肾脏组织中的表达量,并进行半定量评分。
1.5统计学处理采用SPSS 20.0进行分析,应用单因素方差分析和LSD-t检验比较各组大鼠BUN、Scr、Cys-C、24 h尿蛋白定量水平的差异,应用重复测量数据的方差分析比较各组大鼠不同时间点血清UA水平的差异,检验水准α=0.05。
2 结果
2.1各组大鼠一般状况比较实验期间,对照组大鼠一般状况良好,饮食正常;氧嗪酸钾组大鼠出现精神欠佳,皮毛干枯,发黄,光泽度差; 联合组大鼠经过治疗干预后,精神状态好转,毛发改善。实验期间各组大鼠均无死亡。
2.2各组大鼠生化指标比较见表1。
2.3各组大鼠不同时间点血清UA水平比较见表2。实验前,3组大鼠血清UA水平差异无统计学意义(P>0.05),实验第4、12周,与对照组相比,氧嗪酸钾组及联合组UA水平升高(P<0.05),氧嗪酸钾组与联合组尿酸水平差异无统计学意义。
2.4各组大鼠肾脏病理改变见图1。对照组大鼠肾小球、肾小管结构清楚,基底膜厚度均一,毛细血管腔开放良好,间质未见炎性细胞浸润、纤维组织增生;氧嗪酸钾组大鼠肾小球结构清晰,未见明显肿大,部分肾小管上皮细胞肿胀,肾小管轻度扩张,肾间质少量炎性细胞浸润,纤维组织成分明显;联合组大鼠肾小球结构清楚,无明显肿大,毛细血管腔开放良好,肾小管间质炎性细胞浸润较氧嗪酸钾组明显减轻,纤维组织成分明显减少。
2.5各组大鼠肾脏组织中TGF-β1、NF-κB蛋白检测结果见表3、图2。对照组大鼠肾小球及肾小管TGF-β1、NF-κB均少量表达;氧嗪酸钾组及联合组表达量明显增加(P<0.05),主要在肾小球及肾小管表达;与氧嗪酸钾组相比,联合组表达量减少,差异有统计学意义(P<0.05)。
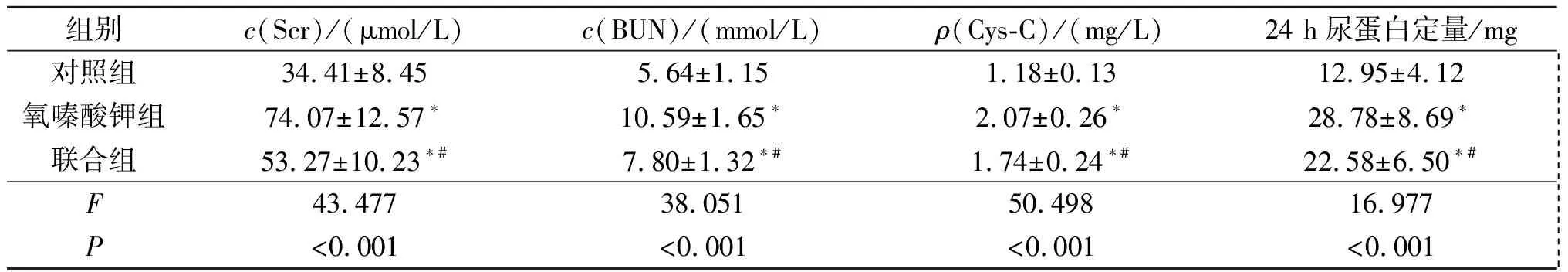
表1 各组大鼠BUN、Scr、Cys-C、24 h尿蛋白定量水平比较(n=12)
*:与对照组比较,P<0.05;#:与氧嗪酸钾组比较,P<0.05

表2 各组大鼠不同时间点血清UA水平比较(n=12) μmol/L
F组别=202.209,F时间=348.146,F交互=13.758;P均<0.001;*:与对照组比较,P<0.05

表3 各组大鼠肾脏组织TGF-β1、NF-κB蛋白半定量分析比较 (n=12)
FTGF-β1=51.551,FNF-κB=40.288,P均<0.001;*:与对照组比较,P<0.05;#:与氧嗪酸钾组比较,P<0.05
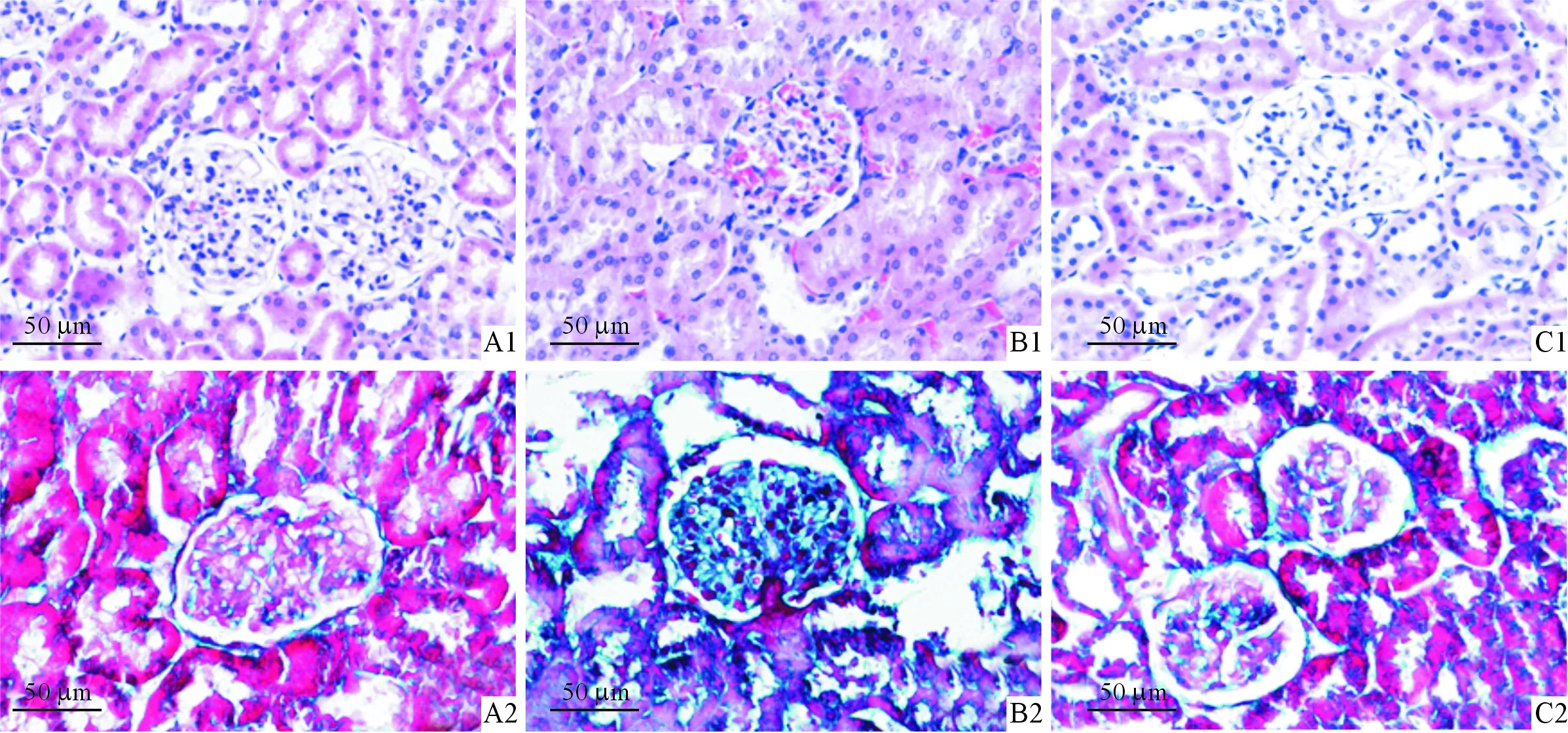
1:HE染色;2:Masson染色;A:对照组; B:氧嗪酸钾组;C:联合组图1 3组大鼠肾脏病理学变化(HE和Masson染色,×400)
3 讨论
传统认为,HUA主要通过尿酸盐晶体在肾脏沉积引起肾脏损伤,其机制类似痛风性关节炎;近年来多项研究[9-12]表明,无症状HUA可通过炎症反应、氧化应激及激活肾素-血管紧张素-醛固酮系统(RAAS)等引起肾小球硬化及肾间质纤维化。本研究结果显示,与对照组相比,氧嗪酸钾组及联合组于第4周血清UA水平升高,提示单独应用尿酸酶抑制剂氧嗪酸钾可成功建立HUA模型。研究[6]发现,在糖尿肾病等慢性肾脏病的发生发展中,姜黄素可通过减轻氧化应激、炎症反应及调控多种细胞因子的表达,发挥肾脏保护作用。本研究结果显示:实验第12周,与对照组比较,氧嗪酸钾组的Scr、BUN及Cys-C水平均明显升高;经姜黄素干预后,联合组的Scr、BUN及Cys-C均明显下降,提示姜黄素对HUA引起的肾损伤具有保护作用。正常情况下,大部分蛋白不能通过肾小球滤过膜,尿中的蛋白量极少,当肾小球滤过膜受损时可出现蛋白尿增加[13]。本研究结果显示,12周氧嗪酸钾组的24 h尿蛋白定量较对照组明显升高,差异有统计学意义,与上述报道相符,但其确切机制有待进一步研究。

1:TGF-β1;2:NF-κB;A:对照组; B:氧嗪酸钾组;C:联合组图2 3组大鼠肾脏组织中TGF-β1、NF-κB蛋白表达(SP,×400)
姜黄素是姜黄的主要成分,属于植物多酚,具有广泛的生物活性, 如抗炎、抗氧化、抗癌和促进伤口愈合等特性[14]。TGF-β1是目前主要的致组织纤维化的细胞因子,TGF-β1高表达与肾脏损伤关系密切,不仅参与糖尿病肾病的发生发展[15-16],在HUA肾病中也发挥重要作用[2-3]。TGF-β1在正常肾组织内较少表达,而在受损的肾小球、肾小管内表达增加。TGF-β1不仅能够抑制ECM降解,还能够诱导包括黏连蛋白在内的多种ECM成分表达并积聚在肾小球、肾间质内,引起肾小球硬化及肾间质纤维化[17-18]。Zhu等[19]的研究结果显示,姜黄素通过调控mTOR/Akt通路,下调TGF-β1表达,减缓EMT,在慢性肾脏病及肾移植中发挥肾脏保护作用。Ho等[20]研究发现,姜黄素可通过拮抗Wnt/β-catenin信号抑制TGF-β1诱导肾小管上皮细胞EMT,从而延缓糖尿病肾病间质纤维化的进展。本研究结果显示,氧嗪酸钾组TGF-β1表达量较其他组明显增强,其在肾小球、肾小管均强阳性表达;与氧嗪酸钾组比较,联合组TGF-β1表达明显减少,且联合组肾功能及肾间质纤维化程度较氧嗪酸钾组均明显好转,表明姜黄素可通过下调TGF-β1的表达而发挥肾脏保护作用。
普遍被认为NF-κB是许多细胞因子的关键调节因子,可以调控多种细胞因子如TNF-α、IL-6 的表达,从而在机体的炎症、免疫应答、细胞增殖、凋亡等方面发挥重要作用[3]。研究[21]表明:在糖尿病肾病大鼠模型中,姜黄素可通过下调P-300及NF-κB的表达,减轻肾间质炎症反应和肾组织纤维化。本研究结果显示,与对照组相比,氧嗪酸钾组NF-κB表达量增加,且以肾小管间质表达为主;联合组NF-κB表达明显减少,肾功能也较模型组模型改善,但UA水平无明显下降。本研究结果提示姜黄素可能通过减轻氧化应激调控NF-κB的表达,减轻肾脏炎症反应及肾组织纤维化。
近年来,姜黄素的在HUA的药理作用受到极大关注,Zhang等[22]研究发现在果糖引起的HUA大鼠模型中,姜黄素可能通过抑制JAK-STAT的激活及TGF-β1的过表达,上调肾脏NO水平,起到改善肾脏内皮功能障碍和提高尿酸转运蛋白能力,从而具有降UA及肾脏保护作用。Ao等[23]研究发现,姜黄素可通过抑制尿酸盐阴离子转运体1,促进UA排泄,从而有望成为新型的治疗痛风的药物。本研究结果显示,与氧嗪酸钾组相比,联合组UA值未见明显下降,差异无统计学意义,考虑可能与本实验周期短及样本量少有关,有待增大样本及延长实验周期进一步验证。
综上所述,单独应用氧嗪酸钾可成功建立HUA模型;HUA可上调 TGF-β1及NF-κB的表达,引起肾脏损伤;姜黄素具有抗氧化应激及炎症反应,可以通过下调TGF-β1和NF-κB的表达,发挥肾脏保护作用,为HUA的治疗提供新思路。
[1] ROMI MM, ARFIAN N, TRANGGONO U, et al. Uric acid causes kidney injury through inducing fibroblast expansion, Endothelin-1 expression, and inflammation[J]. BMC Nephrol, 2017, 18(1): 326
[2] HONG Q, YU S, GENG X, et al. High concentrations of uric acid inhibit endothelial cell migration via miR-663 which regulates phosphatase and tensin homolog by targeting transforming growth factor-β1[J]. Microcirculation, 2015, 22(4): 306
[3] 林章梅,张荣山,范晨雪,等.非布司他对高尿酸血症大鼠肾小管上皮间质转化及血清IL-6、转化生长因子β1的影响[J].中华内科杂志,2017,56(5):338
[4] GUIJARRO C, EGIDO J. Transcription factor-kappa B (NF-kappa B) and renal disease[J]. Kidney Int, 2001, 59(2): 415
[5] ZHOU Y, FANG L, JIANG L, et al. Uric acid induces renal inflammation via activating tubular NF-κB signaling pathway[J]. PLoS One, 2012, 7(6): e39738
[6] LIU H, XIONG J, HE T, et al. High uric acid-induced epithelial-mesenchymal transition of renal tubular epithelial cells via the TLR4/NF-κB signaling pathway[J]. Am J Nephrol, 2017, 46(4): 333
[7] ALI BH, AL-SALAM S, AL SULEIMANI Y, et al. Curcumin ameliorates kidney function and oxidative stress in experimental chronic kidney disease[J]. Basic Clin Pharmacol Toxicol, 2018, 122(1): 65
[9] MAZZALI M, HUGHES J, KIM YG, et al. Elevated uric acid increases blood pressure in the rat by a novel crystal-independent mechanism[J]. Hypertension, 2001, 38(5): 1101
[10]SANCHEZ-LOZADA LG, SOTO V, TAPIA E,et al. Role of oxidative stress in the renal abnormalities induced by experimental hyperuricemia[J].Am J Physiol Renal Physiol,2008,295(4):F1134
[11]CHOI YJ, YOON Y, LEE KY, et al. Uric acid induces endothelial dysfunction by vascular insulin resistance associated with the impairment of nitric oxide synthesis[J]. FASEB J, 2014, 28(7): 3197
[12]SANCHEZ-LOZADA LG, TAPIA E, SANTAMAra J, et al. Mild hyperuricemia induces vasoconstriction and maintains glomerular hypertension in normal and remnant kidney rats [J].Kidney Int,2005,67(1):237
[13]ASAKAWA S, SHIBATA S, MORIMOTO C, et al. Podocyte injury and albuminuria in experimental hyperuricemic model rats[J]. Oxid Med Cell Longev, 2017, 2017: 3759153
[14]AGGARWAL BB, SUNG B. Pharmacological basis for the role of curcumin in chronic diseases: an age-old spice with modern targets[J]. Trends Pharmacol Sci, 2009, 30(2): 85
[15]杨瑞凤,王建生,张宛哲, 等.活性维生素 D3对糖尿病大鼠肾脏 BMP-7及 TGF-β1表达的影响[J].郑州大学学报(医学版),2013,48(5):616
[16]徐静,易兰兰,张春虹, 等.二酯酰甘油-蛋白激酶C信号传导系统和细胞因子与糖尿病肾病的关系[J].西安交通大学学报(医学版),2006,27(2):168
[17]ZEISBERG M, DUFFIELD JS. Resolved: EMT produces fibroblasts in the kidney[J]. J Am Soc Nephrol, 2010, 21(8): 1247
[18]DERYNCK R, ZHANG YE. Smad-dependent and Smad-independent pathways in TGF-beta family signalling[J]. Nature, 2003, 425(6958): 577
[19]ZHU FQ, CHEN MJ, ZHU M, et al. Curcumin suppresses epithelial-mesenchymal transition of renal tubular epithelial cells through the inhibition of Akt/mTOR pathway[J]. Biol Pharm Bull, 2017, 40(1): 17
[20]HO C, HSU YC, LEI CC, et al. Curcumin rescues diabetic renal fibrosis by targeting superoxide-mediated Wnt signaling pathways[J]. Am J Med Sci, 2016, 351(3): 286
[21]CHIU J, KHAN ZA, FARHANGKHOEE H, et al. Curcumin prevents diabetes-associated abnormalities in the kidneys by inhibiting p300 and nuclear factor-kappaB[J]. Nutrition, 2009, 25(9): 964
[22]ZHANG DM, LI YC, XU D, et al. Protection of curcumin against fructose-induced hyperuricaemia and renal endothelial dysfunction involves NO-mediated JAK-STAT signalling in rats[J]. Food Chem, 2012, 134(4): 2184
[23]AO GZ, ZHOU MZ, LI YY, et al. Discovery of novel curcumin derivatives targeting xanthine oxidase and urate transporter 1 as anti-hyperuricemic agents[J]. Bioorg Med Chem, 2017, 25(1): 166
