新基因AY358935对B16细胞小鼠体内外生长的影响
2018-05-30熊绍权李亚玲王莉娟罗秋月宋婷婷李世杰何成诗
熊绍权,蔡 蕊,李亚玲,王莉娟,罗秋月,宋婷婷,丁 倩,李世杰,何成诗
1)成都中医药大学附属医院肿瘤科 成都 610075 2)成都中医药大学附属医院呼吸科 成都 610075
AY358935是本课题组利用交叉免疫学筛选获得的一个功能未知的新基因,相对分子质量为10 100,位于人类染色体11q12.3,包含2个外显子和1个内含子,由93个氨基酸组成,N末端含有一个由23个氨基酸残基组成的信号肽和一个短的跨膜片段,预测为小分子分泌蛋白[1]。前期生物信息学分析[2]发现,AY358935在癌组织中普遍表达,提示该基因可能在肿瘤发生发展中起重要作用。有关该基因的确切功能,目前国内外尚未见有文献报道。本研究首先构建了稳定转染小鼠AY358935(mAY358935)的B16细胞(B16-mAY),观察该细胞的体外增殖活性和小鼠体内成瘤情况,并检测B16-mAY细胞培养上清对人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)生长的影响,探讨其与肿瘤的可能关系,报道如下。
1 材料与方法
1.1主要试剂pCMV-Myc-mAY重组质粒由赵新宇博士友赠;兔抗人AY358935多克隆抗体由本实验室自制[2-3]。pcDNA3.1质粒、脂质体lipofectamine2000购自美国Invitrogen公司。MTT、DMSO购自美国Alnreseo公司。DAB显色试剂盒购自美国Vector Laboratory公司。辣根过氧化物酶标记的羊抗兔二抗和兔抗人β-actin抗体购自北京中杉金桥生物技术有限公司。BamHⅠ/XhoⅠ购自TaKaRa公司。G418、胎牛血清、胰蛋白酶和DMEM培养基原粉购自美国Gibco公司。明胶由迈新生物制剂有限公司提供。
1.2细胞模型B16-mAY的建立
1.2.1 AY358935真核表达质粒的构建 pCMV-Myc-mAY重组质粒的MCS位点克隆有mAY388935的完整cDNA编码区序列。以pCMV-Myc-mAY为模板进行PCR扩增,引物序列:上游5’-CGGGATC CATGGAGGTGGCTCGTA-3’,下游:5’-CCGCTCGAG TCATGCTGACCTGCCA-3’,退火温度60 ℃,循环35次。用BamHⅠ/XhoⅠ双酶切PCR产物和pcDNA3.1空载体并连接,构建真核表达质粒pcDNA3.1-mAY,重组质粒经双酶切和DNA测序鉴定。引物合成和DNA测序由上海英杰生物技术公司完成。
1.2.2 细胞转染及筛选、鉴定 B16细胞(购自美国ATCC)用DMEM(含体积分数10%胎牛血清,100 U/mL青霉素,100 mg/L 链霉素)于体积分数5% CO2、37 ℃孵箱中培养。将生长状态良好的细胞接种到6孔板,待细胞长至60%~70%时,用脂质体lipofectamine2000包裹pcDNA3.1-mAY进行转染,脂质体与质粒比例为2.5 μL1 μg。转染72 h后,换完全培养基并添加G418,筛选稳定转染株。传代培养2次,提取1×106个细胞的总蛋白,Western blot法检测mAY358935蛋白表达情况,蛋白表达良好者即为B16-mAY细胞,然后保种备用。G418筛选浓度为400 mg/L,维持浓度为200 mg/L。以pcDNA3.1空质粒转染细胞(B16-pcDNA3.1)和未转染细胞(B16)作对照。
1.3B16-mAY细胞体外增殖活性的观察采用MTT法检测细胞体外生长情况。将成指数期生长的B16-mAY、B16-pcDNA3.1以及B16细胞接种到96孔板培养,每孔2 000~3 000个细胞,每种细胞5个复孔,用200 μL DMEM培养基于37 ℃、体积分数5% CO2孵箱中培养。96孔板提前2 h用10 g/L明胶处理。从第2天开始,每天每孔加入20 μL MTT (5 g/L)孵育4 h,弃净培养基后,每孔加DMSO 150 μL,振荡10 min,用酶标仪测定490 nm波长处的吸光度(A),以此表示细胞增殖活性。连续测定6 d,每天测定1次,第3天换一次培养液。实验独立重复3次。以时间为横坐标,以吸光度为纵坐标,绘制细胞增殖曲线。
1.4B16-mAY细胞在小鼠体内成瘤情况的观察将成指数期生长的B16-mAY和B16-pcDNA3.1细胞用胰蛋白酶消化,1 500 r/min离心3 min后弃上清,用双无DMEM重悬细胞,洗净胰蛋白酶,再次离心,细胞沉淀用双无DMEM重悬,调整细胞密度为5×107mL-1。参照文献[4-5],选取6~8周龄的C57/BL6小鼠24只(雌雄各半,每只体重18~22 g,SPF级别,由四川大学实验动物中心提供,许可证号:SCXK<川>-09-2006),随机分为两组,每组12只,每只腹背皮下注射100 μL的B16-mAY或B16-pcDNA3.1细胞悬液。从第8天开始,用游标卡尺测量皮下肿瘤的长径和宽径,每隔1 d测量一次,直到有小鼠因肿瘤生长而出现死亡。参照文献[6-8]计算:肿瘤体积=0.52×长径×宽径2。断颈处死小鼠,取出瘤体,用中性福尔马林固定24 h,石蜡包埋、切片,HE染色,镜下观察。
1.5B16-mAY细胞培养上清对HUVEC生长的影响①将B16-mAY和B16-pcDNA3.1细胞于体积分数5% CO2、37 ℃孵箱中用DMEM培养,当细胞生长状态良好至70%~80%单层汇合时,换新鲜DMEM 10 mL培养,24 h后收集培养上清,分别命名为mAY上清和pcDNA3.1上清,4 ℃存放,2周内使用。将mAY上清用pcDNA3.1上清进行11、13稀释,分别得1/2mAY上清、1/4mAY上清。②临床采集脐带,参照文献[9-10]报道的规范方法分离HUVEC并培养5~7 d,细胞长满至80%~90%单层汇合时传代,取传2~4代的细胞用于实验[11]。将HUVEC细胞接种到96孔板,每孔1 000~2 000个,用100 μL DMEM(不含bFGF)于37 ℃、体积分数5% CO2孵箱中培养。96孔板提前2 h用10 g/L明胶处理。接种细胞第2天,换用制备好的上清(pcDNA3.1上清、1/2mAY上清、1/4mAY上清、mAY上清)继续培养,每组5个复孔,每孔加上清100 μL,48 h后分别更换相同上清100 μL。分离接种细胞第5天,MTT法测HUVEC增殖活性,方法同前。实验独立重复3次。
1.6统计学处理采用SPSS 21.0分析数据。3组细胞mAY358935蛋白表达水平、增殖活性的比较采用单因素方差分析;B16-pcDNA3.1和B16-mAY细胞移植瘤体积的比较采用重复测量数据的方差分析;4组HUVEC增殖活性的比较采用单因素方差分析;检验水准α=0.05。
2 结果
2.1B16-mAY细胞的鉴定pcDNA3.1-mAY经BamHⅠ/XhoⅠ双酶切后,产物大小280 bp,与mAY358935 ORF相符,见图1,测序结果提示正确。Western blot结果见图2,B16-mAY、B16-pcDNA3.1和B16细胞中mAY358935蛋白相对表达水平分别为(90.4±9.2)%、(39.6±3.9)%和(44.3±4.2)%,3组比较,差异有统计学意义(F=5.440,P=0.043),B16-mAY细胞中mAY358935蛋白相对表达水平最高(P<0.05),表明稳定转染mAY358935的细胞模型成功建立。
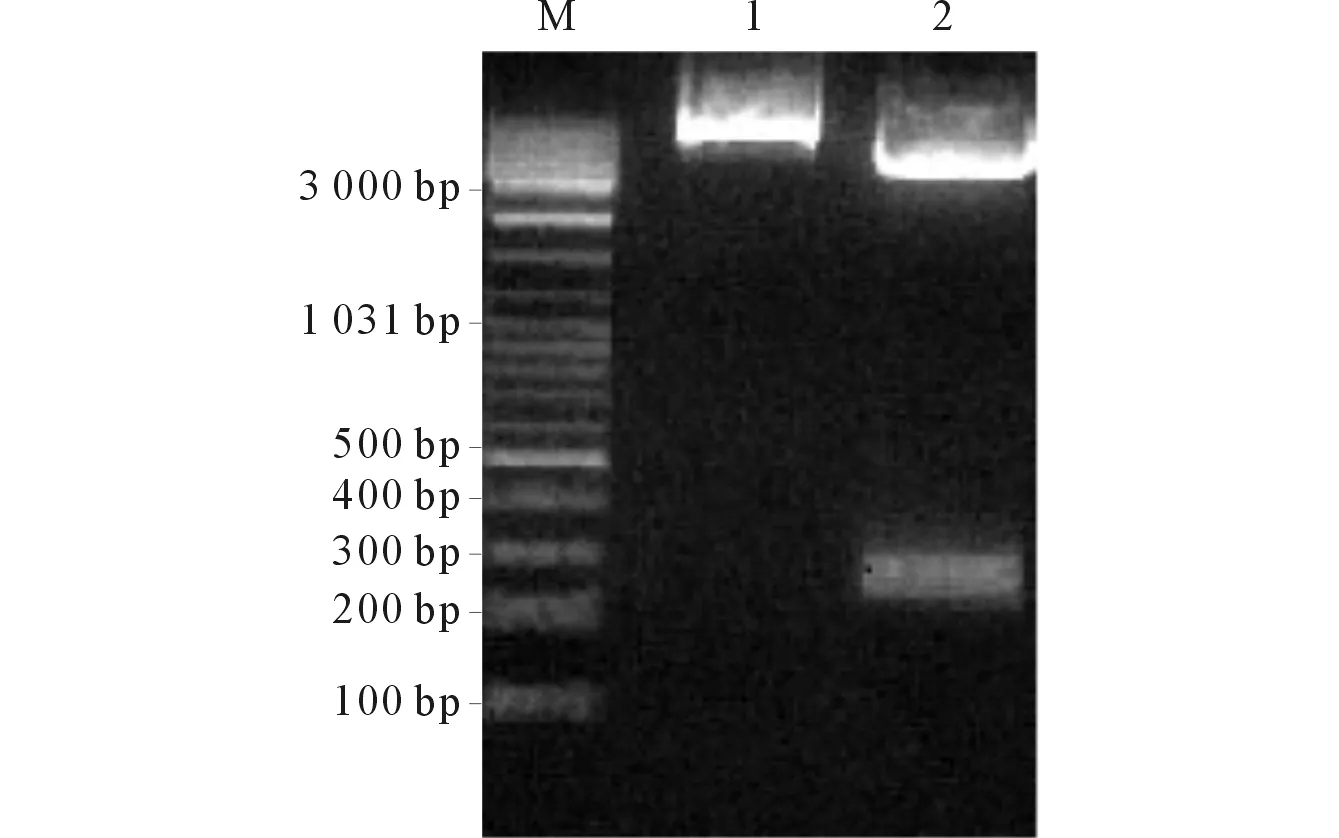
1:pcDNA3.1-mAY;2:pcDNA3.1-mAY酶切片段;M:DNA marker图1 pcDNA3.1-mAY的酶切鉴定

1:B16-mAY细胞;2:B16-pcDNA3.1细胞;3:B16细胞图2 3组细胞mAY358935蛋白的表达
2.2B16-mAY细胞的体外增殖活性B16-mAY、B16-pcDNA3.1和B16细胞的增殖曲线见图3。B16-mAY细胞体外生长良好。尤其在第6天时,B16-mAY、B16-pcDNA3.1和B16细胞组的吸光度值分别为(0.95±0.15)、(0.75±0.05)和(0.68±0.04),3组比较,差异有统计学意义(F=10.431,P=0.022),B16-mAY组明显高于其他两组(P<0.05)。
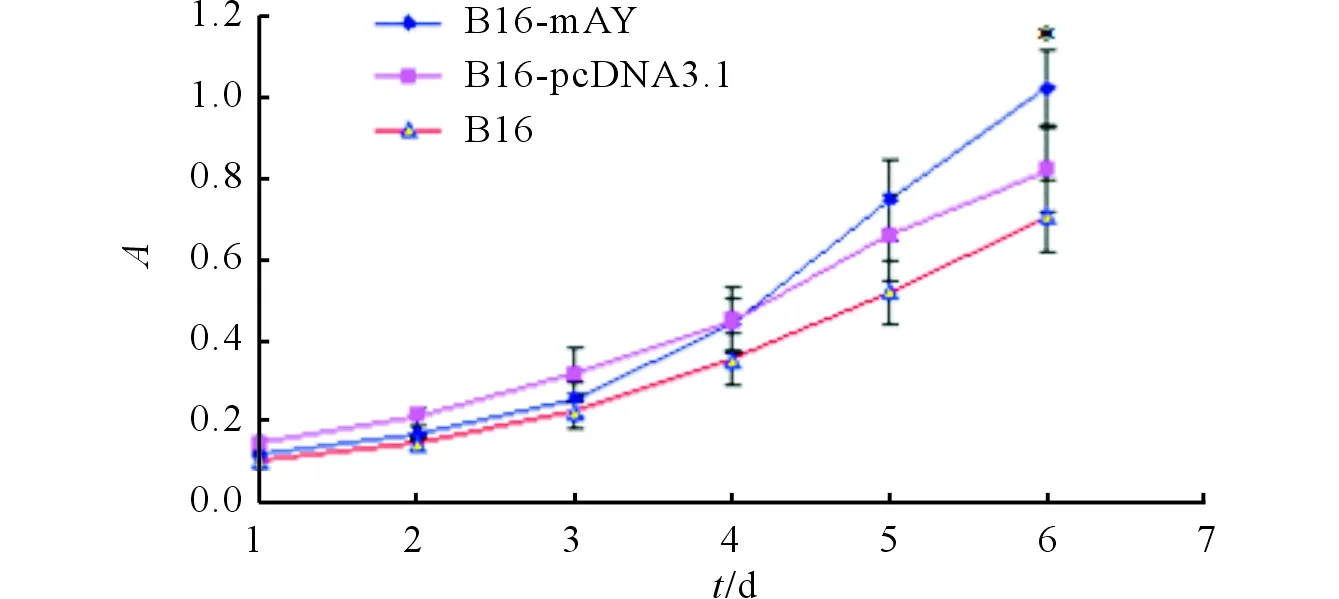
图3 3组细胞的增殖曲线
2.3B16-mAY细胞在小鼠体内的成瘤情况
2.3.1 肿瘤生长情况 两组小鼠移植瘤体积见表1。B16-mAY组移植瘤体积大于B16-pcDNA3.1组。

表1 各组移植瘤体积比较 cm3
F组别=6 647.359,F时间=549.615,F交互=437.975,P<0.001
2.3.2 肿瘤组织学表现 HE染色结果见图4,B16-mAY组移植瘤组织坏死区域明显较大;坏死肿瘤组织之间,特别是中心区域,出现岛状成活的肿瘤细胞,围绕肿瘤血管呈袖套样排列。B16-pcDNA3.1移植瘤组织相对坏死区域较少,且细胞坏死区域未发现存活细胞。
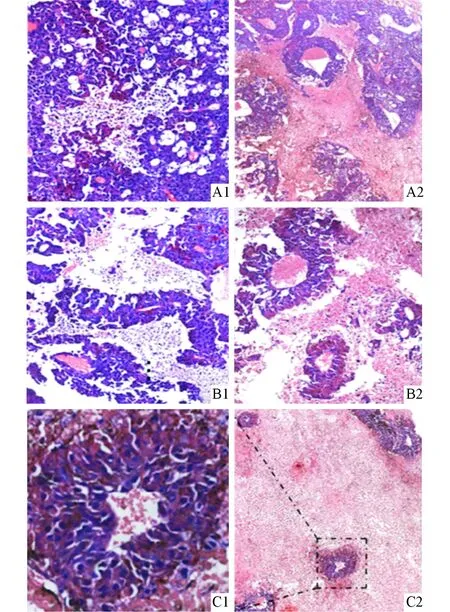
A1、B1:B16-pcDNA3.1(HE,×100);A2、B2、C2:B16-mAY(HE,×100);C1:C2图中放大区域(HE,×400)图4 B16-pcDNA3.1和B16-mAY细胞移植瘤组织学表现
2.4mAY上清对HUVEC增殖的影响pcDNA3.1、1/4mAY、1/2mAY和mAY上清组HUVEC的增殖活性分别为(0.36±0.06)、(0.43±0.08)、(0.61±0.09)和(0.89±0.10),4组比较,差异有统计学意义(F=7.958,P=0.035)。1/4mAY上清即可促进HUVEC增殖,1/2mAY和mAY上清促HUVEC增殖的作用更强(P<0.05)。
3 讨论
本研究利用pcDNA3.1-mAY稳定转染B16细胞,建立稳定表达AY358935的B16-mAY细胞模型。MTT法检测发现,B16-mAY细胞体外增殖活性明显高于B16-pcDNA3.1及B16细胞,提示AY358935可促进肿瘤细胞的体外生长。接着,我们将B16-mAY细胞接种到小鼠皮下观察成瘤情况,结果显示,B16-mAY接种组移植瘤的生长快于B16-pcDNA3.1接种组。进一步对肿瘤组织进行HE染色观察,结果显示,B16-pcDNA3.1组移植瘤组织坏死区域相对较小,属于中心性坏死,坏死区域中间没有发现肿瘤血管和存活细胞;而B16-mAY接种组移植瘤组织中出现较多大面积坏死,但坏死区域并非完全呈中心性,坏死区域中间可见散在的存活细胞,围绕肿瘤血管排列成袖套状。这提示AY358935可能促进了血管生长,进而有利于肿瘤细胞的存活和增殖。虽然我们多次对移植瘤组织进行CD31和CD34免疫组化染色,但显色结果不尽如人意,分析可能原因有黑色素的干扰,或者抗原性弱化,或者由于恶性黑色素瘤常以血管拟态形成等[12-13]。
为进一步探索mAY358935的促血管生长活性,本研究用不同稀释倍数的B16-mAY培养上清培养HUVEC,结果显示,稀释2倍后的B16-mAY培养上清即可促进HUVEC的生长,完全B16-mAY培养上清的作用则更加明显,这表明mAY358935基因具有促进血管内皮生长的作用。血管生成与肿瘤的发生发展密切相关,当肿瘤体积大于1 mm3时,其增长依赖新生血管供养供给[14-18],因而抗血管治疗成为近年来肿瘤治疗的重要策略之一[19]。本研究结果显示,AY358935基因具有促进血管内皮生长的作用,有可能成为抗血管治疗的重要靶点。
综上所述,本研究结果显示,AY358935基因具有促进肿瘤生长、促进血管生长的作用,可能是一个潜在的抗肿瘤干预靶点。
[1] XIONG SQ,YANG HS,CHEN YY,et al.Vascular endothelial cell antigen (VECA), a novel secreted protein: overexpression in Escherichia coli of the hexahistidine-tagged protein and production of polyclonal antibodies[J].Biotechnol Appl Biochem,2009,52(1):61
[2] 熊绍权,杨寒朔,龙奇达.新基因AY358935的生物信息学分析及功能预测[J].南方医科大学学报,2010,30(2):232
[3] YUAN Z,YAN F,WANG YS,et al.PNAS-4,a novel pro-apoptotic gene,can potentiate antineoplastic effects of cisplatin[J].Cancer Chemother Pharmacol,2009,65(1):13
[4] LI L,GRAUSAM KB,WANG J,et al.Sonic Hedgehog promotes proliferation of Notch-dependent monociliated choroid plexus tumour cells[J].Nat Cell Biol,2016,18(4):418
[5] BAKER M,REYNOLDS LE,ROBINSON SD,et al.Stromal Claudin14-heterozygosity,but not deletion,increases tumour blood leakage without affecting tumour growth[J].PLoS One,2013,8(5):e62516
[6] ZHUANG GF,TAN Y,YANG YZ,et al.Experiment research of cisplatin implants inhibiting transplantation tumor growth and regulating the expression of KLK7 and E-cad of tumor-bearing mice with gastric cancer[J].Asian Pac J Trop Med,2016,9(6):606
[7] LIU H,XU HW,ZHANG YZ,et al.Ursodeoxycholic acid induces apoptosis in hepatocellular carcinoma xenografts in mice[J].World J Gastroenterol,2015,21(36):10367
[8] CHANG L,HUO B,LV Y,et al.Ginsenoside Rg3 enhances the inhibitory effects of chemotherapy on esophageal squamous cell carcinoma in mice[J].Mol Clin Oncol,2014,2(6):1043
[9] DOAN CC,LE TL,HOANG NS,et al.Differentiation of umbilical cord lining membrane-derived mesenchymal stem cells into endothelial-like cells[J].Iran Biomed J,2014,18(2):67
[10]POLCHOW B,KEBBEL K,SCHMIEDEKNECHT GA,et al.Cryopreservation of human vascular umbilical cord cells under good manufacturing practice conditions for future cell banks[J].J Transl Med,2012,10:98
[11]LIU P,ATKINSON SJ,AKBAREIAN SE,et al.Sulforaphane exerts anti-angiogenesis effects against hepatocellular carcinoma through inhibition of STAT3/HIF-1α/VEGF signalling[J].Sci Rep,2017,7(1):12651
[12]CHUNG HJ,MAHALINGAM M.Angiogenesis,vasculogenic mimicry and vascular invasion in cutaneous malignant melanoma-implications for therapeutic strategies and targeted therapies[J].Expert Rev Anticancer Ther,2014,14(5):621
[13]LARSON AR,LEE CW,LEZCANO C,et al.Melanoma spheroid formation involves laminin-associated vasculogenic mimicry[J].Am J Pathol,2014,184(1):71
[14]HENDRIX MJ,SEFTOR EA,SEFTOR RE,et al.Tumor cell vascular mimicry: Novel targeting opportunity in melanoma[J].Pharmacol Ther,2016,159:83
[15]AFTAB BT,DOBROMILSKAYA I,LIU JO,et al.Itraconazole inhibits angiogenesis and tumor growth in Non-Small Cell Lung Cancer[J].Cancer Res,2011,71(21):6764
[16]CROCIANI O,ZANIERI F,PILLOZZI S,et al.hERG1 channels modulate integrin signaling to trigger angiogenesis and tumor progression in colorectal cancer[J].Sci Rep,2013,3:3308
[17]TRÉDAN O,LACROIX-TRIKI M,GUIU S,et al.Angiogenesis and tumor microenvironment: bevacizumab in the breast cancer model[J].Target Oncol,2015,10(2):189
[18]YANG Y,SUN M,WANG L,et al.HIFs,angiogenesis,and cancer[J].J Cell Biochem,2013,114(5):967
[19]YANG WH,JUN X,MU JB,et al.Revision of the concept of anti-angiogenesis and its applications in tumor treatment[J].Chronic Dis Transl Med,2017,3(1):33
