基于氮掺杂多孔碳及PoPD电化学免疫传感器的构建
2018-05-28高克孙昭曹凯航杨玉晓乔秀文李红玲齐誉叶邦策
高克,孙昭,曹凯航,杨玉晓,乔秀文*,李红玲,齐誉,叶邦策
(石河子大学化学化工学院/新疆兵团化工绿色过程重点实验室/省部共建国家重点实验室培育基地/材料化工新疆维吾尔自治区重点实验室,新疆 石河子 832003)
血清甲胎蛋白(AFP)作为一种功能性的癌胚糖蛋白[1],是目前唯一广泛应用于筛查和诊断原发性肝癌的肿瘤标志物[2]。在健康人血清中AFP浓度低于25 ng/mL,而在肝癌患者中会明显增加,因此,血清中AFP的检测在诊断中起着重要的作用,广泛用于肝癌患者的早期诊断[3]。免疫传感器由于其灵敏度高、特异性强的优点得到人们的广泛关注[4]。电化学免疫分析法和其它免疫分析方法[5,6]如酶联免疫吸附测定[7]和单径向免疫扩散测定法相比,因为它的便携性,低成本和高灵敏度的测量技术[8]诸多优点可以作为一种理想的检测分析方法。
多孔碳材料具有高比表面积、高孔隙率、良好的导电性、可控的孔径和表面性能在锂电池、催化剂载体等方面有很多潜在应用。氮掺杂能改变碳材料的电学性质,使多孔碳材料在很多方面的应用得到提高[9-11]。聚邻苯二胺是聚苯胺[12-13]的衍生物,它比聚苯胺所具有的氨基及亚氨基更多,可以提供更多的再生基团[14],在实际应用中功能性更强,是一种应用性前景较为广阔的一种聚合物材料。
本研究先将NC-CS[15]滴涂在电极表面,后通过电化学聚合邻苯二胺,从而制备了基于PoPD/NC-CS构建的甲胎蛋白免疫传感器。NC-CS的使用提高了聚邻苯二胺的电化学性质,使其呈现出较好的电化学活性。且利用壳聚糖[16]将NC固定在电极表面使其不易脱落,并且可以牢固的连接聚邻苯二胺,使其电活性很好的保持。
1 材料与方法
1.1 试剂与仪器
邻苯二胺购于 Sigma,乙二胺(C2H8N2)、乙酸、葡萄糖及壳聚糖(CS)购于国药集团(中国上海),磷酸二氢钠(NaH2PO4)、磷酸氢二钠(Na2HPO4)购于光复科技有限公司(中国天津),甲胎蛋白(AFP)购于赛博生物(中国郑州),牛血清白蛋白购于阿法埃莎(中国天津),铁氰化钾(K3[Fe(CN)6])、亚铁氰化钾(K4Fe(CN)6])、氯化钾(KCL)等均购于国药集团(中国上海);试验用水为去离子水,试剂均为分析纯。
化学实验采用三电极系统。工作电极为玻碳电极,对电极为铂丝电极,参比电极为饱和甘汞电极。
测试仪器主要采用Potentiontat/Galvanostst Model 283分析仪(Mattson,美国)、OTF-1200X开启式管式炉(合肥科晶)、TG 16G台式高速离心机(湖南凯达)、水热反应釜(上海鹏弈)、超声波清洗仪(昆山超声仪器)、PHS-3B 数字PH计(上海宏伊)、BSA224S分析天平(德国赛多利斯)、GZX-9140MBE型电热鼓风干燥箱(上海景洪)等。
1.2 NC-CS的制备
在38 mL去离子水中溶解16 g葡萄糖,随后滴入乙二胺2 mL并搅拌;将搅拌配置好的溶液置于高压反应釜内,180℃下水热6 h;反应结束后自然冷却至室温,将反应得到的产物离心水洗,分别利用去离子水以及无水乙醇洗涤至澄清,再将离心得到的产物烘干(80℃,过夜)后,在管式炉中活化(400℃,2 h),得到氮掺杂的多孔碳材料(NC)。
取1 mg纯化的NC超声分散到10mL含有CS(0.5%,wt)的乙酸溶液(1%,wt)中,得到 NC-CS 分散悬浮液。
1.3 免疫传感器的组装
先将金电极(GE)依次利用0.5 μm和0.05 μm的Al2O3悬浊液抛光至镜面,然后分别在无水乙醇及去离子水中超声清洗,晾干备用。将10 μL NC-CS滴在电极表面晾干;再将电极置于含0.01 mol/L邻苯二胺及0.1 mol/L硫酸的溶液中,利用电聚合法在电极表面聚合一层聚邻苯二胺,其中聚合条件为电位区间为0.3-1.3 V,扫描速率为50mV/s,扫描圈数30圈;在4℃下,电极依次在anti-AFP和BSA中浸泡12 h及2 h,得到GE/NCCS/PoPD/antiAFP电极;在不同浓度的AFP溶液中孵育30min后,存放于4℃下保存。
免疫传感器组装过程如图1所示。
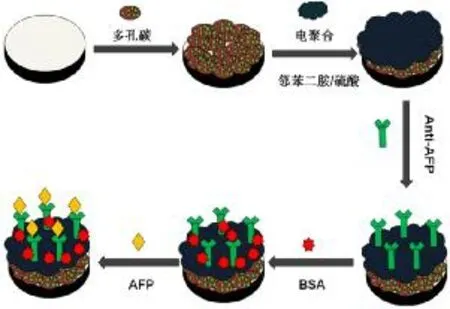
图1 免疫传感器的组装过程Fig.1 The fabrication progress of immunosensor
1.4 检测方法
本实验CV测试条件为:在含有0.1 mol/L KCl测的PBS溶液(pH=7.0)中测试,扫描电位区间为-0.9--0.1 V,扫描速率为50mV/s,孵育温度为30℃。
EIS测试条件为:pH7.0含 5.0mmol/L Fe(CN)6]3-/4-PBS缓冲液,频率为0.001 Hz-100 kHz。
2 结果与讨论
2.1 免疫传感器过程中的循环伏安表征
图2中,a是在裸电极表面聚合邻苯二胺所对应的循环伏安曲线,b是在电极表面修饰一层NC-CS后,再聚合一层聚邻苯二胺所对应的循环伏安曲线。
由图2可以看到:修饰NC-CS后再聚合聚邻苯二胺的峰电流值明显高于不修饰NC-CS的峰电流。这表明NC-CS的修饰可以提高聚邻苯二胺的电活性。

图2 多孔碳修饰对比Fig.2 Comparison of modified porous carbon
图3 是不同材料修饰电极表面后在0.1 mol/L PBS缓冲液中的循环伏安曲线。
由图3可知:
(1)GE电极的循环伏安曲线中无氧化还原峰出现(图 3a)。
(2)当NC-CS/PoPD修饰在电极表面后,出现了一对氧化还原峰(图3b)。这是由于电子媒介体被成功修饰到电极上。
(3)电极在不良导体anti-AFP及BSA溶液中浸泡后,峰电流出现明显降低(图3c、3d)。这是由于其不良导电能力阻碍了电子传递,致使电流值降低。

图3 电极修饰过程的循环伏安曲线Fig.3 CV of the different modified electrodes in 0.1 mol/L PBS solution(pH=7.0)
2.2 免疫传感器组装过程中的交流阻抗表征
图4是不同修饰电极的EIS。图4显示:
(1)裸电极出现高频率区明显小半圆及低频率区直线(图 4a)。
(2)当NC-CS修饰于电极表面后,出现了更小的半圆。这表明NC-CS表现出了良好的电子传导能力,并加速电子转移。
(3)当PoPD修饰于电极表面后,电阻明显增加(图 4c)。
(4)电极在anti-AFP及 BSA溶液中孵育后,高频区半圆依次增加(图4d、4e)。这是由于anti-AFP及BSA为不良导体能够阻碍电子转移。
(5)不同修饰电极的CV曲线及EIS表明,每一层材料成功被修饰于电极表面,完成免疫传感器的组装。

图4 电极修饰过程的交流阻抗谱图Fig.4 EIS of the different modified electrodes in 5.0mmol/L Fe(CN)63-/4-(pH=7.0)
2.3 免疫传感器的扫速
通过实验分析免疫传感器的扫描速率图,探讨该免疫传感器的电化学特性。图5是不同扫描速率对免疫传感器的影响,其中从内至外的扫描速率依次为 10、20、30、50、60、80、120、150、180mV/s。由图5可以看出:当扫描速率的平方根越大时,所对应的氧化还原峰电流值也会得到相应的增大,并呈现出良好的线性关系,如内插图所示。这表明该免疫传感器在测试底液中的氧化还原反应受扩散控制。

图5 PANI/PDA/anti-AFP修饰电极的循环伏安扫速图Fig.5 CVs of the proposed electrodes at different Scan rates
3 性能测试实验
3.1 实验条件的优化
检测液的pH值对抗体、抗原活性以及电活性物质有很大的影响。测试实验考察pH 5.0-8.0范围内PBS缓冲液中免疫传感器响应电流变化(图6a),发现所制备的免疫传感器在pH 7.0的缓冲液中时所对应的响应电流值最大。故将免疫传感器的检测液pH值选定7.0。
免疫结合反应完全的程度与抗原抗体孵育时间有很大关系(图6b)。在本实验中,NC-CS/PoPD/anti-AFP/BSA制备的免疫传感器,随着孵育时间的增加相对应的峰电流相应增加,30min后,峰电流趋于稳定,表面anti-AFP和AFP的免疫反应趋于平衡。最佳孵育时间选定为30min。
孵育温度对抗原抗体的充分结合影响明显(图6c),孵育温度为30℃时,峰电流值达到最大。
综上所述,优化实验条件选定为:pH 7.0,孵育时间30min,孵育温度30℃。
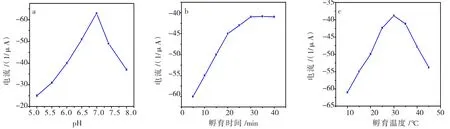
图6 免疫传感器的条件优化Fig.6 The optimization of detection conditions:pH of detection solution(a),incubation time(b),and incubation temperature(c)on the peak current of CVs.above detections in 0.1 mol/L PBS containing 0.1 mol/L KCl,Scan rate:50mV/s
3.2 免疫传感器的线性范围和检测限
基于NC-CS/PoPD/anti-AFP/BSA构建的电化学免疫传感器在含0.1 mol/L KCl的0.1 mol/L PBS溶液(pH=6.5)中进行CV测定,AFP浓度从外向内为0.01-80 ng/mL,结果如图7所示。由于抗原抗体发生特异性结合反应,阻碍电子传递,所对应的峰电流浓度随着抗原浓度增加而降低(图7)。可以得到此免疫传感器的线性范围为0.005-100 ng/mL,线性方程为y=8.703logCAFP+21.93,R2=0.9921,检测限为0.0006 ng/mL。

图7 不同浓度下免疫传感器的循环伏安谱图Fig.7 CVs of different concentration of AFP in PBS solution(pH=7.0)
3.3 免疫传感器的重现性、稳定性和选择性
本实验分别探讨该免疫传感器的重现性、稳定性及选择性。
先在最优条件下对相同浓度的溶液进行检测,响应电流值的相对标准偏差小于3.8%(n=5);再制备好免疫传感器之后,对免疫传感器进行连续扫描90圈于pH为6.5的缓冲液中,与初始电流相比,峰电流仅下降2%;最后把制备的电化学免疫传感器保存在缓冲液的上方,保存条件为pH7.0、温度4℃,每隔3天对同一传感器进行测定,30天后免疫传感器的响应电流值下降了5%。上述结果(图8)表明该免疫传感器具有较好的重现性和稳定性。
免疫传感器的选择性是衡量其抗干扰能力和特异性的重要指标。本实验中,将制备好的免疫传感器放入浓度为1 ng/mL的AFP抗原溶液和含干扰物质的80 ng/mL的AFP抗原溶液中,孵育20min,采用循环伏安法检测并记录峰电流。加入溶液中的干扰物质有牛血清白蛋白(BSA)及癌胚抗原(CEA)、多巴胺(DA)。
结果(图8)表明:两者的响应电流值无明显差异,测量误差小于3.2%。说明该免疫传感器具有较好的选择性。
4 结论
(1)成功构建了基于氮掺杂多孔碳及PoPD构建的的无标记电流型AFP免疫传感器。
(2)氮掺杂多孔碳具备良好的生物相容性,提高了PoPD的电化学活性。
(3)聚邻苯二胺的氨基及亚氨基可以固载更多的anti-AFP,从而提高电化学免疫传感器的性能。
[1]Wang H,He L,Zhang Y,et al.Label-free immunosensor based on Pd nanoplates for amperometric immunoassay of alpha-fetoprotein[J].Biosensors& Bioelectronics,2013,53C(6):305-309.
[2]Zhou H,Gan N,Li T,et al.The sandwich-type electrochemiluminescence immunosensor for α-fetoprotein based on enrichmentby Fe3O4-Au magnetic nano probes and signal amplification by CdS-Au composite nanoparticles labeled anti-AFP[J].Analytica chimica acta,2012,746:107-113.
[3]王知.甲胎蛋白生物传感器的制备和研究[D].苏州:苏州大学,2009.
[4]And E C,C J C.A Novel Self-Assembled Nanoparticulate Film for Covalent Attachment of Antibodies to Plastic[J].Langmuir,2003,19(10):4509-4511.
[5]Lin J,Ju H.Electrochemical and chemiluminescent immunosensors for tumor markers[J].Biosensors&Bioelectronics,2005,20(8):1461-1470.
[6]Bahadr E B,Sezgintürk M K.Applications of electrochemical immunosensors for early clinical diagnostics[J].Talanta,2015,132:162-174.
[7]Loomans E E M G,Roelen A J M,Van Damme H S,et al.Assessment of the functional affinity constant of monoclonal antibodies using an improved enzyme-linked immunosorbent assay[J].Journal of Immunological Methods,1995,184(2):207-217.
[8]Li Q,Zeng L,Wang J,et al.Magnetic Mesoporous Organic Inorganic NiCo2O4Hybrid Nanomaterials for Electrochemical Immunosensors[J].Acs Appl mater interfaces,2011,3(4):1366-1373.
[9]Kroto H W,Heath J R,O'Brien S C,et al.C60:Buckminsterfullerene[J].Nature,1985,318(6042):162-163.
[10]Orikasa H,Akahane T,Okada M,Tong Y,Ozaki J-i,Kyotani T.Electrochemical Behavior of Carbon Nanorod Arrays Having Different Graphene Orientations and Crystallinity[J].J Mater Chem,2009,19(26):4615-4621.
[11]Sun X,Li Y.Colloidal Carbon Spheres and Their Core/Shell Structures with Noble-Metal Nanoparticles[J].Angew Chem Int Ed,2004,43:597-601.
[12]黄维垣.高技术有机高分子材料进展[M].北京:化学工业出版社,1994.
[13]Qiu J D,Huang H,Liang R P.Biocompatible and label-free amperometric immunosensor for hepatitis B surface antigen using a sensing film composed of poly(allylamine)-branched ferrocene and gold nanoparticles[J].Microchimica Acta,2011,174(1-2):97-105.
[14]Xiao S,Zheng C,Liang L,et al.One-Pot Synthesis and Catalyst Support Application of Mesoporous N-Doped Carbonaceous Materias[J].J Mater Chem,2012,22(24):12149-12154.
[15]Zhen Y L,Guo X Z,Zhi Y L,et al.One-Step Scalable Preparation of N-doped Nanoporous Carbon as High-Performance Electrocatalysts for Oxygen Reduction Reaction[J].Nano Res,2013,6(4):293-301.
[16]Ghalkhani M,Shahrokhian S.Application of carbon nanoparticle/chitosan modified electrode for the square-wave adsorptive anodic striping voltammetric determination of Niclosamide[J].Electrochemistry Communications,2010,12(1):66-69.
