重组人Neuritin蛋白的简易纯化、鉴定及应用
2018-05-28王娜董洪昌黄瑾
王娜,董洪昌,黄瑾
(石河子大学医学院生化教研室/新疆地方与民族高发病教育部重点实验室,新疆 石河子 832002)
Neuritin是众多神经营养因子中的一个,又被称为神经可塑性相关蛋白CPG15,位于人类六号染色体 6p24-p25[1],其开放阅读框为 426 bp,共编码 142个氨基酸,第28-115号氨基酸残基为Neuritin发挥生物学活性的关键片段[2]。
随着研究的深入,Neuritin在多个领域的重要性不断凸显。Neuritin在神经领域的功能已被证实,Neuritin促进神经元突起生长、神经元分支和突触成熟、调节突触回路形成,并且是唯一维持细胞存活的神经营养因子[3-5]。Neuritin与神经损伤修复密切相关,报道显示,重组人Neuritin(recombinant human Neuritin,rhNeuritin)能促进大鼠坐骨神经损伤、脊髓损伤及功能恢复[6-7]。此外研究发现,Neuritin在促进细胞迁移、分化、抑制细胞凋亡、促进血管生成等方面具有其独特作用[8-9]。深入研究Neuritin的功能,对于神经领域、肿瘤以及糖尿病等疾病的治疗具有重要意义[10]。
分别对2辆货车在1127轴型下的通行记录进行整理并作可视化处理,可得到对比曲线见图3。由图3可知:正常轴型货车(车牌为PF5168)的轴重载荷曲线与参考曲线基本上一致;当疑似假轴货车(车牌为CR2721)被判定为1127轴型车辆时,其轴重载荷曲线与参考曲线差别较大,很容易判别出该货车与正常的1127轴型货车不同,稽查人员可以此为参考,对该货车进行拦截和查验,核实后依法进行处理。由此可证明,将轴重载荷曲线作为疑似假轴车辆的判别曲线具有一定的参考价值。
制备并纯化具有生物活性的Neuritin重组蛋白,是进行Neuritin相关的生物学功能和机制研究的重要基础。纯化的重组人Neuritin(recombinant human Neuritin,rhNeuritin)在功能及机制研究中都有十分良好的应用[6-7,11]。因此,通过简易、有效的Neuritin蛋白纯化方法,获得实验环节中所需的rhNeuritin并对其进行鉴定,对于实验研究是至关重要的基础。本研究,采用简易的手动纯化方法,对毕赤酵母中获得的rhNeuritin进行纯化,并对其纯度、生物学活性及免疫原性进行分析,证实本研究简易纯化方法具有可行性,对今后的实验研究发挥非常重要的作用。
活性炭一般为粉末状或颗粒状,具有密集的多孔结构、较大的内表面积,因此具有良好的吸附性能,尤其对苯系等大分子气体的脱除效果显著。活性炭作为吸附剂可以处理大风量、低浓度的VOCs气体,常温下即可应用,运行费用较低,并且净化效率高,因此应用最为广泛。
1 材料与方法
1.1 材料
1.1.1 菌株、细胞株
96孔板每孔加入0.01 mg/mL多聚赖氨酸,37℃,5%CO2培养箱中包被过夜,24 h后用无菌双蒸水清洗后晾干备用。待PC12细胞传两代生长状态稳定后用培养基 (85%RMPI1640+10%HS+5%FBS+100U链、青霉素)调整细胞浓度以1×104个/孔传代至多聚赖氨酸包被过的96孔板中。待PC12细胞在96孔板贴壁生长6-8 h后,弃去培养基,加入含有500 ng/mL rhNeuritin完全培养液;阴性对照组中加含有500 ng/mL His蛋白的完全培养液,空白对照组加入等量的PBS,将96孔培养板置于37℃、5%CO2培养箱中培养。加入蛋白以后每日观察PC12细胞突起生长状况,第4 d在倒置相差显微镜下观察并对其拍照。
1.1.2 仪器与试剂
纯化的rhNeuritin免疫SD大鼠,心脏取血,离心收集的血清即抗血清。用Western Blot的方法鉴定抗Neuritin抗血清制备(图 4a),以未免疫前的SD大鼠血清作为阴性对照血清(图4b),市售的Neuritin多克隆抗体做阳性对照(图4c)。经实验验证,抗血清能有效结合rhNeuritin及细胞内源性 Neuritin(图 4),约在11 Kd及16 Kd处检测出目的条带(图中箭头所指)。以上结果提示:本研究中采用手动纯化方法获取 rhNeuritin纯度为 92%,rhNeuritin可有效的引起SD大鼠免疫反应,具有良好的免疫原性并免疫获得了具有与Neuritin特异性结合的多克隆抗体。
1.2 方法
1.2.1 重组人Neuritin的诱导表达与盐析
所以,在校长和家长的认识中,不排除“踢好足球,上名大学”的动机,但是就校长而言,他们更多的想法是响应国家号召,执行国家政策,丰富校园文化生活,提高学校知名度。就家长而言,他们更多的想法是让孩子参与校园足球,促进孩子身心健康,让孩子有一项体育特长,进而养成终身体育的意识。而家长的这一认识恰好契合了校园足球改革的本初含义。
1.2.2 重组人Neuritin表达蛋白的简易纯化策略
贴壁生长的PC12细胞,分别加入含500 ng/mL His蛋白、rhNeuritin蛋白和等量PBS的完全培养液进行培养,隔天换液,连续培养4 d后,观察并对细胞进行拍照,并统计数据。每组随机选取5-10个视野,且每个视野中总细胞个数约在100个细胞,计数视野中的所有细胞数目(不计团块中不易计数的细胞),再计数每个视野中长出突起的细胞个数,阳性细胞比例即视野中长出突起细胞个数与视野中总的细胞数目的比值。对计数资料进行卡方检验分析,P<0.01为极显著性差异。本研究中,PBS培养组未见细胞有明显突起生长,阳性细胞在总的细胞中占比11.4%(图3a);His蛋白培养组未见明显的细胞突起生长,阳性细胞在总的细胞中占比14.59%(图 3b);500 ng/mL rhNeuritin培养组可见明显的细胞突起生长,阳性细胞在总的细胞中占比 41.76%(图 3c),rhNeuritin培养组与空白对照组和阴性对照组分别进行卡方检验分析,统计结果为 =0(P<0.01),即明确了rhNeuritin对促进PC12细胞突起生长具有良好效果。统计结果显示,rhNeuritin培养组细胞突起生长相较于PBS空白组和His蛋白阴性组均有极显著性差异(图3d),也证实本研究中的纯化方法未影响rhNeuritin的生物学活性;空白组与阴性组经统计学卡方检验分析,=0.4(p >0.05),两组间无统计学意义上的差异,明确了His tag对PC12细胞突起生长不产生任何作用。以上实验结果,在统计学理论分析的基础上,提示:rhNeuritin蛋白有效促进PC12细胞突起生长的生物学活性;本研究中所采用的纯化方法不影响rhNeuritin蛋白的生物学活性。因此,采用本研究中手动纯化获取rhNeuritin具有可行性。
将GS115/pPIC9K- 菌株由-80℃冰箱取出,用接种环挑取适量至3 mL YPD液体培养基。30℃,220 r/min,培养至菌液稍有浑浊。用接种环蘸取菌液“Z”字划线至含 0.5mg/mL G418的YPD平板,30℃恒温培养至单克隆菌株长出。在新的含0.5mg/mL G418 YPD培养平板底部,用记号笔划线均匀分格,用接种环挑取单克隆菌株接种点至小格区域,培养平板用封口膜封口,置于30℃恒温培养。待单克隆长出后,用接种环挑取单克隆菌株于 20mL YPD液体培养基,30℃,220 r/min恒温培养16 h,将菌液按1∶100体积比转接于BMGY培养基,30℃,220 r/min培养。培养18 h后,使用分光光度计测量,将 OD600nm为 2-6的菌液,6000 r/min,5min分批离心。菌体转入对应体积BMMY培养基中,30℃,220 r/min培养,每24 h补加1次甲醇,使其终浓度保持为1%,诱导72 h后,将 BMMY培养基4℃,14000 r/min,30min分批次离心,弃去沉淀,收集上清。称取(NH4)2SO4加入上清蛋白液中使其饱和度为65%,同时加入1 mmol/L DTT,4℃过夜。盐析后的蛋白液4℃,14000 r/min,30min离心收集沉淀,并用40mL溶解buffer重悬沉淀,0.22 μm滤膜过滤。
1.2.3 重组人Neuritin纯化蛋白的SDS-PAGE及Western Blot鉴定
收集的蛋白样经15%SDS-PAGE电泳分离,恒压83V 30min后,转换至恒压113V 90min。电泳结束后考马斯亮蓝R-250室温染色2 h,脱色至清晰可见,Bandscan扫描。Western Blot检测蛋白经SDS-PAGE电泳分离,23 V,43 min将蛋白转至硝酸纤维素膜(NC)上,膜用5%脱脂奶粉室温封闭2h,加入1∶500稀释比的Neuritin抗体,4℃孵育过夜后,0.02%TBST洗涤NC膜1次×5min/次,3次×10min/次,加入1∶5000稀释比的辣根过氧化物酶标记的山羊抗鼠IgG二抗,37℃孵育2 h,洗涤NC膜1次×5min/次,3次×15min/次,最后用发光试剂显色并曝光。
1.2.4 重组人Neuritin纯化蛋白的生物学活性鉴定
GS115/pPIC9K- 菌株由本实验室构建并保存于-80℃[12];PC12细胞株购自中国科学院典型培养物保藏委员会细胞库;Sprague-Dawley(SD)大鼠购自新疆医科大学。
文化元素在高校导视系统设计中的应用具有极其重要的作用,因此,在进行导视系统的设计工作中,我们不但要充分的体现出其功能性,也要更好的体现出校园的文化魅力以及深厚底蕴,进而将校园的文化特色更好的表现出来,将艺术与功能完美结合,体现出现代高校所倡导的时代精神以及治学思想,使高校的校园文化以及思想内涵得到有效的传播。
1.2.5 重组人Neuritin纯化蛋白在多克隆抗体的制备中应用
雄性壮年健康SD大鼠2只,大鼠乙醚麻醉。取1 mg rhNeuritin蛋白(1mL)与等体积的完全弗式佐剂(FAC)混合。首次免疫使用2 mL完全佐剂乳化的蛋白,背部皮下散点注射。首次免疫后的第3 d,进行第二次免疫,免疫佐剂使用“弗氏不完全免疫佐剂(FAIC)”。第二次免疫后的第25 d进行第三次免疫,方法同前。末次免疫1周后采血,大鼠在采血前一天禁食。将大鼠麻醉后仰面固定于固定架上,采用心脏取血法获取全血血液样本,获取的血液立即注入灭菌的EP管中,置于37℃温箱大约1 h,待血液完全凝固后,4 ℃,3000 r/min,15min,弃沉淀保留上清,即获得抗血清。
2 结果与分析
2.1 重组人Neuritin简易纯化策略图示
本研究通过SDS-PAGE检测rhNeuritin的诱导表达和纯化(图2a),经诱导的毕赤酵母表达系统表达出rhNeuritin,分子量约11 Kd处出现目的条带。纯化结果显示,流出液中主要是不含rhNeuritin的杂蛋白。70mmol/L咪唑洗脱液对介质蛋白复合物洗脱时,有少量rhNeuritin及杂蛋白被洗脱。300mmol/L咪唑洗脱液洗涤蛋白介质蛋白复合物,rhNeuritin被洗脱,分子量约11 Kd处有明显条带且在约22 Kd处(图中箭头所指)存在少量二聚体。相同的实验条件下,利用Neuritin抗体进行Western Blot检测,NC膜条带显示,特异性结合的蛋白条带出现,分子量约11 Kd(图中箭头所指),即为Neuritin条带,且300mmol/L咪唑洗脱液的实验组中rhNeuritin含量高,图为曝光过度的NC膜条带,包含大量的rhNeuritin和少量的rhNeuritin二聚体(图2b),针对纯化鉴定结果 SDS-PAGE图做灰度值扫描。未纯化时,rhNeuritin占总蛋白比例为56%左右,混有较多的非Neuritin蛋白;经70mmol/L咪唑的洗脱液,含有300m mol/L 咪唑洗脱液洗涤rhNeuritin,收集并浓缩后鉴定结果显示:纯化后rhNeuritin占洗脱蛋白的92.55%,提示纯化的rhNeuritin蛋白纯度可达到 92%以上(图 2c),证明本研究中手动纯化的可行性。
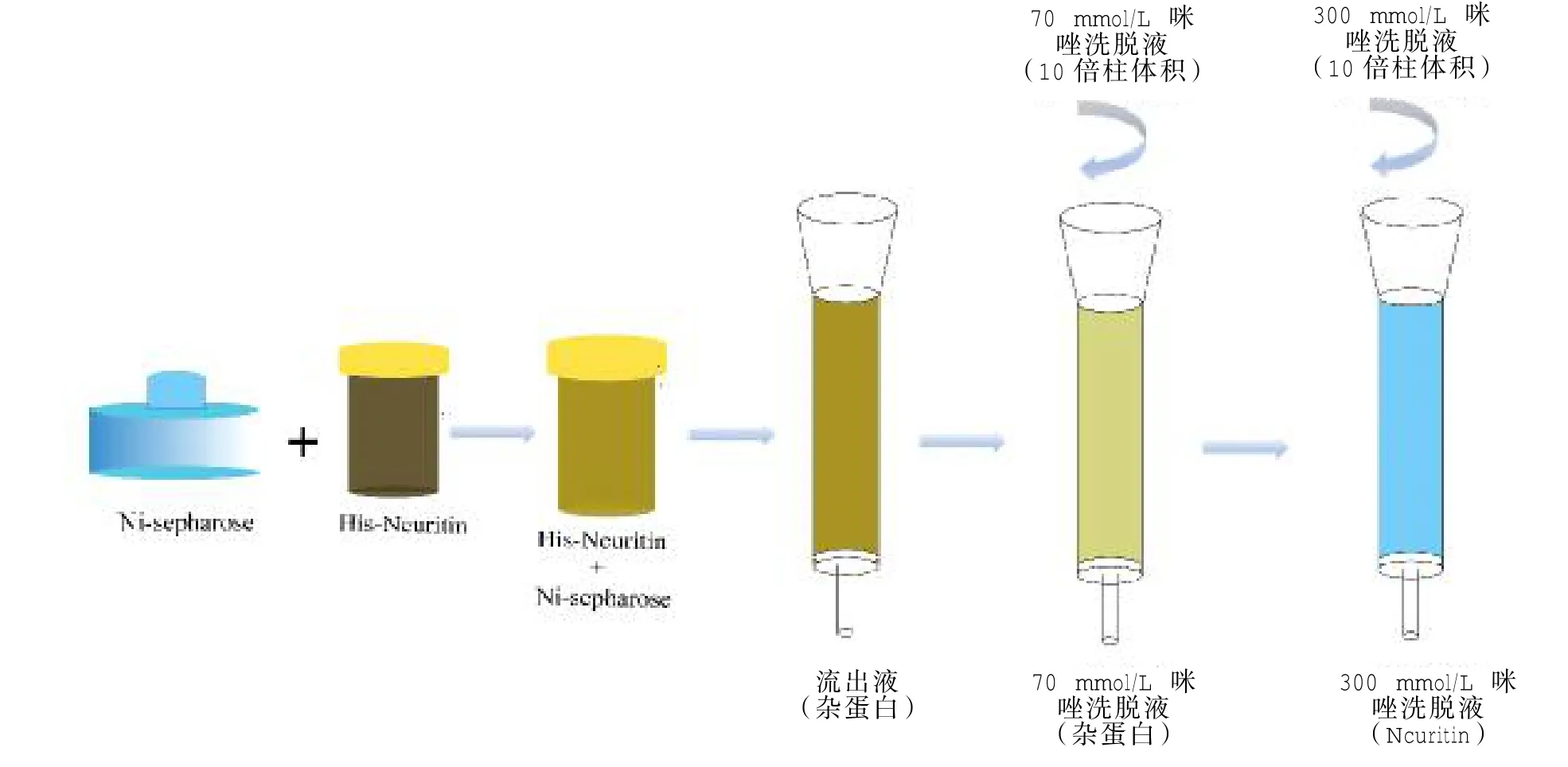
图1 重组人Neuritin简易纯化方法图示Fig.1 The sample purification of rhNeuritin
2.2 重组人Neuritin的诱导表达及纯化鉴定
将未纯化的蛋白液与Ni介质混合,4℃结合2 h后,将Ni介质与蛋白混合液加入带有滤膜的空柱中,收集流出液;rhNeuritin带有His标签易与Ni2+结合,由于咪唑竞争性的与Ni进行结合,根据咪唑浓度大小,选取含有70、300mmol/L咪唑的洗脱液分别对柱中介质进行清洗,洗脱液体积为介质体积的10倍,分别收集各洗脱液,分离获得目的蛋白(图 1)。
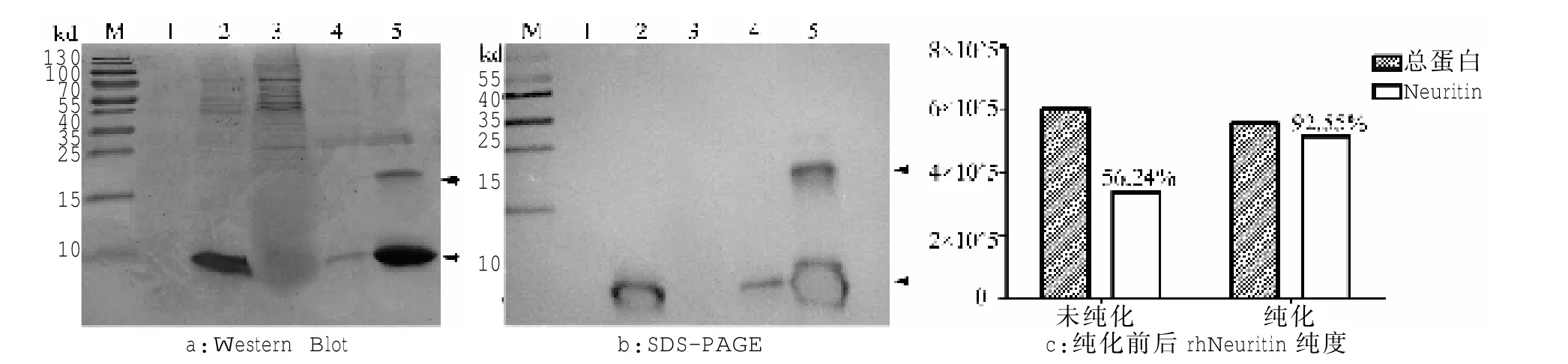
图2 重组人Neuritin表达、纯化及鉴定Fig.2 The expression,purification,and identification of rhNeuritin
2.3 重组人Neuritin纯化蛋白的生物学活性鉴定
将Ni sepharoseTM介质重悬混匀后,用移液器吸取6 mL于层析柱空柱中,待储存介质的20%乙醇流出,加Ni介质5倍体积的过滤水冲洗介质,待水流出。加5倍体积溶解buffer平衡Ni介质,待溶解buffer流出,用2 mL溶解 buffer重悬Ni介质,将介质加入过滤后的的蛋白液中,4℃旋转结合2 h。将介质与蛋白混合物移至空柱,并收集流出液,流出的前5mL中取样鉴定;用10倍体积洗脱buffer 1洗涤Ni介质蛋白复合物,流出前5mL中取样鉴定;用10倍体积洗脱buffer 2洗涤Ni介质蛋白复合物,流出前5mL中取样鉴定。Neuritin蛋白洗脱液超滤浓缩后,用0.1 mol/L PBS稀释 10倍,再超滤、浓缩,分装冻存于-80℃备用。
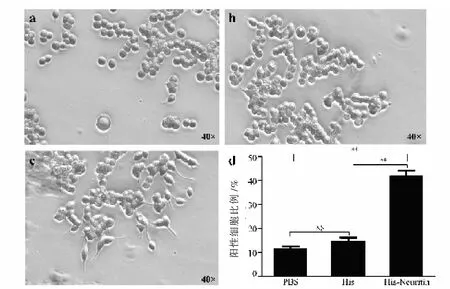
图3 重组人Neuritin蛋白的生物学活性鉴定Fig.3 The biological activity of rhNeuritin
2.4 重组人Neuritin纯化蛋白在多克隆抗体的制备中的应用
Ni Sepharose TM highperformance购自GE公司;Olympus Microscope Digital Camera显微镜;亲和层析纯化空柱、电泳仪均购自BIO-RAD公司;离心超滤管购自 Millipore公司;RMPI 1640培养基购自Gbico公司;多聚赖氨酸购自SIGMA公司;酵母提取物和胰蛋白胨购自 Oxide公司;酵母氮源(YNB)和G418均购自 Invitrogen公司;YPD、BMGY 和 BMMY培养基配方见Invitrogen公司提供的毕赤酵母操作手册;NC膜购自 Whatman公司;Neuritin抗体购自Abcam公司,山羊抗鼠IgG-HRP购自中衫金桥公司;化学发光试剂盒购置Millipore公司;96孔板购自Coaster公司;蛋白分子量Marker购自Thermo公司;溶解buffer(10mmol/L磷酸一氢钠、10mmol/L磷酸二氢钠、0.5mol/L氯化钠、20mmol/L咪唑,pH 7.4);洗脱 buffer 1(10m mol/L磷酸一氢钠、10mmol/L磷酸二氢钠、0.5mol/L氯化钠、70mmol/L咪唑,pH7.4);洗脱 buffer 2(10mmol/L磷酸一氢钠、10m mol/L磷酸二氢钠、0.5 mol/L氯化钠、300mmol/L咪唑,pH7.4);不完全弗氏佐剂(FAC)、完全弗氏佐剂(FAIC)购自Thermo公司;高压灭菌锅购自HIRAYAMA公司;离心管购自Millipore公司;Neuritin多克隆抗体购自Abcam公司;其他试剂均为国产或进口分析纯。
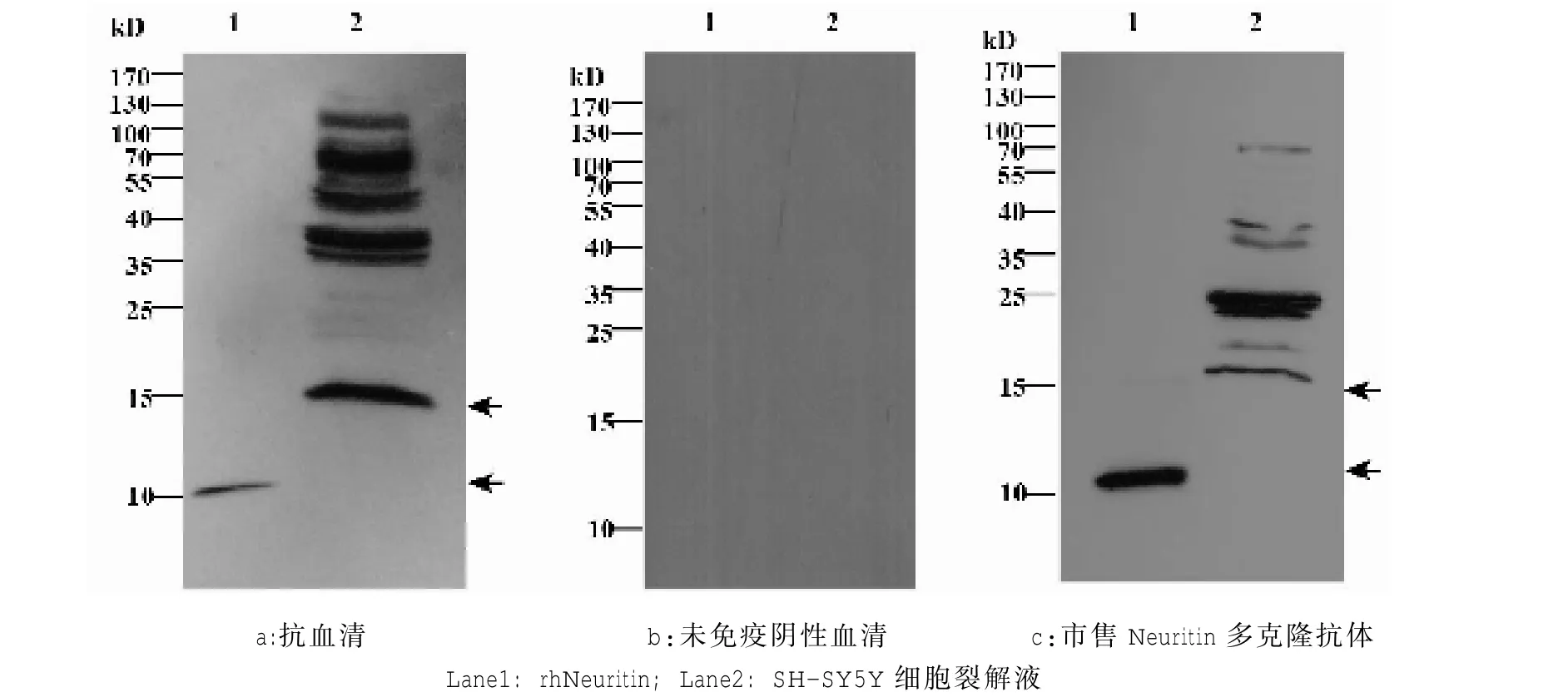
图4 重组人Neuritin蛋白抗血清的鉴定Fig.4 Identification of antiserum against Neuritin
3 讨论
重组人Neuritin蛋白纯化的方法及条件在我们的前期的研究中已基本确立[12]。基于前期采用GE Healthcare公司AKTA纯化系统对重组人Neuritin蛋白的线性纯化结果,本研究优化了纯化步骤,获得了纯度为92%以上的Neuritin重组蛋白。在AKTA纯化结果的基础上,针对杂蛋白及His标签的Neuritin蛋白的洗脱液咪唑浓度进行优化,用70mmol/L咪唑的buffer1洗脱杂蛋白,用300mmol/L咪唑的buffer2洗脱目的蛋白,仅用两步获得了较高纯度的Neuritin重组蛋白。该方法简易、有效、可节省成本、不受柱体积限制可用于各种剂量的蛋白纯化、不受设备限制,且在纯化过程中使蛋白与层析介质充分混合和洗脱,提高了亲和层析的效果,缩短了实验时间,减低了纯化蛋白降解的可能。
(四)1761年—1771年,亦即渥巴锡执政时期,由于沙皇俄国控制空前加剧而造成汗国严重政治危机。土尔扈特人反抗压迫在渥巴锡领导下举族东归祖邦,持续一个半世纪之久的土尔扈特汗国走向瓦解。留居伏尔加河流域的杜尔伯特牧民和少量土尔扈特人、和硕特人大约4700余帐,全部归入阿斯特拉罕省长办公室下设的专门管理机构——“特别管理处”管辖,1797年俄国政府在阿斯特拉罕成立“卡尔梅克公署”,留居伏尔加河流域的卡尔梅克人已失去了政治独立,沦为俄国政府监督下的俄罗斯帝国的一个行政区域。
然后,我们利用已建立的Neuritin活性鉴定平台,观察了纯化的Neuritin重组蛋白对未分化的PC12细胞突起生长的影响,进一步明确了简易纯化方法获得的Neuritin促进神经元突起生长的作用,证明该纯化方法具有可行性。
最后,结合多克隆抗体制备的免疫方法[13-15],我们利用该简易纯化方法获得的Neuritin重组蛋白免疫动物,制备其特异性的多克隆抗体。研究显示,成功制备的抗血清不仅能有效结合rhNeuritin,而且能识别细胞内源性Neuritin,证实免疫动物所用的Neuritin重组蛋白具有良好的免疫原性。
以上研究表明本研究中所采用的纯化方法简易有效,是蛋白制备工作中必不可少的重要环节,对于深入开展Neuritin的功能及机制研究具有非常重要的意义。
[1]Nedivi E,Hevroni D,Naot D,et al.Numerous candidate plasticity-related genes revealed by differential cDNA cloning[J].Nature,1993,363(6431):718-722.
[2]Di Giovanni S,Faden A I,Yakovlev A,et al.Neuronal plasticity after spinal cord injury:identification of a gene cluster driving neurite outgrowth[J].Faseb j,2005,19(1):153-154.
[3]Zito A,Cartelli D,Cappelletti G,et al.Neuritin 1 promotes neuronal migration[J].Brain Struct Funct,2014,219(1):105-118.
[4]Zhou S and Zhou J.Neuritin,a neurotrophic factor in nervous system physiology[J].Curr Med Chem,2014,21(10):1212-1219.
[5]Wang X,Liu C,Xu F,et al.Effects of neuritin on the migration,senescence and proliferation of human bone marrow mesenchymal stem cells[J].Cell Mol Biol Lett,2015,20(3):466-474.
[6]Wang H,Li X,Shan L,et al.Recombinant hNeuritin promotes structural and functional recovery of sciatic nerve injury in rats[J].Front Neurosci,2016,10:589.
[7]Gao R,Li X,Xi S,et al.Exogenous neuritin promotes nerve regeneration after acute spinal cord injury in rats[J].Hum Gene Ther,2016,27(7):544-554.
[8]Zhang L,Zhao Y,Wang C G,et al.Neuritin expression and its relation with proliferation,apoptosis,and angiogenesis in human astrocytoma[J].Med Oncol,2011,28(3):907-912.
[9]Han D,Qin B,Liu G,et al.Characterization of neuritin as a novel angiogenic factor[J].Biochem Biophys Res Commun,2011,415(4):608-612.
[10]Karamoysoyli E,Burnand R C,Tomlinson D R,et al.Neuritin mediates nerve growth factor-induced axonal regeneration and is deficient in experimental diabetic neuropathy[J].Diabetes,2008,57(1):181-189.
[11]Zhang P,Luo X,Guo Z,et al.Neuritin inhibits notch signaling through interacted with neuralized to promote the neurite growth[J].Front Mol Neurosci,2017,10:179.
[12]Zhang Y,Zhang S,Xian L,et al.Expression and purification of recombinant human neuritin from Pichia pastoris and a partial analysis of its neurobiological activity in vitro[J].Appl Microbiol Biotechnol,2015,99(19):8035-8043.
[13]Chen Y,Liu Y,Guo J,et al.Preparation and characterization of a polyclonal antibody against human actin filamentassociated protein-120 kD[J].Int J Mol Sci,2016,17(6):942-951.
[14]Li J,Wu R,Chen H,et al.The cloning and characterization of the enolase2 gene of Gekko japonicus and its polyclonal antibody preparation[J].Int J Mol Sci,2013,14(5):8787-8800.
[15]Hu Y X,Guo J Y,Shen L,et al.Get effective polyclonal antisera in one month[J].Cell Res,2002,12(2):157-160.
