脂肪酸基双子表面活性剂的合成及其对蒙脱土的改性
2018-05-28李鹏飞马建中王泓棣
吕 斌, 李鹏飞, 马建中, 王泓棣
(陕西科技大学 轻工科学与工程学院 轻化工程国家级实验教学示范中心, 陕西 西安 710021)
0 引言
表面活性剂是指分子中含有两亲性基团,在浓度很低时能显著降低水溶液表面张力的化学品,是一类能显著提高产品质量、降低生产成本的重要原料与助剂,被广泛应用于轻工、纺织、石油等多个领域[1].双子表面活性剂是一类分子内至少含有两个亲水基团和两个疏水基团的新型表面活性剂,与传统表面活性剂相比,双子表面活性剂具有优异的性能[1,2].
尽管双子表面活性剂性能优异,但是目前其合成原料价格昂贵,合成步骤复杂,生产成本较高,限制了其应用.因此,采用价格低廉的原料和简化制备工艺成为研究双子表面活性剂的主要任务之一[3].
蒙脱土是一种具有典型2∶1型层状结构的硅酸盐矿物,来源丰富,其结构的特殊性使其得到广泛的应用.由于天然蒙脱土层间以范德华力结合,键能较弱,晶胞中含有很多羟基亲水基,表现出强亲水性.蒙脱土的亲水疏油性不利于其在有机相中分散以及其对有机物质的吸附,限制了它在诸多领域的应用,因此常对应用于有机体系的蒙脱土进行改性[4].经过有机改性后的蒙脱土变为疏水亲油性,由于其片层表面被有机离子上的烷基长链覆盖,改变了层间微环境,蒙脱土外表面由亲水性变为亲油性,提高了其在聚合物基体中的分散性和相容性,有利于形成聚合物/层状硅酸盐纳米复合材料[5-7].
双子表面活性剂因其特殊的结构,改性后的蒙脱土亲油性更强,在有机基体中的分散效果更好[8].本研究采用油酸、硬脂酸、芥酸等为原料,与单乙醇胺和三氯氧磷等制备系列脂肪酸基双子表面活性剂.再采用脂肪酸基双子表面活性剂对蒙脱土进行改性,制得脂肪酸基双子表面活性剂改性蒙脱土,以增强蒙脱土的亲油性与分散性.
1 实验部分
1.1 主要试剂与仪器
(1)主要试剂:油酸,分析纯,天津市天力化学试剂有限公司;硬脂酸,分析纯,郑州派尼化学试剂厂;芥酸,分析纯,国药集团化学试剂有限公司;单乙醇胺,分析纯,天津市登峰化学试剂厂;十六烷基二甲基叔胺,分析纯,梯希爱上海化成工业有限公司;蒙脱土,工业品,河北张家口市清河化工厂.
(2)主要仪器:FTIR-5DX傅里叶变换红外光谱仪,美国Nicole公司;XJZ-200全自动表面张力仪,承德市金建检测仪器有限公司;D/max2200PC型X射线衍射仪,日本理学公司;TGAQ500型热重分析仪,美国TA公司.
1.2 实验方法
1.2.1 脂肪酸单乙醇酰胺的制备[9]
90 ℃下,反应整个过程通N2,按摩尔比n(单乙醇胺)︰n(脂肪酸)=0.8︰1加入脂肪酸、单乙醇胺到四口烧瓶中,升温至160 ℃,恒温反应5 h,降温到60 ℃,按n(单乙醇胺)︰n(脂肪酸)=0.25︰1补加单乙醇胺,并加入0.2 wt%甲醇钠,再升温至100 ℃恒温反应3 h,制得脂肪酸单乙醇酰胺,用无水乙醇对其进行重结晶,得到提纯产物,进行真空干燥.
1.2.2 脂肪酸基双子表面活性剂的制备
将脂肪酸单乙醇酰胺用等体积比例四氢呋喃、乙醚、乙腈溶液溶解后加入烧瓶中,按n(脂肪酸单乙醇酰胺)︰n(POCl3)︰n(三乙胺)︰n(乙二醇)︰n(叔胺)=1︰1.25︰1︰1︰1加入三氯氧磷、三乙胺、乙二醇、十六烷基二甲基叔胺,0 ℃下反应4 h后,升温至65 ℃反应36 h,制得脂肪酸基双子表面活性剂.所得产物用分别用正己烷、异丙醇依次进行重结晶,得到提纯产物,在真空干燥箱中干燥以除去挥发性溶剂.
1.2.3 脂肪酸基双子表面活性剂改性蒙脱土的制备
称取5 g蒙脱土置于100 mL去离子水中,搅拌至分散均匀.然后加入脂肪酸基双子表面活性剂,在90 ℃的恒温水浴下搅拌4 h,取出离心,并用去离子水洗涤,100 ℃下干燥至恒重,获得改性蒙脱土.
1.3 结构表征
(1)采用KBr压片法,在VECTOR-22傅里叶变换红外光谱仪进行红外测试,测试范围400~4 000 cm-1.
(2)分别采用氘代氯仿(CDCl3),氘代二甲基亚砜(DMSO)和氘代N,N-二甲基甲酰胺(DMF)为溶剂,用400 MHz核磁共振波谱仪对最终制备的表面活性剂样品进行1H NMR测试.
(3)采用日本理学D/max2200PC型X射线衍射仪对改性蒙脱土和钠基蒙脱土其进行测试.测试条件:CuKa辐射,扫描速度2 °/min,扫描角度:0 °~10 °.
(4)采用TGS 22型热分析仪分别对不同的双子表面活性剂改性蒙脱土和未改性的蒙脱土样品进行TGA测试,温度20 ℃~600 ℃,N2,10 ℃/min.
1.4 性能检测
根据文献[10]中的临界胶束浓度(cmc)、泡沫性能、乳化力测定和润湿性能的测试方法,对三种脂肪酸基双子表面活性剂进行性能检测.
(1)酸值的测定:将待测样品置于250 mL的干净的锥形瓶中,加入乙醇后振荡使样品溶解,加入酚酞作为指示剂,采用0.1 mol/L标准氢氧化钾滴定至微红色,保持15~20 s颜色不褪去[9].
(2)胺值的测定:根据国家标准GB/T15046-2011[11]的规定,采用95%乙醇与苯的混合溶液(V乙醇∶V苯=1∶1)与1~3 g样品置于干净的锥形瓶中,加入2~3滴溴酚蓝,采用0.1 mol/L标准盐酸溶液滴定值微黄色,并保持15~20 s颜色不褪去.
(3)分散性实验方法:将10 mg脂肪酸基双子表面活性剂改性蒙脱土分别分散在1 mL水、无水乙醇和液体石蜡中,震摇15 min后静置,观察样品的沉降现象[12].
2 结果与讨论
2.1 脂肪酸单乙醇酰胺合成及表征
2.1.1 脂肪酸单乙醇酰胺的合成
脂肪酸中的-COOH与单乙醇胺中的-NH2反应生成脂肪酸单乙醇酰胺(如反应式(1)),为避免高温条件下油酸与芥酸分子中双键氧化,反应在N2保护下进行.随着反应进行,副产物酰胺酯和氨基酯大量生成(如反应式(2)、(3)),酰胺酯可在碱性催化剂下转化为脂肪酸单乙醇酰胺(如反应式(4)),而氨基酯的胺解条件却很苛刻.因此,为避免大量氨基酯的生成,采用两步反应法,先在高温条件下反应生成脂肪酸单乙醇酰胺和脂肪酸酰胺酯,再降温并添加催化剂甲醇钠,胺解第一步生成的酰胺酯[10].
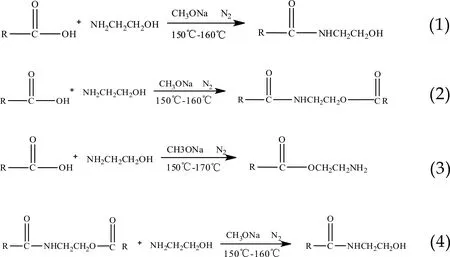
由表1反应过程酸值、胺值可以看出,第一步反应结束后,酸值大幅度降低,胺值也很小,说明反应程度较高;第二步反应结束后,酸值进一步降低,说明酰胺酯副产物在碱催化下转化为脂肪酸酰胺.如表1所示油酸、硬脂酸、芥酸三种脂肪酸单乙醇酰胺的产率分别达到91.72%、89.60%、88.26%.
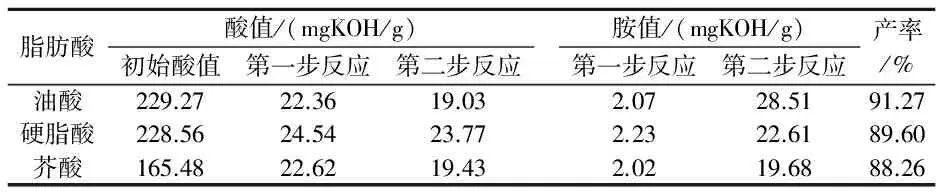
表1 酰胺化反应过程中酸值、胺值及产率的变化情况
注:产率=(1-反应结束酸值/初始酸值)×100%
2.1.2 红外光谱结果
图1为油酸单乙醇酰胺、硬脂酸单乙醇酰胺和芥酸单乙醇酰胺的FT-IR谱图.由图1可以看出,三种脂肪酸单乙醇酰胺在1 730~1 750 cm-1无吸收峰,说明无酯键形成,产物在3 208.87 cm-1处有峰,为OH的吸收峰.1 640~1 645 cm-1处为酰胺键中C=O强吸收峰,1 550~1 567 cm-1处为酰胺键的C-N强吸收峰,1 067 cm-1处为醇羟基中C-OH的吸收峰,油酸单乙醇酰胺和芥酸单乙醇酰胺在3 009 cm-1处的峰为脂肪族不饱和烃=CH的伸缩振动吸收峰,这表明所得产物的双键未被氧化,而硬脂酸则无=CH的伸缩振动吸收峰,检测结果与脂肪酸单乙醇酰胺的分子结构相吻合,表明成功制得了脂肪酸单乙醇酰胺.
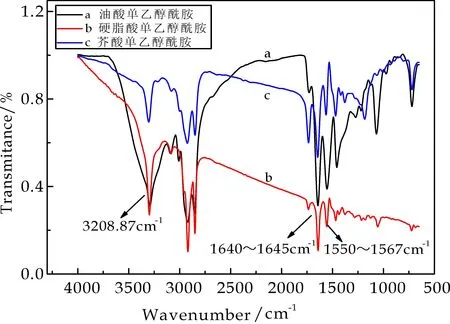
图1 脂肪酸单乙醇酰胺的FT-IR谱图
2.1.3 核磁谱图结果
图2为油酸单乙醇酰胺、硬脂酸单乙醇酰胺和芥酸单乙醇酰胺的核磁共振氢谱图.
图2中a曲线为油酸单乙醇酰胺,在1H-NMR(CDCl3,400 MHz),δ:0.89(3H,CH3-),1.30(2H,-CH2-),2.03-2.33(6H,CH2C=O;2CH2-C=C);3.41(2H,-N-CH2-);3.701(2H,C-CH2-O);5.36(2H,-CH=CH-);6.17(H,-NH-C-).通过核磁共振氢谱图可以发现,出现明显的碳碳双键、羟基和酰胺键的吸收峰,说明成功制备了油酸单乙醇酰胺.
图2中b曲线为硬脂酸单乙醇酰胺,1H-NMR(CDCl3,400 MHz),δ:0.859(3H,-CH3);1.233(30H,-CH2-);2.163(2H,CH2C=O);3.409(2H,-N-CH2-);3.708(2H,C-CH2-O);5.938(H,-NH-C-).其中,羟基和酰胺键的吸收峰说明成功制备了硬脂酸乙醇酰胺.
图2中c曲线为芥酸基双子表面活性剂,在1H-NMR(CDCl3,400MHz),δ:0.90(3H,CH3-);1.28(2H,-CH2-),2.02- 2.32(6H,CH2C=O;2CH2-C=C);3.44(2H,-N-CH2-);3.75(2H,C-CH2-O);5.37(-CH=CH-);5.96(H,-NH-C-).其中,图出现明显的碳碳双键、羟基和酰胺键的吸收峰,说明成功制备了芥酸单乙醇酰胺.通过红外与核磁结合分析,表明确定成功制备了脂肪酸单乙醇酰胺.
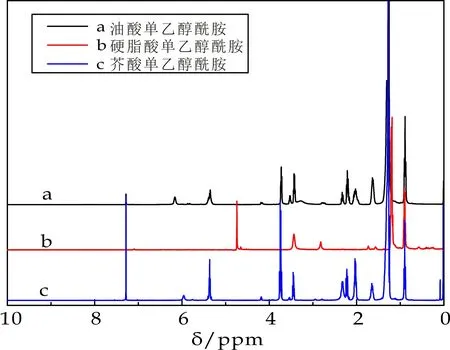
图2 脂肪酸单乙醇酰胺的1H-NMR谱图
2.2 脂肪酸基双子表面活性剂的合成、表征与性能
2.2.1 脂肪酸基双子表面活性剂的合成
脂肪酸双子表面活性剂的合成分为磷酸化和季铵化.脂肪酸单乙醇酰胺的-OH与POCl3进行磷酸化反应从而引入磷酸酯基,制备得到脂肪酸单乙醇酰胺磷酸酯(如反应式(5)).再将脂肪酸单乙醇酰胺磷酸酯、乙二醇、十六烷基二甲基胺引入到体系中,反应制得脂肪酸基双子表面活性剂[13](如反应式(6)).
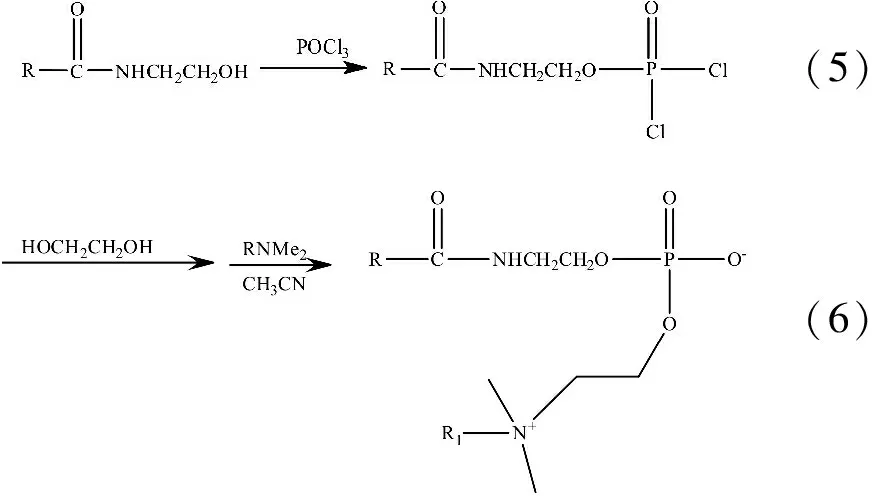
注:R为脂肪酸烃链;R1为十六烷基烃链.
2.2.2 红外光谱分析
图3为油酸基双子表面活性剂、硬脂酸基双子表面活性剂和芥酸基双子表面活性剂的FT-IR谱图.由图3可以看出,三种脂肪酸基双子表面活性剂均出现了脂肪酸单乙醇酰胺所具有的吸收峰,在1 640~1 645 cm-1处为酰胺键中C=O强吸收峰,1 550~1 567 cm-1处为酰胺键的C-N强吸收峰,但不含有-OH吸收峰,950 cm-1的吸收峰为C-N的振动吸收峰,是季铵盐的特征吸收峰,1 165 cm-1的吸收峰为P=O的吸收峰,检测结果与脂肪酸基双子表面活性剂分子结构吻合,表明成功制备得系列脂肪酸基双子表面活性剂.
2.2.3 核磁氢谱分析
图4为油酸基双子表面活性剂、硬脂酸基双子表面活性剂和芥酸基双子表面活性剂的核磁共振氢谱图.
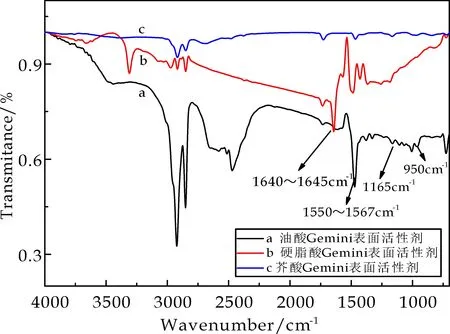
图3 脂肪酸基双子表面活性剂的FT-IR谱图
图4中a曲线为油酸基双子表面活性剂,在1H-NMR(C2D6OS,400 MHz),δ:0.88(3H,CH3-),1.06(2H,-CH2-),2.51(6H,2NCH3),2.72(2H,-CH2CO-),3.44(2H,-N-CH2-),4.38(2H,-C-CH2O-),5.32(2H,-CH=CH-).
图4中b曲线为硬脂酸基双子表面活性剂,1H-NMR(C3D7NO,400 MHz),δ:1.07(6H,CH3-),1.46(2H,-CH2-),2.97(6H,2NCH3),3.14(2H,-CH2CO-),3.66(2H,-N-CH2-),4.61(2H,-C-CH2O-),其中DMF溶剂峰分别为δ:8.21、3.10和2.97.对比DMSO溶剂基团出峰位置发现DMF检测氢谱出峰位置向高场移动2.30左右.
图4中c曲线为芥酸基双子表面活性剂,1H-NMR(C2D6OS,400 MHz),δ:0.88(3H,CH3-),1.07(2H,-CH2-),2.51(6H,2NCH3),2.72(2H,-CH2CO-),3.47(2H,-N-CH2-),4.39(2H,-C-CH2O-).通过核磁共振氢谱图可以发现,未出现明显的羟基的吸收峰,说明反应方程式(5)进行完全;此外,油酸和芥酸基双子表面活性剂在δ=3.44和δ=4.38处出峰(或硬脂酸基双子表面活性剂在δ=3.66和δ=4.61处出峰),可以说明反应方程式(6)进行完全.通过红外与核磁可以确定成功制备了脂肪酸基双子表面活性剂.
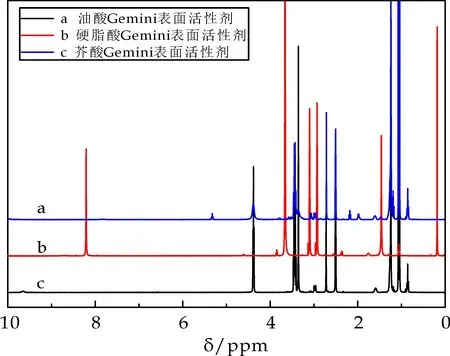
图4 脂肪酸基双子表面活性剂的1H-NMR谱图
2.2.4 脂肪酸基双子表面活性剂的表面活性
图5为油酸基双子表面活性剂、硬脂酸基双子表面活性剂和芥酸基双子表面活性剂表面张力随浓度的变化曲线.由图5可以看出,随着表面活性剂浓度的增大,油酸基双子表面活性剂、硬脂酸基双子表面活性剂、芥酸基双子表面活性剂的表面张力逐渐降低,油酸基双子表面活性剂、硬脂酸基双子表面活性剂、芥酸基双子表面活性剂的临界表面张力为18.10 mN/m、32.43 mN/m和29.16 mN/m;临界胶束浓度分别为7.88×10-4mol/L、6.0×10-4mol/L、5.25×10-4mol/L.
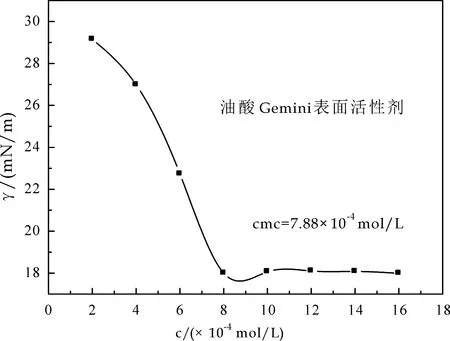
(a)油酸基双子表面活性剂表面张力变化曲线
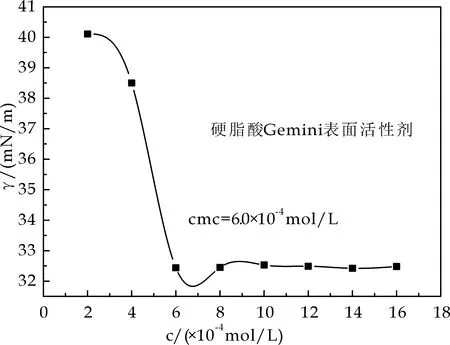
(b)硬脂酸基双子表面活性剂表面张力变化曲线
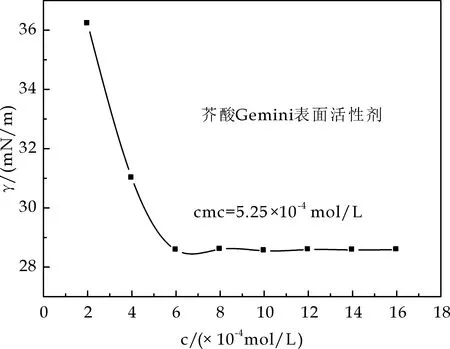
(c)芥酸基双子表面活性剂表面张力变化曲线图5 脂肪酸基双子表面活性剂的表面张力与浓度的关系图
2.2.5 脂肪酸基双子表面活性剂的性能检测结果
表2为三种脂肪酸基双子表面活性剂的乳化性、润湿性和泡沫性能的检测结果.由表2可以看出,在乳化性能方面,芥酸基双子表面活性剂的乳化性相对较好,优于十二烷基苯磺酸钠.在油酸基、硬脂酸基、芥酸基双子表面活性剂溶液中布块的沉降时间分别为8.2 s、8.1 s、8 s,均优于十二烷基苯磺酸钠,这是由于脂肪酸基双子表面活性剂含有两条疏水链,分子易于在界面进行平行铺展,从而表现出更为优异的润湿性[14].油酸基、硬脂酸基、芥酸基三种双子表面活性剂的发泡力为初始液面高度的1.36倍、1.86倍、1.43倍,泡沫较为细腻、均匀.30 min时的泡沫体积与30 s时的泡沫体积比分别为0.79、0.57、0.57稳泡性一般,与十二烷基苯磺酸钠的发泡力与稳泡性基本一致.
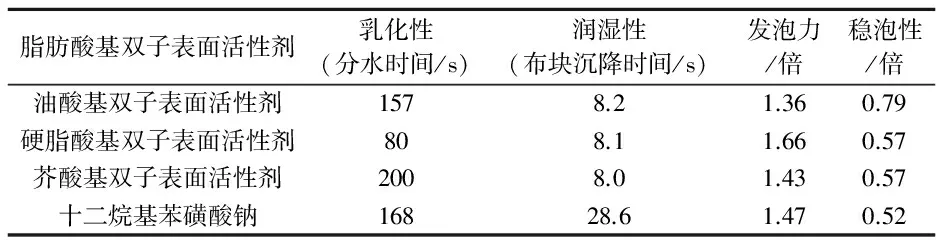
表2 脂肪酸基双子表面活性剂的性能
2.3 脂肪酸基双子表面活性剂改性蒙脱土的表征及其分散性
2.3.1 X射线衍射(XRD)结果
图6为蒙脱土与脂肪酸基双子表面活性剂改性蒙脱土的XRD变化曲线.由图6可以看出,与钠基蒙脱土相比,改性后的蒙脱土,衍射峰都向小角度方向移动,根据Bragg公式2dsinθ=λ,计算得蒙脱土的层间距.钠基蒙脱土的层间距为1.27 nm,油酸基双子表面活性剂改性蒙脱土的层间距增大至1.70 nm;硬脂酸基双子表面活性剂改性蒙脱土的层间距增大至1.86 nm;芥酸基双子表面活性剂改性蒙脱土的层间距增大至1.60 nm,这表明脂肪酸双子表面活性剂已成功插层到蒙脱土层间[15,16].
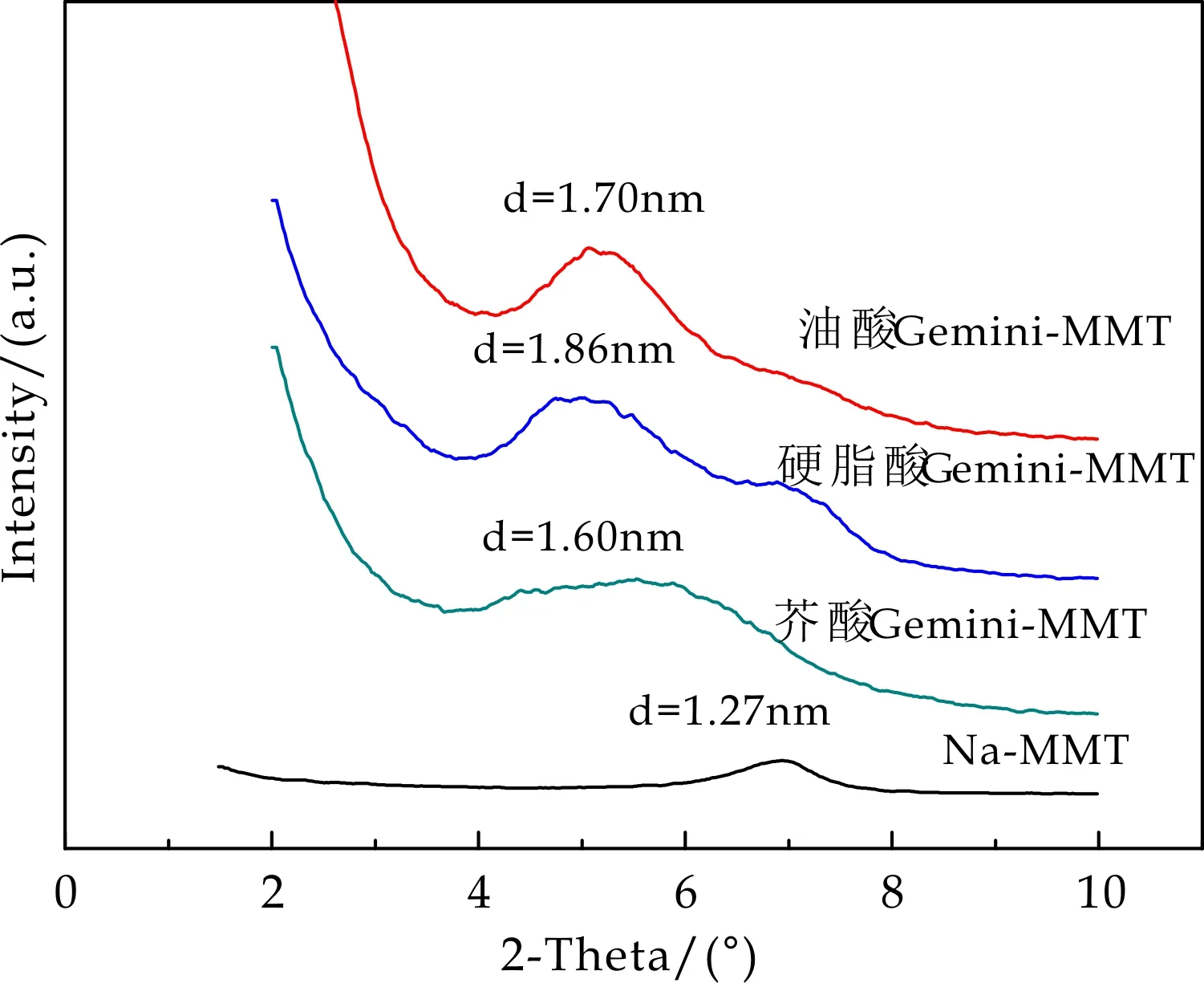
Na-MMT为纳基蒙脱土;油酸Gemini-MMT为油酸基双子表面活性剂改性蒙脱土;硬脂酸Gemini-MMT为硬脂酸基双子表面活性剂改性蒙脱土;芥酸Gemini-MMT为芥酸基双子表面活性剂改性蒙脱土(图7同).图6 脂肪酸基双子表面活性剂的XRD谱图
2.3.2 热重结果
图7为蒙脱土与脂肪酸基双子表面活性剂改性蒙脱土的TG变化曲线.由图7可以看出,钠基蒙脱土并未出现明显的质量变化,微量的失重是由于脱水所致.而改性后的蒙脱土热分解分为三个阶段,在150 ℃之前,蒙脱土主要脱去片层间的吸附水与自由水,改性后的有机蒙脱土失重较少,表明蒙脱土层间的部分水已经被表面活性剂置换出来,说明经双子表面活性剂改性后的蒙脱土疏水性增强;当升温到170 ℃左右时,有机蒙脱土层间的表面活性剂开始分解,改性蒙脱土重量迅速降低,开始出现明显的失重;当升温到430 ℃左右时,TG曲线趋于平缓,说明有机插层剂脂肪酸基双子表面活性剂已基本热分解完全.
在150 ℃~600 ℃范围内,有机蒙脱土的失重是由双子表面活性剂的分解引起的,三种双子表面活性剂改性蒙脱土的失重率分别达33%、31%、34%.这表明脂肪酸基双子表面活性剂已经成功插层到蒙脱土层间,而且插入到蒙脱土中的脂肪酸基双子表面活性剂的量较大,并且也说明脂肪酸双子表面活性剂对蒙脱土进行了改性,从而提升了蒙脱土的亲油性.除此之外,加热过程中蒙脱土层间插入脂肪酸基双子表面活性剂质量顺序为芥酸基>油酸基>硬脂酸.这可能是由于芥酸基和油酸基内均含有双键,改变了疏水链的线型结构,从而能够改变脂肪酸基双子表面活性剂进入蒙脱土的空间位阻;而且芥酸基的分子量大于油酸基,从而出现了失重率的差异[17].
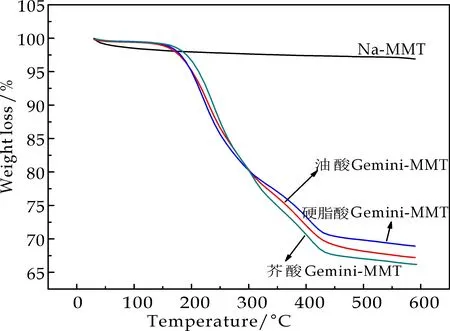
图7 脂肪酸基双子表面活性剂的TG曲线
2.3.3 脂肪酸基双子表面活性剂改性蒙脱土的分散性
将未改性的蒙脱土和改性后的蒙脱土分别分散在水、乙醇和液体石蜡中,研究它们在水、乙醇和液体石蜡中的分散性能.由表3可以看出,改性后的蒙脱土在水中的分散性变差,而在有机溶剂乙醇和液体石蜡中的分散性比未改性的蒙脱土好.经脂肪酸基双子表面活性剂改性后,其疏水性增强,在有机体系中的分散性得到显著提高,为后期制备复合材料奠定了基础.

表3 Na-MMT和脂肪酸基双子表面活性剂改性蒙脱土的分散性
注:“-”表示分散性非常差;“+-”表示分散性较差;“+”表示分散性较好;“++”表示分散性非常好.
3 结论
(1)以系列脂肪酸为原料,分别与单乙醇胺反应制备中间体脂肪酸单乙醇酰胺,进而与三氯氧磷、十六烷基二甲基叔胺反应制得了油酸基、硬脂酸基、芥酸基双子表面活性剂.
(2)通过对表面活性剂性能的测定,得出了油酸基、硬脂酸基、芥酸基三种表面活性剂的临界胶束浓度分别为7.88×10-4mol/L、6.0×10-4mol/L、5.25×10-4mol/L,分水时间分别为157 s、80 s、200 s,发泡力分别为1.36倍、1.86倍、1.43倍,稳泡性分别为0.79倍、0.57倍、0.57倍,润湿时间分别为8.2 s、8.1 s、8 s.
(3)钠基蒙脱土经油酸基、硬脂酸基、芥酸基双子表面活性剂改性后,层间距由原来的1.27 nm分别增加到1.70 nm、1.86 nm、1.60 nm.双子表面活性剂在蒙脱土的层间插入量分别为33%、31%、34%,经改性后的蒙脱土在有机体系中具有良好的分散性.
[1] Niu R,Wang C,Sun Z,et al.A novel alkyl sulphobetaine gemini surfactant based on s-triazine:Synthesis and properties[J].Journal of Surfactants & Detergents,2017(1):1-8.
[2] Patel U,Parekh P,Sastry N V,et al.Surface activity,micellization and solubilization of cationic gemini surfactant-conventional surfactants mixed systems[J].Journal of Molecular Liquids,2017,225:888-896.
[3] Liu X M,Song C,Wang S Y.Synthesis and properties of cationic Gemini surfactants with amide group[J].Chemical Research and Application,2011,23(2):185-186.
[4] 王成乐,丁文鹏,丁 鹏,等.层柱粘土与膨胀阻燃剂在聚乙烯醋酸乙烯酯中的协同作用[J].高分子材料科学与工程,2017,33(2):84-88.
[5] Zaini M,Majid R A,Nikbakht H.Modification of montmorillonite with diamine surfactants[J].Applied Mechanics & Materials,2015,695:224-227.
[6] Sun H G,Zhang J C,Li L,et al.Surface modification of natural Na-montmorillonite in alkane solvents using a quaternary ammonium surfactant[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2013,426:26-32.
[7] Shirzad Siboni M,Khataee A,Hassani A,et al.Preparation,characterization and application of a CTAB-modified nanoclay for the adsorption of an herbicide from aqueous solutions:Kinetic and equilibrium studies[J].Comptes Rendus Chimie,2015,18(2):204-214.
[8] Liu B,Lu J X,Xie Y,et al.Microwave-assisted modification on montmorillonite with ester-containing Gemini surfactants and its adsorption behavior for triclosan[J].Journal of Colloid and Interface Science,2014,418:311-316.
[9] Lyu Bin,Gao Jianjing,Ma Jianzhoang.Organic modification and characterization of Na-montmorillonite[J].China Surfactant Detergent & Cosmetics, 2015,45(2):76-80.
[10] 王泓棣.不对称磺基琥珀酸酯盐Gemini表面活性剂的合成、性能与应用[D].西安:陕西科技大学,2016.
[11] GB/T15046-2011,脂肪酰二乙醇胺[S].
[12] Li Zhongheng,Zhou Limei.Preparation and characterization of organic montmorillonite intercalated with ester quaternary ammonium salt surfactants[J].Guangzhou Chemical Industry,2011,39(3):101-102,125.
[13] Muller D.Competitive adsorption of gelatin and sodium do-decylbenzene sulfonate at hydrophobic surface[J].Langmuir,1998,14(9):3 107-3 110.
[14] 赵剑曦.Gemini表面活性剂的研究与发展方向[J].精细与专用化学品,2008,16(2):14-19.
[15] Maiti P,Yamada K,Okamoto M,et al.New polylactide/layered silicate nanocomposites:Role of organoclays[J].Chemistry of Materials,2002,14(11):4 654-4 661.
[16] Calderon U,Lennox B,Kamal M R.Thermally stable phosphonium-montmorillonite organoclays[J].Applied Clay Scicence,2008,40(1):90-98.
[17] 赵剑曦.杂双子表面活性剂的研究进展[J].化学进展,2005,17(6):987-993.
