荒漠植物骆驼蓬的繁殖生物学特性研究
2018-05-28杨旭陆嘉惠陈晓翠牛清东韩春王跃
杨旭 ,陆嘉惠 ,2*,陈晓翠 ,牛清东 ,韩春 ,王跃
(1石河子大学生命科学学院,植物资源与生态重点实验室,新疆 石河子832003;2新疆兵团绿洲生态农业重点实验室,新疆 石河子832003)
植物花部特征和繁育系统是植物繁殖生物学的重要特征[1]。对植物花大小、颜色、花部结构及花期物候、交配系统、传粉策略等的研究[2],有助于了解植物的有性繁殖方式及其与环境的适应关系,可为植物及其演化的研究提供科学依据[3]。
骆驼蓬Peganum harmala为蒺藜科Zygophyllaceae骆驼蓬属Peganum多年生草本植物。全属共6种,间断分布于中亚、地中海沿岸、墨西哥和美国南部[4]。《中国植物志》记载骆驼蓬属有3个种在中国有分布,即骆驼蒿P.nigellastrum、骆驼蓬P.harmala和多裂骆驼蓬P.mulstecutm,主要分布于新疆、甘肃、宁夏、青海和内蒙古的荒漠或半荒漠地区[5]。骆驼蓬具有很高的药用价值,据记载骆驼蓬具有祛风湿,消肿痛,止平喘之功效[6],全草总生物碱对肿瘤细胞有一定的抑制作用[7],但全草有毒,不可生服。此外,其经济价值很高,可做肥料和工业原料,植株干枯后可做牛羊饲料[4-5],还具有保土固沙的效益等作用[5]。
骆驼蓬是典型的荒漠植物,目前其传粉策略和繁育系统的研究尚未见报道,因此,本研究通过对骆驼蓬花部特征及花期物候的观察、繁育系统类型的测定和传粉策略的研究,揭示骆驼蓬有性繁殖策略及其适应意义,可为荒漠植物的生态适应和植物花器官、有性繁殖、交配系统的进化、适应理论提供新资料。另外,通过荒漠植物骆驼蓬的繁殖生物学特性研究,也有助于更好地理解荒漠植物与环境之间的相互关系,对干旱荒漠区的生态恢复及资源的可持续利用具有深远的意义。
1 材料与方法
1.1 试验地概况
试验地位于石河子市霍斯阿尔克村附近,地处北纬 44°13′,东经 85°55′,海拔 525m。属于温带大陆性干旱气候,年均气温7-8℃,日照2721-2818 h,年有效积温3000~3500℃,年均降水量125.0-207.7 mm,年均蒸发量1500-2000mm,土壤类型为壤土。本实验对该地区的野生骆驼蓬种群进行定点观测。
1.2 方法
1.2.1 花部特征和开花动态的观察
自然环境下随机选取株型大小相似的10个植株(每株植物至少含有5个花蕾)判断花发育不同阶段雌蕊和雄蕊发育状况;观察花在不同时期花冠颜色、雌雄蕊间异位距离、花萼的形态,花冠各部器官长度的测量。
从初生花蕾期到开花败落,比较不同发育时期花部特征的动态变化。
1.2.2 繁育系统的检测
(1)OCI
随机取开放的小花10朵,测量或记录花部特征参数,按照Dafni[8]的标准进行繁育系统的检测。具体方法[19]是:(1)花冠直径 <1 mm 记为 0,1-2 mm记为 1,2-6 mm 记为 2,>6 mm 记为 3;(2)花药开裂时间与柱头可授期之间的时间间隔,同时或雌蕊先熟记为0,雄蕊先熟记为1;(3)柱头与花药的空间位置,同一高度记为0,空间分离记为1。三者之和为OCI值。评判标准为:OCI=0时,繁育系统为闭花受精;OCI=1时,繁育系统为专性自交;OCI=2时,繁育系统为兼性自交;OCI=3时,繁育系统为自交亲和,有时需要传粉者;OCI=4时,繁育系统为部分自交亲和,异交,需要传粉者。
(2)P/O
随机选取即将开放但花药未裂开的花10朵,用镊子取下每朵花的花药,分别装在10mL离心管里,加入1 mL 10%HCl水解去除花药壁,制成悬浮液[10]。用微量移液器取1 μL(重复 10次),在低倍显微镜下统计花粉粒数,每个视野重复计数3次,算出平均值。解剖刀横切子房,在体视显微镜下观察并记录胚珠的数目。
需要标明的是,这一点极其重要,他在一定程度上回应了上一个部分提出的必然性难题。对人类理性来说,因果性存在于时间序列当中,囿于这一点,自由意志才是与上帝预知相矛盾。实际上,神的领域在永恒当中,所以神意根本不像人一样被限定在时间序列。既然“永恒当下”敉平了人类时间的三个向度——过去现在未来,那么因果序列在神意那里便完全失效。这也呼应到前文对神意与命运关系的辨析,整个逻辑显得十分缜密。
P/O为单花花粉数量与胚珠数之比。根据Cruden[11]的标准,P/O值的范围可以表示植物不同的繁育系统类型,P/O为2.7-5.4,繁育系统为闭花受精;P/O为18.1-39.0,繁育系统为专性自交;P/O为31.9-396.0,繁育系统为兼性自交;P/O为244.7-2588.0时,繁育系统为兼性异交;P/O为2108.0-195252.0,繁育系统为专性异交。
1.2.3 传粉特性的研究
(1)访花昆虫采集拍照
随机选取3个10m×10m的样地,观察访花昆虫,每个样方内至少有50株正在开花的植株。选择晴朗无风的天气,盛花期观察并记录访花昆虫,采用相机进行拍照记录,并对其进行鉴定分类。观察记录至少60 h。
(2)主要访花昆虫的日活动规律
选择晴朗无风的天气,8:00-22:00,每隔2 h记录访花昆虫的活动规律。统计每一时间段访花昆虫的数量,并对飞落在植株上的昆虫跟踪观察其访花行为,了解其传粉习性。
1.2.4 数据处理
采用Microsoft Excel 2010和SPSS 19.0统计分析软件对所得数据进行处理,采用Origin 6.1软件制图。
2 结果与分析
2.1 花部特征及开花动态
2.1.1 花部特征
骆驼蓬花单生,花期5-7月,约80 d,单花花期2-3 d,果期6-8月;花瓣黄白色或淡白色,呈顶端微钝椭圆形,长约 0.5-1 cm,宽 2-5mm(图 1a、b);萼片 5枚,长 0.5-1 cm(图 1c);雄蕊 15枚,花药渐次开裂(图1e),花冠未张开时已有花药开裂,开裂方式为纵裂,基着药,花丝近基部扩展,15枚花丝基部包裹子房;整个植株是由下往上的开花顺序,即靠近根部的先开放,远离根部的较晚开放;子房3室,胚珠55-70枚,柱头呈三面微凹的三棱柱形(图1 d);子房基部具有5个蜜腺窝(图 1g),盛花期花蜜量较丰富。蒴果近球形,顶端稍扁,宽约1 cm;种子多数,呈黑褐色,三棱形,其种子形态与前人研究的多裂骆驼蓬种子形态相似[9]。骆驼蓬存在雌雄异位现象,异位距离为0.067±0.0047 cm(表1)。

图1 骆驼蓬花部器官的形态及发育动态Fig.1 The shape and its development of floral organs ofPeganum harmala

表1 骆驼蓬的花部特征参数cmTab.1 Traits parameters ofPeganum harmalaflowers
2.1.2 开花动态
依据骆驼蓬花冠的发育状态,将其划分为8个时期(图1h、表2):第1时期:花冠全为绿色,萼片明显高于花冠;第2时期:花冠尖端泛白色,其余为淡绿色,基部最深,萼片略高于花冠或等高,花药未开裂;第3时期:花冠除基部绿色外通体呈淡白色,花冠未开放,萼片低于花冠,且和花冠存在明显夹角,2-5枚花药开裂;第4时期:花冠微张,花瓣呈淡白色,萼片低于花冠,且与花冠存在明显夹角,4-8枚花药开裂;第5时期:花冠半张开,呈淡白色,萼片低于花冠,有雄蕊露出,6-10枚花药开裂;第6时期:花瓣淡白色,5枚花瓣即将呈一水平面,萼片低于花冠,12-15枚花药开裂;第7时期:花瓣淡白色,花冠完全展开,呈一平面,萼片低于花冠,且萼片基本呈一平面,雄蕊散开,花药部分开裂,部分萎蔫;第8时期:花瓣淡白色,萼片低于花冠,且萼片基本呈一平面,全部花药接近萎蔫。
2.1.3 异型花柱花的结构差异
观察发现,在自然居群中,同时具有长花柱型花和短花柱型花,且着生在同一植株上。整个居群长花柱型花占大多数,短花柱型只占据极少的比例。2种不同形态的花在第5时期差别最大,现以第5时期的2种花来做比较。
长花柱型花的花冠比短花柱型花略大(图2);长花柱型花雄蕊较长,雄蕊和柱头等高或者雄蕊略高于柱头,而短花柱型花雄蕊明显高于柱头,异位距离超过3 mm;两者雌蕊的形态也有差异,长花柱型花雌蕊柱头颜色为绿色,柱头表面凹陷较深(图1d),短花柱型花雌蕊柱头为浅黄绿色,柱头表面凹陷略浅(图1d);长花柱型花子房比短花柱型花子房大,颜色更深,胚珠数无明显差异。

图2 不同发育时期花雌雄蕊空间距离Fig.2 The herkogamy distance in different periods
(2)不同时期雌雄蕊空间距离的差异
图2显示,长花柱型花从最初的花药低于柱头到花药等高或略高于柱头期间,花丝在不断地伸长,而花柱相比伸长不明显;短花柱型花从最初的柱头低于花药到第5时期的柱头明显低于花药;2种类型的花均在第3时期(花冠未张开)已有部分花药开裂(图 2C2),到第 6时期花药全部开裂(图2C6)、第7时期部分花药还具有散粉能力(图2G2),第 8时期全部花药近乎萎蔫(图 2H2),散粉结束,花丝发生弯曲(图 2H1、F2、G2、H2),整个散粉过程持续接近3 d。
2.2 繁育系统的检测
2.2.1 OCI
OCI结果见表3。

表2 骆驼蓬的开花动态Tab.2 The flowering dynamics ofPeganum harmala
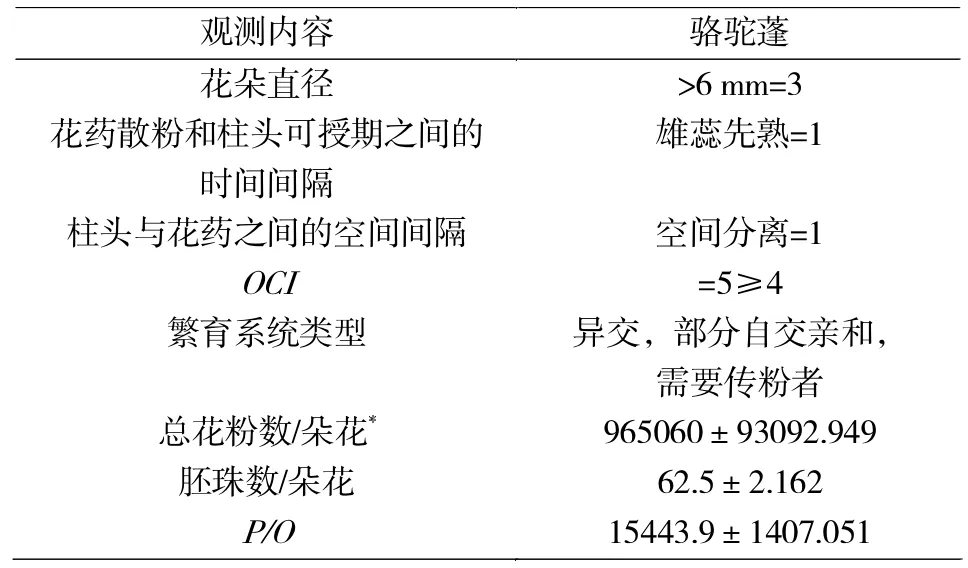
表3 骆驼蓬的OCI和P/OTab.3OCIandP/OofPeganum harmala
表 3 显示,OCI≥4,根据 Dafni[8]的标准,判断其繁育系统类型为异交,部分自交亲和,需要传粉者。
2.2.2 P/O
表3显示,骆驼蓬的P/O为15443.9±1407.051,依据Cruden[11]的标准,骆驼蓬的繁育系统为专性异交。
2.3 传粉昆虫的观测
2.3.1 主要传粉昆虫及访花行为
对骆驼蓬花期的传粉昆虫观察表明,主要为膜翅目Hymenoptera的昆虫,偶见蝇类和蝶类昆虫。常见的有蜜蜂科Apidae、木蜂科Xylocopidae等(图3)。

图3 骆驼蓬主要传粉昆虫及其盗食花蜜现象Fig.3 Main pollinators ofPeganum harmalaand nectar stealing phenomena
部分膜翅目昆虫在采集花粉或取食花蜜的同时,身体腹部、尾部和足部的绒毛会携带一部分花粉,在飞往下一朵花的同时,起到了传粉的作用。蜂类大多首先在花的上部飞舞,然后悬停在一朵花上面,当发现有未被访问过的花朵时便迅速靠近并伸出喙停留在花朵正面进行采食,蜂的腹部、尾部和足部都会携带大量的花粉(图3A、C、D)。在观察的过程中发现一个现象:部分昆虫采集花粉或者取食花蜜的同时,自己也变成了蜘蛛口中的猎物(图3F),在此过程中,蜘蛛在花冠以及雄蕊上部来回移动的同时,也会携带少量的花粉,起到一定的传粉效果。除了采集花粉的昆虫外,一部分昆虫更多地是取食花蜜(图3E、G、H),取食花蜜的同时身体碰撞雄蕊,使得部分花粉粒落在昆虫背部(图3E、G),该昆虫携带着花粉移动到下一朵花的同时,便起到了传粉的效果。观察过程中,也有蝇类、蝶类昆虫进行访花,但数量极少,停留时间也非常短。
2.3.2 访花昆虫的日活动规律
8:00-22:00,观察访花昆虫,当日天气晴朗无风,全天平均气温27℃。由图4可见,10:00之前访花昆虫数量很少;随着气温的上升,10:00以后,访花昆虫渐渐增多;到12:00-13:00,昆虫数量大幅增多,其中13:00左右,平均气温达到27℃,访花昆虫数量达到1 d中的最大值;随着气温的继续升高,访花昆虫略有减少;到16:00,平均气温达到最大值37.3℃,访花昆虫数量降到最低,而且花冠口出现微闭合现象;到19:00之后,平均气温降到27℃,访花昆虫又有略微的增加;到22:00之后,访花昆虫基本消失,花冠出现微闭合状态。

图4 骆驼蓬访花昆虫的日活动规律Fig.4 law of pollinators foraging activities ofPeganum harmala
3 讨论
3.1 骆驼蓬花部综合征
骆驼蓬每朵花具有15枚雄蕊,平均单花花粉粒数量高达965060±93092.949,且15枚雄蕊花药呈现渐次开裂,使得雄蕊散粉过程持续接近3 d,这在数量、时间上均大大增强和延长了花的雄性阶段,使每一朵花都具有持久的散粉和吸引传粉者的能力,与此同时,鲜艳的花瓣、丰富的花蜜量给予访花者优厚的回报。这与前人研究的结果相似[12-13],如王丽[14]研究的新疆党参Codonopsis clematidea等。花雄性阶段的增强和延长,有助于骆驼蓬在荒漠环境中,减少由于干旱等因素导致的传粉失败的风险,这在干旱荒漠盐碱地区具有很重要的适应意义[15]。异型花柱被认为是一种受遗传因素控制的花型多态性现象[16]。本研究发现,骆驼蓬是存在异型花柱的,但短花柱型花只占居群中很小比例,短花柱型花雌雄异位距离变化较大,末花期花丝发生弯曲(图 2H1、F2、G2、H2),这可能有助于调节已散粉花药和散粉花药的空间位置,降低前者对后者散粉的物理干扰,其具体机制还需进一步研究。
3.2 骆驼蓬繁育系统类型
繁育系统具有多样性,近交衰退使近交的便利减少,而远交的代价又很高,且易受外界环境的影响。然而进化是折中的,权衡近交和远交利弊后的途径便是混合交配系统。自然界中完全自交或异交的植物种类很少,大多数是两者兼有的混合交配模式[1,17]。本研究按照 Cruden[11]标准和 Dafni[8]标准对骆驼蓬分别进行OCI和P/O的测定,初步推断骆驼蓬属于异交,部分自交亲和的繁育系统类型,其具体交配机制还有待进一步的研究。而且骆驼蓬具有无性繁殖的特性,通过地下根状茎来繁衍后代[4,18]。这种繁育策略极大地体现了荒漠植物在极端恶劣环境条件下所进化出的生殖对策,在进化和生态方面具有深远意义。
3.3 骆驼蓬的传粉系统
传粉系统由花粉、柱头和传粉媒介3个部分组成[1,19]。有性生殖过程中,植物花的展示和设计与传粉机制相适应,而高效的传粉过程是以大量有活力的花粉、具有可授性的柱头和有效的传粉媒介为前提[20]。骆驼蓬的花粉活力和柱头可授性尚未进行准确的检测,后期会对其进行深入的研究。而对于传粉媒介来说,荒漠地区空旷、风大,风媒是大多数荒漠植物传粉的重要途径[21]。但通过观察发现,骆驼蓬部分花药开裂时,柱头并未伸出花冠,而是低于或与花药等高,并且花冠呈现微张状态,该情况下,风媒传播效果甚微。虽然末花期花冠完全展开,但此时大多数花药已发生萎蔫,故推断风媒不是骆驼蓬的主要传粉媒介。
骆驼蓬通过虫媒传粉较为明显,但其有效传粉昆虫数量不多,种类较少,主要为膜翅目Hymenoptera的昆虫,有蜜蜂科Apidae、木蜂科Xylocopidae等(图3),其各自的访花行为千姿百态。Castellanos等[21]发现蜂类具有频繁的梳理行为而将身上很大比例的花粉丢失,属于高移出低沉降(传粉效率极低)[22-23],从花药移走的花粉只有约1%能够到达同种植物的柱头,99%的花粉均在花药移出、昆虫取食、昆虫梳理与飞行、花粉成层堆积在昆虫体表或昆虫访问异种花等过程中损失殆尽。由此看出,骆驼蓬虫媒效果很低。Gong等[24]指出,传粉效率与花粉-胚珠比成负相关关系,即传粉效率低的植物花粉数量更多,导致花粉-胚珠比极高。本研究也发现,骆驼蓬开花期具有大量的花粉输出(花粉量多,渐次散粉),花粉胚珠比极高,达 15443.9±1407.051,这显然与荒漠环境中昆虫传粉效率低是相互适应的。骆驼蓬通过大量的花粉输出和极高的花粉-胚珠比来达到繁殖保障。
温度是影响访花昆虫数量的一个重要因素[25],本研究发现,骆驼蓬访花昆虫日活动规律呈现双峰趋势,高峰期出现在12:00-13:00和19:00-20:00两时间段,平均温度为27℃左右,为最适宜昆虫活动的温度。当温度达到1 d中最大值时,即16:00左右,昆虫数量达到 1 d中最低,同时出现花冠微闭现象,温度过高反而抑制了昆虫的访花行为。Widen[26]指出,这是昆虫的一种保护策略,花冠微闭是植物和昆虫协同进化的结果,可以避免在高温情况下造成花粉粒活性的丧失。另外,王丽等[14]指出,在天气多变的环境中,植物进化出特殊的保护机制如花冠下垂、花瓣闭合或保护性苞片。本研究发现,阴雨低温天气对骆驼蓬访花昆虫的数量具有较大的影响,其数量明显减少,与此同时,骆驼蓬也出现花冠闭合、延迟开花等现象。因此,骆驼蓬访花昆虫数量的减少与花冠闭合、延迟开花开放等现象相互适应,这是植物与昆虫长期对环境、气候的协同适应的结果。
[1]Ariascóyotl E,Stoner K E,Casas A.Effectiveness of bats as pollinators ofStenocereus stellatus(Cactaceae)in wild,managed in situ,and cultivated populations in La Mixteca Baja,central Mexico[J].American Journal of Botany,2006,93(11):1675-1683.
[2]马文宝,施翔,张道远,等.准噶尔无叶豆的开花物候与生殖特征[J].植物生态学报,2008,32(4):760-767.Ma W B,Shi X,Zhang D Y.Flowering phenology and reproductive features of the rare plantEremosparton songoricumin desert zone,Xinjiang,China[J].Journal of Plant Ecology,2008,32(4):760-767.
[3]Chen M,Zhao X,Zuo X,et al.Floral traits and pollination system ofZygophyllum xanthoxylumin the managed and wild populations in an arid region of Northwest China[J].Journal of Arid Land,2015,7(4):488-500.
[4]马骥,王勋陵.中国荒漠地区骆驼蓬属植物种类与分布[J].中国沙漠,1998,18(2):131-136.Ma J,Wang X L.The species and distribution of genusPeganumL.in the desert area of China[J].Journal of Desert Research,1998,18(2):131-136.
[5]马骥,王勋陵,赵松岭.骆驼蓬属种子萌发条件与更新生态位的研究[J].草业学报,1996(3):76-101.Ma J,Wang X L,Zhao S L.The studies of seeds germination and the regneration niches of Peganum in northwest China[J].Acta Prataculturalence,1996(3):76-101.
[6]宋立人.现代中药学大辞典[M].北京:人民卫生出版社,2001.
[7]薛小青,何文婷,张洪亮.骆驼蓬抗肿瘤作用研究进展[J].中医学报,2015(5):628-630.Xue X Q,He W T,Zhang H L.Research progress ofHarmel antitumoreffect[J].China Journal of Chinese Medicine,2015(5):628-630.
[8]Dafni A.Pollination ecology[M].New York:Oxford Univ Press,1992.
[9]陈晓翠,陆嘉惠,韩春,等.多裂骆驼蓬种皮微形态及其粘液特征的分析[J].石河子大学学报(自科版),2016,34(6).Chen X C,Lu J H,Han C,et al.Observation on the seed coat micromorphology and the mucus characteristics of the desert plantPeganum multisectum[J].Journal of Shihezi University(Natural Science),2016,34(6).
[10]田润炜,陆嘉惠,李学禹,等.光果甘草二体雄蕊的发育及其适应意义[J].植物生态学报,2013,37(7):641-649.Tian R W,Lu J H,Li X Y,et al.Diadelphous stamensinGlycyrrhiza glabra:theirdevelopment and adaptive significance[J].Chinese Journal of Plant Ecology,2013,37(7):641-649.
[11]Cruden R W.Pollen-ovule ratios:A conservative indicator of breeding systems in flowering plants[J].Evolution,International Journal of Organic Evolution,1977,31(1):32.
[12]陆婷,谭敦炎.动物传粉植物花粉呈现时序的进化意义[J].生物多样性,2007,15(6):673-679.Lu T,Tan D Y.Evolutionary implications of pollen presentation schedules in animal-pollinated plants[J].Biodiversity Science,2007,15(6):673-679.
[13]任明迅,夏婧,孟千万.雄蕊:生态与进化[M].北京:科学出版社,2016.
[14]王丽,谭敦炎.新疆党参的花部综合征与次级花粉呈现[J].生物多样性,2011,19(1):24-33.Wang L,Tan D Y.Floral syndrome and secondary pollen presentation in Codonopsis clem-atidea(Campanulaceae)[J].Biodiversity Science,2011,19(1):24-33.
[15]Martínez-Peralta C,Mandujano M C.Reproductive ecology of the endangered living rock cactus,Ariocarpus fissuratus(Cactaceae)[J].Journal of the Torrey Botanical Society,2011,138(2):145-155.
[16]刘欣欣,吴小琴,张奠湘.艳丽耳草的二型花柱及异型自交不亲和系统[J].生物多样性,2012,20(3):337-347.Liu X X,Wu X Q,Zhang D X.Distyly and heteromorphic self-incompatibilityofHedyotispulcherrima(Rubiaceae)[J].Biodiversity Science,2012,20(3):337-347.
[17]何亚平,刘建全.植物繁育系统研究的最新进展和评述[J].植物生态学报,2003,27(2):151-163.He Y P,Liu J Q.A review on recent advances in the studies of plant breeding system[J].Acta Phytoecologica Sinica,2003,27(2):151-163.
[18]刘建新,胡浩斌,王鑫.多裂骆驼蓬水浸液对多年生黑麦草的化感作用与生理生化表现[J].草地学报,2008,16(4):374-379.Liu J X,Hu H B,Wang X.Study on allelopathy of aqueous extract fromPeganum multisectum(Maxim.)Bobr.onPerennial ryegrass(Lolium perenneL.)and its physiologicalbiochemical manifestation[J].Acta Agrestia Sinica,2008,16(4):374-379.
[19]黄双全,郭友好.传粉生物学研究进展[J].科学通报,2000,45(3):225-237.
[20]关文灵,李叶芳,陈贤,等.蝴蝶花花器结构和开花授粉生物学特性[J].园艺学报,2009,36(10):1485-1490.Guan W L,Li Y F,Chen X,et al.Flower structure and biological characteristics of flowering and pollination inIris japonicaThunb.[J].Acta Horticulturae Sinica,2009,36(10):1485-1490.
[21]魏岩,尹林克,严成.白梭梭开花及风媒传粉特点[J].干旱区研究,2005,22(1):85-89.Wei Y,Yin L K,Yan C.Study on the flowering and pollination characteristics ofHaloxylon perisicum[J].Arid Zone Research,2005,22(1):85-89.
[22]Castellanos M C,Wilson P,Keller S J,et al.Anther evolution:pollen presentation strategies when pollinators differ[J].The American Naturalist,2006,167(2):288-296.
[23]Harder L D,Wilson W G.Floral evolution and male reproductive success:Optimal dispensing schedules for pollen dispersal by animal-pollinated plants[J].Evolutionary Ecology,1994,8(5):542-559.
[24]Gong Y B,Huang S Q.Interspecific variation in pollenovule ratio is negatively correlated with pollen transfer efficiency in a natural community[J].Plant Biol,2014,16(4):843-7.
[25]陈河龙,孙桂枝,张耿,等.中间锦鸡儿的开花习性研究[J].草业科学,2006,23(3):51-55.Chen H L,Sun G Z,Zhang G,et al.Study on the flowering habit ofCaragana intermediaKuang[J].Pratacultural Science,2006,23(3):51-55.
[26]Widen B.Environmental and genetic influences on phenology and plant size in a perennial herb.Senecio integriflorus[J].Canadian Journal of Botany,1991,69(69):209-217.
