牛病毒性腹泻病毒(BVDV)E0蛋白原核表达及间接ELISA方法的建立
2018-05-28丁金花马旭升蔡卓轩肖盛中吴鹏盛金良陈创夫
丁金花 ,马旭升 ,蔡卓轩 ,肖盛中 ,吴鹏 ,盛金良 ,陈创夫
(1石河子大学动物科技学院,新疆 石河子 832003;2石河子大学生命科学学院,新疆 石河子 832003)
牛病毒性腹泻/粘膜病(Bovine viral diarrheamucosal disease,BVD-MD)是由牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV)引起的传染病[1],各种年龄的牛均易感染、以犊牛易感性最高,同时对山羊和绵羊均存在持续性感染。给我国乃至全球养殖产业带来了严重的经济损失[2]。BVDV之所以无法消除,一个重要的原因就是持续性感染(PI)动物的存在[3]。考虑到PI动物为病毒传播提供了重要的条件,控制BVDV的关键因素是识别和消除PI动物[4]。
在全球范围内,消除牛病毒性腹泻病毒(BVDV)仍处于起步阶段[5]。虽然BVDV感染可以从临床症状中来确诊,但由于病毒的基因型不同以及病程不同使得临床症状表现出差异[6],尤其是持续性感染牛通常无明显的临床症状,给诊断带来了不便并使诊断结果变得不可靠[7]。在已经建立的诊断方法中,如病毒分离、免疫组化、核酸检测、病毒中和实验等均因其工作量大、需要专业人员和仪器等条件的制约,而无法在牧场推广应用[8]。而另外一种检测方法酶联免疫吸附试验(ELISA)因其操作简单、快速、灵敏、特异性而被广泛应用。
在BVDV病毒的结构蛋白中,E0是BVDV编码蛋白中保守性很高的蛋白,其含有中和表位,可产生的中和抗体具有中和BVDV和CSFV的能力[9]。通过对E0氨基酸序列的分析,可得知E0中含有一段保守较高的结构区域[10],这使得E0在研究制备基因工程亚单位疫苗以及作为基因工程诊断的抗原中担任了重要的角色。
在本研究中,首先对E0基因进行原核表达载体的构建,获得E0蛋白。通过方阵滴定法初步建立了检测BVDV血清抗体的间接ELISA方法,对收集的约88份血清样品进行了检测,并与商品化的国外试剂盒检测结果进行比对,以期为检测BVDV提供了一种方法并为试剂盒的标准化奠定基础。
1 材料与方法
1.1 材料
pACNR/NADL质粒由石河子大学人畜共患病实验室保存,BVDV阳性血清和阴性血清购自中国兽药监察所,牛布鲁氏菌病阳性血清、牛传染性鼻气管炎病毒阳性血清、牛支原体阳性血清、牛副结核阳性血清和口蹄疫病毒阳性血清匀由本实验室保存,HRP标记的兔抗牛IgG购自北京博奥森;96微孔板购自Costar公司,脱脂奶粉,牛血清白蛋白(BSA),明胶,TMB显色液,酶标仪。
1.2 方法
1.2.1 引物的合成
根据GenBank中公布的E0基因序列(登录号:NC_001461.1),用 Primer 5.0软件设计2对引物,上、下游引物分别引入BglⅡ、SalⅠ限制性内切酶位点,Erns基因上游:5'AGATCTGGAAAACATAACACAGTGG3', 下 游 :5'GTCGACAGCGTATGCTCCAAAC 3'下划线部分分别为BglⅡ、SalⅠ酶切位点。引物由上海生工生物技术有限公司合成。
1.2.2 目的基因的扩增
以pACNR/NADL质粒为模板,PCR扩增 Erns,扩增体系如下:ddH2O 9.7 μL,上下游引物各 0.4 μL,模板 2.0 μL,Mix 12.5 μL。
反应条件为:预变性95℃ 5min,94℃ 30 s,61 ℃ 35 s,72 ℃ 90 s,30个循环;最后 72 ℃延伸7 min,置4℃保存。1%琼脂糖凝胶电泳检测,DNA琼脂糖凝胶回收试剂盒回收产物,备用。
1.2.3 pET-32a-E0表达载体的构建及鉴定
通过限制性酶切位点 BglⅡ、SalⅠ将载体pET-32a(+)双酶切,回收酶切产物。用T4 DNA连接酶将E0基因与回收的pET-32a(+)载体在16℃进行过夜连接。次日,将连接产物转入DH5α感受态细胞中,涂布于LB固体培养基上(含100 μg/mL氨苄青霉素)37℃过夜培养。采用BglⅡ、SalⅠ进行双酶切验证,将阳性克隆送公司测序。
1.2.4 E0蛋白的表达与检测
将测序成功的pET-32a-E0质粒转化到 BL21(DE3)感受态细胞中,然后均匀涂布到 LB平板上(含100 μg/mL的氨苄青霉素),之后倒置于37℃培养箱过夜。从转化的平板中挑选单克隆,接种到4 mL的 LB培养基中(含 100 μg/mL的氨苄青霉素),待培养至 OD600nm为 0.5-0.8,取出 1 mL菌液备用。向试管培养液中加入终浓度 0.1 mmol/L IPTG,分别诱导 2、4、6、8 h。
1.2.5 重组E0蛋白的纯化与Western-Blot检测
将得到的全菌蛋白用蛋白纯化仪进行纯化,然后将纯化的目的蛋白E0用SDS-PAGE和Western-Blot进行检测。
1.2.6 间接ELISA方法的建立
将纯化好的E0蛋白用包被液稀释成一定浓度,加入96微孔板中,每孔100 μL,37℃包被2 h。取出包被好的微孔板,弃去包被液,用1%PBST洗涤4次。加入封闭液100 μL/孔,37℃恒温箱封闭一定时间。洗涤同上,将待检血清(阳性和阴性)稀释一定比例,加入96微孔板中100 μL/孔,37℃恒温箱孵育一定时间。用1%PBST洗4次,将稀释好的酶标二抗100 μL/孔加入酶标板中,置于37℃恒温箱孵育一定时间。洗涤同上,加入TMB显色液,100 μL/孔,37℃恒温箱孵育一定时间。浓硫酸终止50 μL/孔。酶标仪测OD450nm。
1.2.7 特异性实验
用已建立的间接ELISA方法检测牛布鲁氏菌病阳性血清、牛传染性鼻气管炎病毒阳性血清、牛支原体阳性血清、牛副结核阳性血清和口蹄疫病毒阳性血清作最佳稀释度稀释,同时做BVDV阳性和阴性血清对照,按照间接ELISA操作方法测定 OD450nm。
2017年7月以来,按照中央环保督察反馈意见和整改方案,湖南省委书记、省长先后21次主持召开与中央环保督察整改工作有关的会议,9次深入整改一线调研督导,20次对环保督察整改工作做出批示,督促地方加快解决突出环境问题。各地坚持高位推进,集中资源,倒排工期,全力推进整改攻坚,加快解决了一批长期未得到有效解决的突出问题。
1.2.8 灵敏性实验
将阳性血清做梯度稀释 1∶50、1∶100、1∶200、1∶400、1∶800、1∶1600、1∶3200,其他条件不变,按照已建立的间接ELISA操作方法测定OD450nm,检测其灵敏度。
1.2.8 商品化试剂盒的比较
应用本研究建立的间接ELISA方法与和美国IDEXX公司的牛病毒性腹泻病毒抗体检测试剂盒比较,同时检测来自不同牧场的88份牛血清样品,对检测结果进行卡方检验。

图1 PCR扩增的Erns基因Fig.1 PCR amplification of Ernsgene
2 结果与分析
2.1 目的基因的扩增及pET-32a-E0表达载体的鉴定
PCR扩增产物用1%琼脂糖凝胶电泳检测,结果从pACNR/NADL中得到与预期大小相符的目的片段条带(图1);将构建成功的pET-32a-E0载体用酶BglⅡ和SalⅠ切割,得到2条DNA带分别为683和5900 bp(图 2)。

图2 pET-32a-Erns重组表达质粒鉴定Fig.2 pET-32a-ErnsIndetification of the recombinant expressed plasmid
2.2 E0基因的表达、纯化和Western-Blot检测
结果如图3和图4所示。

图3 pET-32a-Erns表达产物的SDS-PAGE分析Fig.3 pET-32a-ErnsSDS-PAGE profile of expressed product
将重组菌诱导表达 2、4、6、8 h产物以及未诱导的菌体进行SDS-PAGE检测,结果发现未诱导的菌液未检测到表达蛋白,经0.1 mmol/L IPTG诱导的菌在45 kD处有蛋白条带且在6和8 h表达量最高(图3)。Western-Blot检测结果表明该条带与预期45 kD大小的蛋白一致(图4)。
2.3 间接ELISA条件优化
2.3.1 抗原包被浓度和血清稀释比
按常规ELISA方法进行方阵滴定实验,然后用酶标仪测其OD450nm。结果显示,抗原E0包被量为5μg/mL、血清稀释比为 1∶10时,阳性血清OD450nm接近1.0,阴性血清值最小,且P/N的值最大,结果见表1。
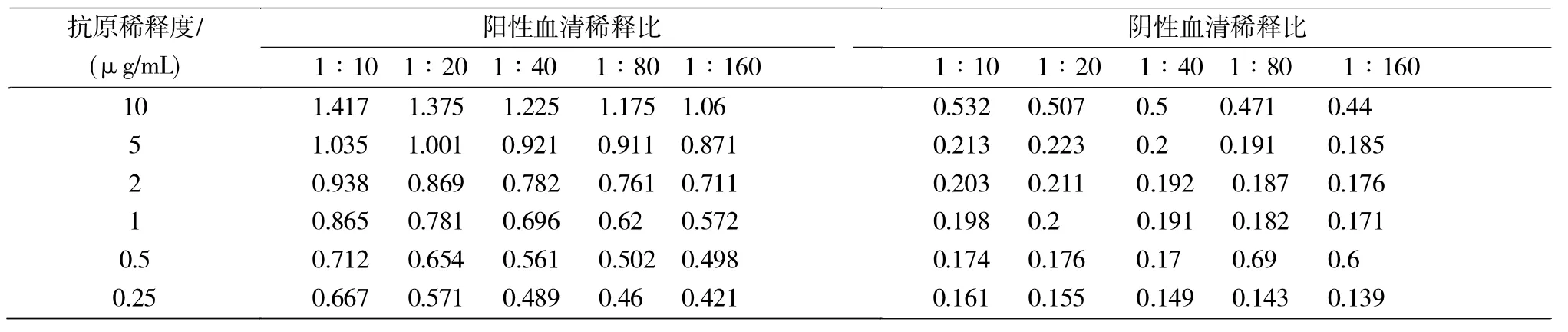
表1 抗原包被浓度和血清稀释比测定Tab.1 The concentration of antigen and serum dilution ratio were determined
2.3.2 最佳封闭液和封闭时间的确定
分别以5%脱脂奶粉、2%牛血清白蛋白(BSA)、1%明胶作为封闭液,加入微孔板中,100 μg/mL,37℃恒温箱孵育2 h。

表2 封闭液的确定Tab.2 Determination of optional blocking solution

表3 封闭时间的确定Tab.3 Determination for blocking time
2.3.4 酶标二抗稀释倍数及作用时间
将HRP标记的兔抗牛IgG进行稀释,稀释倍数为 1∶5000、1∶6000、1∶7000、1∶8000、1∶10000,每孔 100 μL,37℃恒温箱孵育 0.5、1.0、1.5 和 2 h。按常规ELISA方法进行实验。结果显示,酶标二抗稀释比为1∶8000,且孵育时间为30min时结果最佳,结果见表4和表5。

表4 酶标二抗最佳稀释度的确定Tab.4 Determination for optimum rabbit anti-mouse IgG/HRP concentration

表5 酶标二抗最佳作用时间的选择Tab.5 The optimized incubation period of the labeled antibody
2.3.5 临界值的确定
经血凝试验检测均为牛病毒性腹泻病毒阴性的30份血清,测定其OD450nm值并进行统计学分析。计算得到30份阴性血清OD450nm值平均值(X)和标准差(S)分别为0.2215和0.033,那么样品临界值X+2S为0.278,结果如表6所示。

表6 间接 ELISA阴阳性临界值的确定Tab.6 Determination of the threshold for ELISA
2.4 特异性实验
用该方法建立的间接ELISA检测牛常见病毒和细菌,结果显示该方法具有良好的特异性,结果见表7。

表7 ELISA特异性试验结果Tab.7 Result of specific test for indirect ELISA
2.5 灵敏性实验
用本文已建立的间接ELISA检测7个稀释度,结果发现血清稀释比为1∶1600时,仍检测为阳性(表8),说明该间接ELISA方法具有较好的灵敏性。

表8 间接 ELISA敏感性试验结果Tab.8 Result of indirect ELISA sensitivity test
2.6 商品化试剂盒的比较
用间接ELISA和IDEXX试剂盒检测88份临床血清,结果显示2种方法的符合率为86%。对检测结果进行统计分析,结果见表9。检测结果用SPSS19.0统计软件进行配对四格表卡方检验,计算得到P=0.064>0.05,无显著性差异。

表9 血清样品的间接ELISA与IDEXX试剂盒检测方法比较Tab.9 The comparision of serum detection by indirect ELISA and IDEXX
3 讨论
BVDV是单股正链RNA病毒,属于黄病毒科瘟病毒属[9]。自从1946年第一次在北美牛体中分离出BVDV以来[11],在其病毒学、流行病学和病理学特征上已经取得了很大的进步,使BVDV成为全世界最重要的牛病毒病原体之一[12]。根据国家相关规定BVDV的检查方法均为细胞培养法和免疫荧光抗体检查法[13],但该方法过程较繁琐且耗时长,检测结果滞后;并且血样中如果有抗体存在就会大大降低病毒的检出率,导致假阴性的出现,不利于生产过程中的质量控制。在大多数情况下,ELISA检测方法却得到了广泛的推广。
ELISA检测法作为经典的血清学检测方法[14],在国内外广泛应用。自20世纪90年代初以来,市面上已有一些用于检测BVDV特异性抗体的ELISA试剂盒。这种方法之所以被广泛应用,其原因为:它们独立于细胞培养,可较容易地应用于大规模快速检测[15]。此法简单快速,且特异性良好,但鉴于制备特异性抗原困难,并且假阳性、假阴性问题的存在,使本方法在实际应用上受到限制。
BVDV国际标准检测试剂盒基本上被国外公司垄断,价格昂贵,购买周期太长,不适用于中小型养殖场和散养户。因此,有必要建立一种良好的ELISA方法为国产ELISA试剂盒做技术储备。新疆是我国主要的畜牧业生产基地,也是该病流行的主要地区之一。研制出一种适用于新疆本地流行株的检测方法对新疆的养殖业至关重要。另外,在BVDV结构蛋白中E0是保守性很高的蛋白,在不同的毒株中变异系数很低[16],更适合做为包被抗原。
本研究中成功获得特异性抗原E0,并以此为基础建立了间接ELISA方法。用建立的间接ELISA和IDEXX试剂盒对在克拉玛依地区采集的88份牛血清进行检测,二者符合率为86%,用四格表卡方检验分析,P=0.064>0.05,2种方法无显著性差异,该方法的建立基本可以用于实验室临床检测。但就目前的技术水平,较高的BVDV抗体阳性率仅代表牛群中血清抗体阳性率的高低,不能准确反应牛群对该病的免疫保护率,其原因可能是牛群正处于疾病感染阶段,另外,血清抗体为阴性的也可能是持续性感染的牛,需结合实际生产进行分析判断。
[1]王兰东,冯东晓,张淑敏,等.牛病毒性腹泻病毒研究进展[J].生物技术通讯,2016,27(3):453-458.
[2]韩猛立,黄新,钟发刚,等.牛病毒性腹泻病流行现状与防制[J].中国奶牛,2010,12(3):35-38.
[3]Donis R O,Corapi W V,Dubovi E J,et al.Bovine viral diarrhea virus proteins and their antigenic analyses[J].Archives of Virology Supplementum,1991,3(3):29.
[4]Ammari M,MccarthyF M,NanduriB,etal.Analysisof bovine viral diarrhea viruses-infected monocytes:identification of cytopathic and non-cytopathic biotype differences[J].Bmc Bioinformatics,2010,11(6):9-17.
[5]Lang Q,Wang F,Yin L,et al.Specific probe selection from landscape phage display library and its application in enzyme-linked immunosorbent assay of free prostate-specific antigen[J].Analytical Chemistry,2014,86(5):2767-2774.
[6]Giammarioli M,Ceglie L,Rossi E,et al.Increased genetic diversity of BVDV-1:recent findings and implications thereof[J].Virus Genes,2015,50(1):147.
[7]Deng M,Ji S,Fei W,et al.Prevalence study and genetic typing of bovine viral diarrhea virus(BVDV)in four bovine species in China[J].PlosOne,2015,10(4):121-137.
[8]Ellis J A,Martin K,Norman G R,et al.Comparison of detection methods for bovine viral diarrhea virus in bovine abortions and neonatal death[J].Journal of Veterinary Diagnostic Investigation Official Publication of the American Association of Veterinary Laboratory Diagnosticians Inc,2014,7(4):433.
[9]Mayo M A.A summary of taxonomic changes recently approved by ICTV[J].Archives of Virology,2002,147(8):1655-1663.
[10]刘军,尹惠琼,颜仁和,等.牛病毒性腹泻病毒E0基因重组慢病毒载体构建和鉴定[J].中国预防兽医学报,2015,37(5):357-360.Liu J,Yin H Q,Yan R H,et al.Construction and identification of lentiviral vector for bovine viral diarrhea virus E0 gene[J].Chinese Journal of Preventive Veterinary Medicine,2015,37(5):357-360.
[11]Pinior B,Firth C L,Richter V,et al.A systematic review of financial and economic assessments of bovine viral diarrhea virus (BVDV)prevention and mitigation activities worldwide[J].Preventive Veterinary Medicine,2017,137(7):77-92.
[12]Lanyon S R,Hill F I,Reichel M P,et al.Bovine viral diarrhoea:pathogenesis and diagnosis[J].Veterinary Journal,2014,199(2):201-209.
[13]李文文,刘情,刘亚刚,等.牛病毒性腹泻病毒间接ELISA方法的建立[J].中国畜牧兽医,2015,42(3):558-562.Li W W,Liu Q,Liu Y G.Establishment of indirect ELISA method of bovine viral diarrhea virus[J].China Animal Husbandry&Veterinary Medicine,2015,42(3):558-562.
[14]Duncan A J,Gunn G J,Humphry R W,et al.Difficulties arising from the variety of testing schemes used for bovine viral diarrhoea virus(BVDV)[J].Veterinary Record,2016,178:123-134.
[15]Sandvik T.Selection and use of laboratory diagnostic assays in BVD control programmes[J].Preventive Veterinary Medicine,2005,72(1):3-16.
[16]Diéguez F J,Cervi o M,Yus E,et al.Bovine viral diarrhea virus (BVDV)genetic diversity in Spain:A review[J].Spanish Journal of Agricultural Research,2017,15(2):23-28.
