新疆哈萨克羊NYD-SP27基因的克隆及序列分析
2018-05-28加米拉吐尔逊陈云蕾吾热力哈孜哈孜汗马亚茹赛务加甫
加米拉·吐尔逊,陈云蕾,吾热力哈孜·哈孜汗,马亚茹,赛务加甫
(石河子大学动物科技学院,新疆 石河子832003)
哺乳动物精子受精前需要在雌性生殖道内停留一段时间,期间精子的形态和生理会发生必要的变化[1-3],这样精子就会具备受精所需的能力,这个过程称之为获能。获能后的精子的代谢加强,主要表现包括活力增强,呼吸率增高、耗氧量增多以及尾部线粒体内氧化磷酸酶功能旺盛等[4-6]。
研究发现该过程参与的并发挥作用的基因编码蛋白数量约为1000种[7-11],只有保证需要相关蛋白分子的适时表达,才能够使精子结构完整,并且可以将正确的基因和表观遗传信息传给子代[12]。精子及时获能和产生顶体反应在自然受精过程中很重要,同样维持精子在受精前未获能状态也非常关键。PLCζ在生殖发育中意义重大,其对精子的发生发育及卵母细胞激活等相关研究已成为生殖发育的研究热点[13-14]。
家畜中的不孕症一直都是比较重大的疾病之一[15]。PLCζ家族中的睾丸发育特异性蛋白-27基因(testis development specific protein gene 27,NYD-SP27),被认为是一种新的精子内源性去能因子,在家畜的不孕症方面起到非常大的作用[16],但目前NYD-SP27在绵羊精子获能中的作用未见相关报道。本研究在克隆新疆哈萨克羊NYD-SP27基因并在此基础上对其进行序列分析,旨在为NYD-SP27基因表达调控研究提供科学数据,为揭示NYD-SP27在绵羊精子发生及获能中的作用机制提供参考依据。
1 材料与方法
1.1 材料
1.1.1 菌株、载体及动物组织
克隆载体pMD19-T及DH5α感受态细胞由新疆兵团动物重大疫病防控重点实验室保存,绵羊睾丸组织采自石河子大学动物科技学院动物医院。挑选2周岁健康哈萨克公羊,屠宰并取出睾丸组织,将其装入病料袋。
1.1.2 主要试剂
质粒小提试剂盒、琼脂糖凝胶回收试剂盒购自北京天根科技有限公司;Transzol up RNA提取试剂盒、离心TransStart FastPfu Fly DNA Polymerase购自北京全式金公司;ExTaqDNA聚合酶,DL2000分子量标准,T4 DNA 连接酶、PrimeScript RT reagent Kit、RNA酶抑制剂、TaKaRa MiniBESTTMDNA Fragment Purification Kit Ver.4.0等均购自大连宝生物工程有限公司。
1.1.3 主要仪器和设备
微量移液器 (Eppendorf公司)、超净工作台(ZHJH-1112)、水浴锅(DKB-501A)、摇床(HZQ-X100)、超速离心机 (eppendorf,centrifuge-5415D);去离子水机、NanoDrop 2000微量分光光度计、匀浆机(QIZGEN、Tissuelyser II)。
1.2 方法
1.2.1 引物设计与合成
根据GenBank中人NYD-SP27序列(登录号:AY035866.1),利用Primer5.0软件设计引物NYD-F和NYD-R,扩增该基因完整的ORF区。比对分析后获得绵羊NYD-SP27基因序列,将该序列上传至NCBI数据库(登录号:KX905090),根据该基因序列设计合成引物P2A-Flag-NYDSP-F和P2A-Flag-NYD SP-R。以上引物合成由生工生物工程(上海)股份有限公司合成,引物序列见表1。
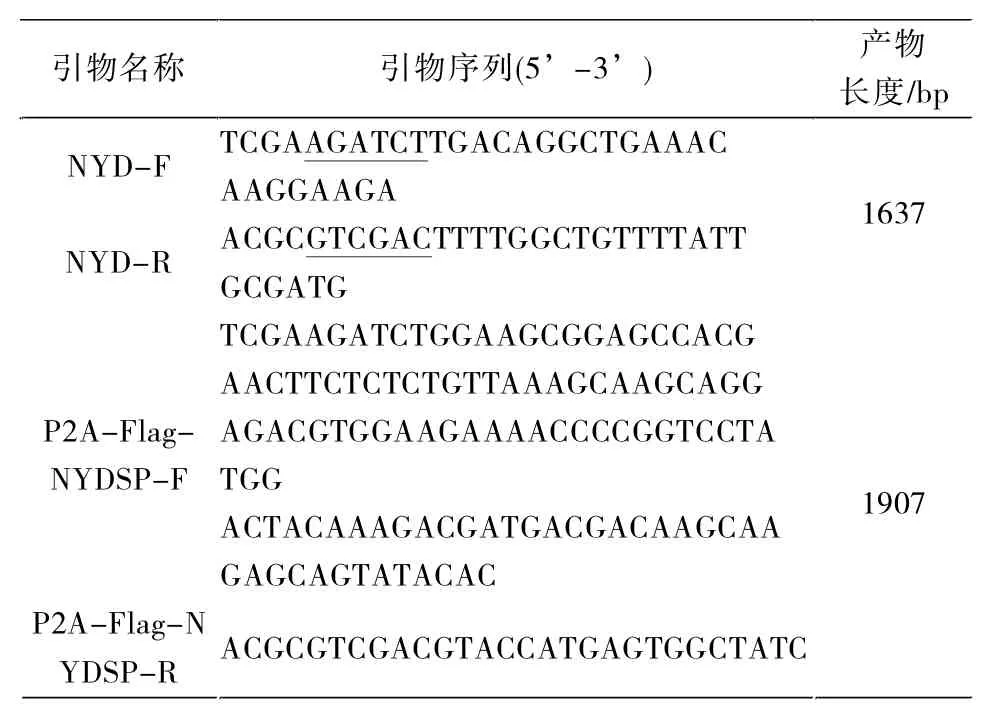
表1 实验中所需引物Tab.1 primers used in the study
1.2.2 总RNA的提取
先将采集的绵羊睾丸组织剪成小块分装在2 mL冻存管中,保存于液氮中待用;然后迅速称量取出约500mg组织块,置于DEPC水泡过的研钵中,多次加入适量液氮迅速进行研磨直至研磨成粉末状,之后将其转移至1.5mL的无RNase离心管中,加入1 mL的Transzol up并按照总RNA提取试剂盒抽提睾丸组织总RNA,最后用NanoDrop 2000测定浓度并置于-80℃,保存备用。
1.2.3 cDNA制备
将 RNA 模板、5×PrimeScript Buffer、PrimeScript RT Enzyme Mix I、Oligo dT Primer、Random 6 mers和RNase Free dH2O置于冰上溶解后,将RNA模板量定为1 μg,总体积为20 μL,按照既定的合成体系(表2)加样混合,并根据产品使用说明书中的操作步骤,用PCR仪进行反转录:37℃ 条件下进行反转录反应5min,85℃ 条件下持续8 s使反转录酶失活,瞬时离心,置于冰上冷却后置于-20℃保存,备用。

表2 cDNA合成反应体系Tab.2 Reaction system of synthetising cDNA
1.2.4 哈萨克羊NYD-SP27的PCR扩增和纯化
1.2.4.1 目标基因的扩增
由于真核生物基因中自身含有内含子,故采用RT-PCR法克隆目的片段。以反转录的睾丸组织cDNA作为模版,采用所设计的特异性引物,使用TransStart FastPfu Fly高保真酶扩增绵羊NYD-SP27基因,扩增体系为25 μL,其中 2×Mix 12.5 μL、cDNA 2 μL、上下游引物(100 μmol/L)各 2 μL、补充去离子水至25 μL。反应条件:95℃ 5min;94℃40 s;61 ℃ 40 s;72 ℃ 2 min;35个循环;72 ℃延伸8 min。
1.2.4.2 目标基因的纯化及末端加A
将扩增的目的基因取出2 μL用1%的琼脂糖凝胶电泳检测,如果检测有特异性条带,则将剩余的扩增产物根据Takara MiniBEST DNA Fragment Purification Kit说明书进行纯化。目标基因纯化后,为了增加连接效率需末端加A。按照以下体系混合样品:将纯化后的目的基因片段 30 μL,TaqDNA聚 合 酶 1 μL,dNTP 3 μL,Buffer 3 μL,ddH2O 13 μL。将混合好的样品放入PCR仪中,设置程序为72℃ 20min。
1.2.4.3 琼脂糖凝胶电泳检测
将加A后的目的片段,加入10 μL的Loading Buffer,用1%的琼脂糖凝胶电泳检测。若检测有大小合适的目标条带,进一步从凝胶中切下目的DNA条带,切胶时要迅速并且切的尽量薄,放入无菌的离心管中,进行回收纯化。
1.2.5 PCR产物的克隆与鉴定
把RT-PCR产物切胶回收后,依据PCR胶回收纯化试剂盒说明书进行对目的基因的回收纯化试验。将回收纯化的目的基因片段与pMDl8-T载体按照说明书要求和条件进行充分混匀,待混匀后密封避光于16℃水浴锅中进行连接反应,待连接反应12 h后,将连接产物按照说明书和实验要求进行转化试验。将转化至DH5a感受态细胞中的连接产物,于含抗生素的固体平板培养基上培养12-16 h,后观察平板菌落,根据需要筛选单个、大小合适的阳性克隆菌落。为了保证后续实验的准确性以及实验所要求的严谨性,还需对克隆的菌株进行扩增培养,并对克隆菌落采用菌液PCR和酶切等方法鉴定,最后将初步鉴定正确的菌株或者质粒送至上海生工进行序列检测,最终确保结实验结果的可靠性和真实性。
1.2.6 序列测定及分析
将鉴定为阳性的克隆株由上海生工生物工程有限公司进行 DNA测序。利用 DNAman、DNAStar、Chromas等软件,将所得到的cDNA序列与GenBank数据库中近缘物种NYD-SP27基因序列进行序列比对分析。
2 结果与分析
2.1 总RNA的分离
所分离总RNA A260/A280为1.9,琼脂糖凝胶电泳后清晰可见18S和28S 2条核糖体RNA条带(图1),说明睾丸组织总RNA提取过程中未发生降解。
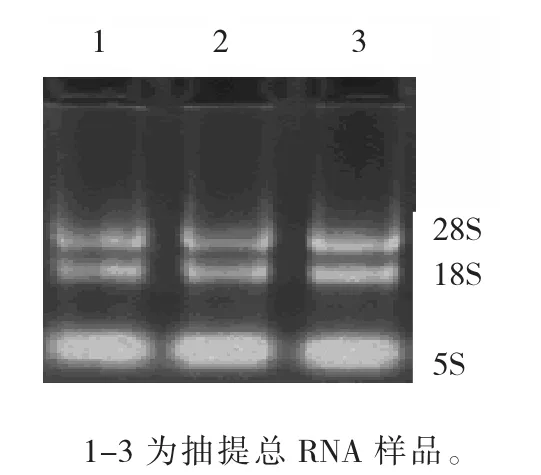
图1 总RNA琼脂糖凝胶电泳Fig.1 Agarose electrophoresisof total RNA
2.2 哈萨克羊NYD-SP27基因编码区的克隆
提取的哈萨克羊睾丸组织中的总RNA,用琼脂糖凝胶电泳检测RNA(图1)的完整性,并且测定A260/A280为1.89。将总RNA反转录的cDNA,以cDNA为模板,以特异性引物扩增目的基因,扩增产物经纯化、末端加A后,用1%琼脂糖凝胶电泳进行检测分析,出现特异性条带(图2),条带大小为1000-2000 bp。

图2 哈萨克羊NYD-SP27基因的PCR扩增Fig.2 PCR amplification of ovine NYD-SP27 gene
2.3 哈萨克羊NYD-SP27基因序列分析结果
将通过高保真酶扩增的目的基因,与pMD19-T连接后,挑选大量的单克隆菌落,进行PCR验证(图3),大量测序,通过分析比对,获取哈萨克羊该基因的序列。确认无误后,向NCBI提交该基因序列(登录号:KX905090)。在 NCBI上对绵羊 NYD-SP27基因的结构域进行分析,发现哈萨克羊NYD-SP27基因的保守结构域(图4)和人类的NYD-SP27(登录号:AY035866)一致,均含有2个EF结构域,1个PI-PLC结构域(图5)。1个C2结构域。NYD-SP27保守结构域与人源的PLCZ1的保守结构域(图6)分析后发现缺少1个EF手型结构域。经过分析,哈萨克羊NYD-SP27基因属于PLCζ家族,基因全长1901 bp,其中只含有1617 bp组成的开放阅读框(ORF),其起始密码子为ATG,终止密码子为TAG,共编码538个氨基酸(图 7);相对分子质量 61995.66,理论 PI值为6.16,正电荷残基数(Arg+Lys)为 61,负电荷残基数(Asp+Glu)为 67;分子式 C2798H4319N737O819S19;体外半衰期为30 h,不稳定系数46.96(不稳定);总平均吸水性-0.403。
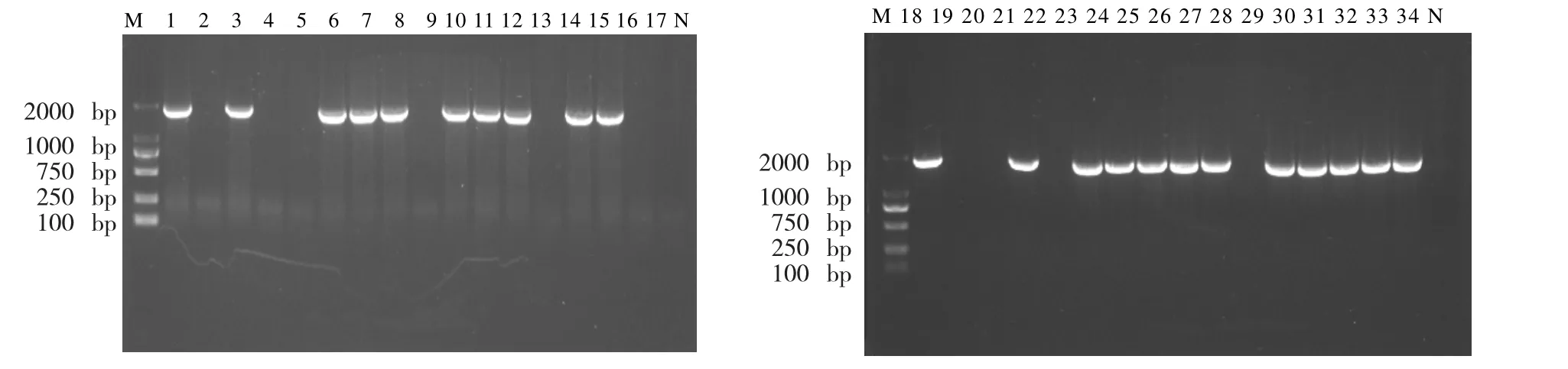
图3 单克隆菌株菌液PCR验证Fig.3 Detection of monoclonal strains by PCR
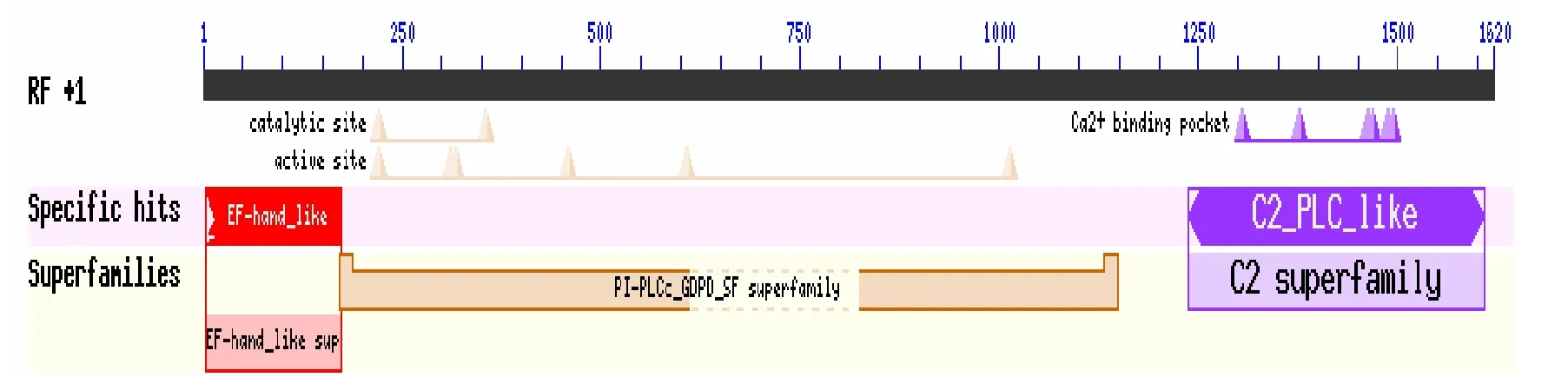
图4 哈萨克羊NYD-SP27保守结构域Fig.4 Conserved domain of ovine NYD-SP27
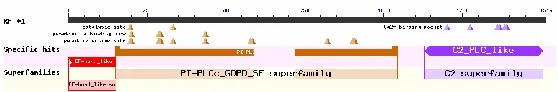
图5 人源NYD-SP27保守结构域Fig.5 Conserved domain of human NYD-SP27
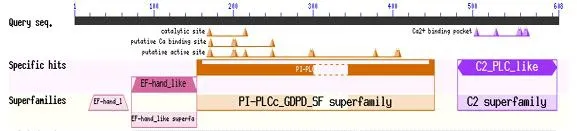
图6 人源PLCZ1保守结构域Fig.6 Conserved domain of human PLCZ1
3 讨论
本研究用高保真酶扩增哈萨克羊NYD-SP27基因,确保其扩增序列的准确性,之后通过对新疆多个样品的测序分析,获得其完整的编码序列,对哈萨克羊NYD-SP27基因的保守结构域分析发现哈萨克羊NYD-SP27和人类的NYD-SP27结构域类似。以往的研究发现人和小鼠的NYD-SP27基因与PLCZ1相比缺少N端的EF手型结构域,EF手型结构域是Ca2+结合位点,缺少后会造成结合Ca2+能力下降,之前人们对绵羊PLCζ的功能进行研究,发现它能够引起卵母细胞内Ca2+震荡,从而激活卵母细胞。这些结构上的差异可能是造成NYD-SP27基因与PLCζ功能的不同所在,也可能是其抑制PLC的原因。
相关的研究报道指出一种磷脂酶C的亚型NYD-SP27是一种内源性的去能因子,研究证实其在胰腺中发挥抑制PLC偶联的Ca2+的动员作用,其后的研究中还证明抑制NYD-SP27的表达可导致ATP刺激的Ca2+依赖性胰腺阴离子分泌的增强[16]。研究发现该蛋白定位于精子的顶体部,能够在获能和顶体反应的过程中逐渐的丢失。从获能培养液中去除HCO-3获能活化因子,可使NYD-SP27不再丢失,同样NYD-SP27的特异性抗体也会抑制NYD-SP27的丢失并能够显著的降低ATP和孕酮诱导的获能和顶体反应的精子的数量,同时还能够抑制精子内的激动剂诱导的PLC偶联的钙离子动员[17],而这些结果与PLC抑制剂的作用相似。由此,我们可以推测出PLC生理性的抑制剂NYD-SP27,作为精子内源性的去能因子防止获能和顶体反应的提前发生。

图7 新疆哈萨克羊NYD-SP27基因cDNA序列以及推倒的氨基酸序列Fig.7 cDNA sequence and amino acid sequence of NYD-SP27 gene in Xinjiang Kazakh sheep
[1]贺亚南,朱化彬,陈晓丽,等.哺乳动物精子获能前后的理化变化及获能机制研究进展 [J].畜牧兽医学报,2013,44(12):1867-1873.He Y N,Zhu H B,Chen X L,et al.Advance of capacitation mechanism and the physiochemical changes of sperm before and aftercapacitation ofmammalian[J].Chinese Journal of Animal& Veterinary Sciences,2013,44(12):1867-1873.
[2]石其贤,袁玉英.精子获能及其发展[J].生理科学进展,1998(3):243-245.Shi Q X,Yuan Y Y.Sperm capacitation and its development[J].Advances in Physiological Science,1998(3):243-245.
[3]Yanagimachi R.In vitro capacitation of golden hamster spermatozoa by homologous and heterologous blood sera[J].Biology of Reproduction,1970,3(2):147-153.
[4]罗玉香,刘杰森,刘学高.人类精子膜抗原的生殖免疫学研究[J].暨南理医学报,1985(3):86-88,90-93.Luo Y X,Liu J S,Liu X G.Repoductive immunological studies on human sperm membrane antigen[J].Journal of Science and Medicine of Jinan University,1985(3):86-88,90-93.
[5]Purdy P H,Graham J K.Effect of adding cholesterol to bull sperm membranes on sperm capacitation,the acrosome reaction,and fertility1[J].Biology of Reproduction,2004,71(2):522-527.
[6]Visconti P E.Understanding the molecular basis of sperm capacitation through kinase design[J].Proceedings of the National Academy of Sciences of the United States of America,2009,106(3):667-668.
[7]Cyr D G.Connexins and pannexins:Coordinating cellular communication in the testis and epididymis[J].Spermatogenesis,2011,1(4):325-338.
[8]Hermo L,Pelletier R M,Cyr D G,et al.Surfing the wave,cycle,life history,and genes/proteins expressed by testicular germ cells.Part 1:background to spermatogenesis,spermatogonia,and spermatocytes[J].Microscopy Research&Technique,2010,73(4):241.
[9]Hermo L,Pelletier R M,Cyr D G,et al.Surfing the wave,cycle,life history,and genes/proteins expressed by testicular germ cells.Part 4:Intercellular bridges,mitochondria,nuclear envelope,apoptosis,ubiquitination,membrane/voltagegated channels,methylation/acetylation,and transcript[J].Microscopy Research&Technique,2010,73(4):364-408.
[10]Hermo L,Pelletier R M,Cyr D G,et al.Surfing the wave,cycle,life history,and genes/proteins expressed by testicular germ cells.Part 3:developmental changes in spermatid flagellum and cytoplasmic droplet and interaction of sperm with the zona pellucida and egg plasma membrane[J].Microscopy Research&Technique,2010,73(4):320-363.
[11]Hermo L,Pelletier R M,Cyr D G,et al.Surfing the wave,cycle,life history,and genes/proteins expressed by testicular germ cells.Part 2:changes in spermatid organelles associated with development of spermatozoa[J].Microscopy Research&Technique,2010,73(4):279-319.
[12]葛少钦,康现江,刘桂荣,等.精子发生过程中的相关基因[J].遗传,2008,30(1):3-12.Ge S Q,Kang X J,Liu G R,et al.Genes involved in spermatogenesis[J].Hereditas,2008,30(1):3-12.
[13]Saunders C M,Larman M G,Parrington J,et al.PLCζ:a spermspecific trigger of Ca2+oscillations in eggs and embryo development[J].Development,2002,129(15):3533-3544.
[14]邓敏,梁光华,徐雷,等.理囊散治疗卵泡囊肿不孕奶牛血清微量元素与激素的相关性分析[J].石河子大学学报(自然科学版),2013,31(5):592-596.Deng M,Liang G,Lei X U,et al.The correlation analysis of trace elements and hormones in serum of follicular cyst dairy cattle treated by cyst-regulating powder[J].Journal of Shihezi University(Natural Science),2013,31(5):592-596.
[15]Nomikos M,Elgmati K,Theodoridou M,et al.Novel regulation of PLCζ activity via its XY-linker[J].Biochemical Journal,2011,438(3):427-432.
[16]Zhu J X,Yang N,Zhu H,et al.Effect of NYD-SP27 downregulation on ATP-induced Ca2+-dependent pancreatic duct anion secretion in cystic fibrosis cells[J].Cell Biology International,2007,31(5):521-525.
[17]Sha J H.NYD-SP27,a novel intrinsic decapacitation factor in sperm[J].Asian Journal of Andrology,2009,11(2):229-239.
