广东省鼠形动物携带巴尔通体的调查和基因特征分析
2018-05-28,,,,,,,
,,,, ,,,
鼠形动物是一类种类多,数目庞大的小型哺乳类动物,其繁殖能力强,生活环境多样,并且对自然环境有着极强的适应性,是多种病原体的储存宿主。巴尔通体是一种通过媒介传播的革兰阴性菌,近年来,随着人兽共患病的增多,巴尔通体在鼠形动物中的携带情况引起了国内外研究者的关注。目前在全球范围内,啮齿类动物具有较高的巴尔通体感染率,并且已有30余种巴尔通体被成功分型[1]。人可通过节肢动物的叮咬引起菌血症或与鼠形动物密切接触而感染巴尔通体,主要引起猫抓病、战壕热、心内膜炎及菌血症等典型和常见疾病;此外,一些症状不典型的发热病例也证实为巴尔通体感染[2]。
广东省地处我国大陆南端,贸易发达,是人口活动最频繁,最开放的省份之一,其丰富的雨水环境和亚热带季风气候为自然疫源性疾病宿主动物提供了优质的生存条件。目前我国许多地区已开展鼠形动物携带巴尔通体的调查研究,但关于广东省巴尔通体的分布情况和病原特征还未见报道,人群中巴尔通体引起的疾病资料也有限。本研究旨在通过对广东地区巴尔通体病原体的研究,了解该地区鼠形动物携带巴尔通体的情况及其生物多样性特征,为疾病的预防和控制提供科学依据。
1 材料与方法
1.1样本采集 研究分别选择地处广东省中部、西部和东部的惠州市惠东县,茂名市高州市,云浮市罗定县,潮州市潮安县,揭阳市惠来县共5个地区作为监测点,采样区分布见图1。鼠形动物的捕捉主要以笼夜法进行:即居民区每户放置5个笼,连续布放3 d,100笼次/d;野外每5 m放置1个笼,连续布放3 d;100笼次/d,晚放晨收。捕获的动物带回实验室后进行种类鉴定,记录每只鼠形动物的背景资料,包括编号、釆集时间、地点、鼠种、雌雄等。麻醉后无菌采集血清、肝、脾、肺、肾等脏器组织材料,标本冷藏保存并带回至广东省疾病预防控制中心。
1.2 试剂与设备
1.2.1分子生物学检测 肝组织材料核酸提取试剂盒(Qiagen cador pathogen kit), real time PCR试剂盒(QuantiTect Probe PCR Kit),2000 bp DNA marker(Takara),菌落DNA提取试剂盒(Bio-Rad InstaGene Matrix);引物,探针由英潍捷基贸易有限公司广州合成部合成。
1.2.2组织分离培养 胰酶大豆肉汤,5%羊血胰蛋白胨大豆琼脂培养基(广州迪景微生物科技有限公司),磁珠菌株保存液,含30%甘油的脑心浸液。
1.2.3仪器设备 组织研磨仪(Precellys 24 均质器),荧光定量PCR仪(Bio-Rad CFX96型),CO2培养箱。
1.3 方法
1.3.1巴尔通体的分子生物学检测 称取约25 mg的肝脏组织,加入PBS,运用均质研磨器充分研磨脏器后按照试剂盒说明提取总核酸。荧光定量PCR反应体系25 μL,模板DNA加5 μL,2Mix 12.5 μL,上下游引物各1 μL(10 μmol/L),探针0.5 μL,加去离子水定容至25 μL,反应用文献[2]中所用引物,上游引物:5′-GCTATGGTAATAAATGGACAATGAAATAA-3′;下游引物:5′-GCTTCTGTTGCCAGGTG-3′;探针:FAM-ACCCCGCTTAAACCTGCGACG-BHQ1;反应条件为94 ℃预变性,30个循环:94 ℃ 30 s,60 ℃退火40 s,收集荧光信号。每次实验为防止假阳性,样本处理,反应体系的制备,PCR扩增均在不同区域进行,并设定阳性对照和空白对照。
1.3.2分离培养 将经荧光定量PCR鉴定为阳性的样本进行分离培养,每份肝组织样本取约25 mg,加入约400 μL的胰酶大豆肉汤研成匀浆,然后吸取约100 μL接种于含5%羊血的胰酶大豆琼脂培养基上,置于含5% CO2、37 ℃培养箱中,观察生长情况,最长观察时间25 d,并进行菌落分纯,对疑似菌落进行PCR鉴定,最后收集阳性纯菌保存。
1.3.3序列测定与分析 荧光定量PCR扩增非编码RNA(ssrA)基因,经研究证明与gltA基因具有相同的遗传学分类功能[3], PCR产物送至广州艾基生物有限公司进行测序,在NCBI上将序列与参考序列进行搜索比对,运用MegAlign软件进行同源性分析,并用Mega6.0,采用邻接法,bootstrap 1000构建系统发育树;采用SPSS19.0软件进行统计学分析,率的比较采用卡方检验和Fisher’s概率确切法,检验水准为α=0.05。
2 结 果
2.1各地区鼠形动物的分布 2016-2017年,于广东省惠来县、惠东县、潮安县、罗定县和高州市5个地区共捕获鼠形动物375只,隶属2目3科6属8种。5个地区样本量分别为惠东县143份,高州市26份,潮安县81份,罗定县46份,惠来县79份;其中以褐家鼠(R.norvegicus)和黄胸鼠(R.flavipectus)数量占优势,分别为239只和53只。其余捕获的鼠形动物中,有屋顶鼠(R.rattus)9只,臭鼩鼱(Suncusmurinus)32只,黄毛鼠(R.losea)19只,田鼠(Microtinae)2只,板齿鼠(Bandicotaindica)17只,卡式小鼠(Muscaroli)4只。各地的鼠种构成中基本均以褐家鼠为优势鼠种,云浮罗定市主要以板齿鼠居多。见表1。
表1 广东省鼠形动物分布和巴尔通体感染情况
Tab.1 Distribution and Bartonella prevalence of rodents in Guangdong Province
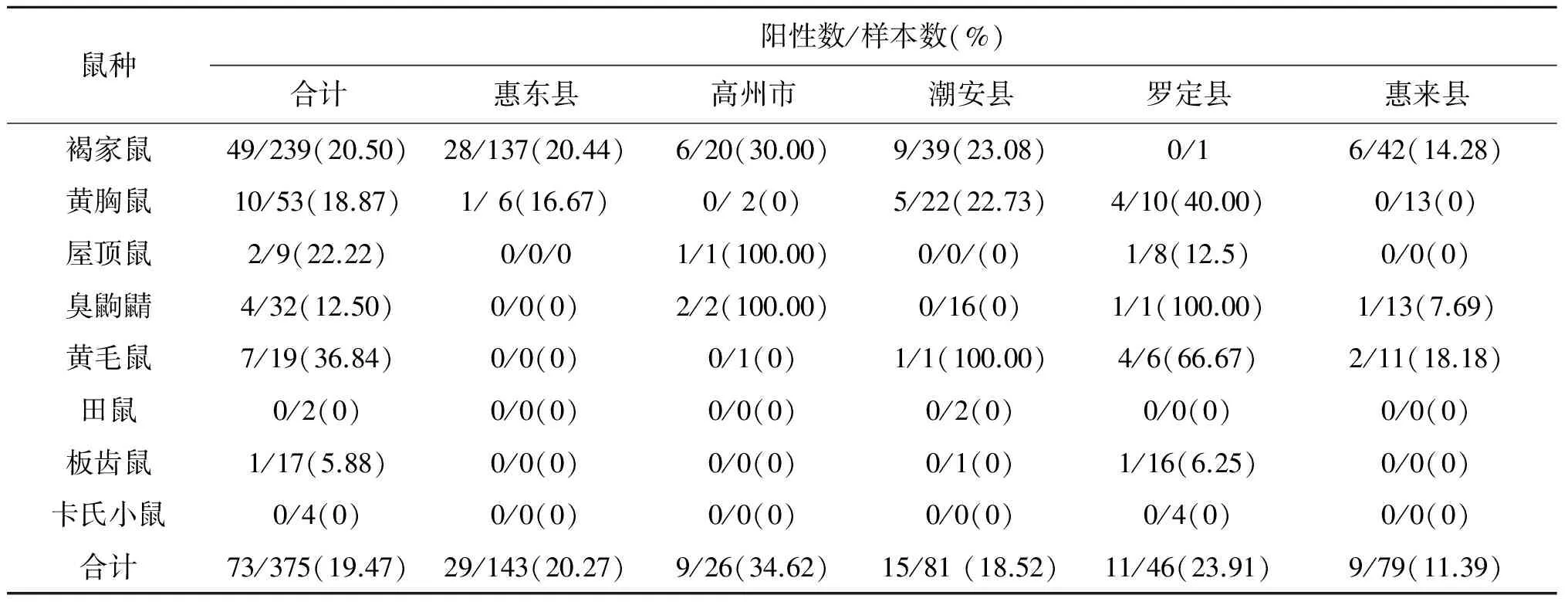
鼠种阳性数/样本数(%)合计惠东县高州市潮安县罗定县惠来县褐家鼠49/239(20.50)28/137(20.44)6/20(30.00)9/39(23.08)0/16/42(14.28)黄胸鼠10/53(18.87)1/6(16.67)0/2(0)5/22(22.73)4/10(40.00)0/13(0)屋顶鼠2/9(22.22)0/0/01/1(100.00)0/0/(0)1/8(12.5)0/0(0)臭鼩鼱4/32(12.50)0/0(0)2/2(100.00)0/16(0)1/1(100.00)1/13(7.69)黄毛鼠7/19(36.84)0/0(0)0/1(0)1/1(100.00)4/6(66.67)2/11(18.18)田鼠0/2(0)0/0(0)0/0(0)0/2(0)0/0(0)0/0(0)板齿鼠1/17(5.88)0/0(0)0/0(0)0/1(0)1/16(6.25)0/0(0)卡氏小鼠0/4(0)0/0(0)0/0(0)0/0(0)0/4(0)0/0(0)合计73/375(19.47)29/143(20.27)9/26(34.62)15/81(18.52)11/46(23.91)9/79(11.39)
2.2巴尔通体检测结果 用具有巴尔通体种属水平特异性的ssrA基因引物[3]进行荧光定量PCR基因检测,获得73份阳性样本。经测序确认,该73份均为巴尔通体序列,总阳性率为19.47%。感染鼠种为褐家鼠、黄胸鼠、屋顶鼠、臭鼩鼱、黄毛鼠、板齿鼠,其中以黄毛鼠阳性率最高36.84%,田鼠和卡式小鼠阳性率为0%,但样本量太少,缺乏代表性;不同鼠形动物间巴尔通体阳性率差异无统计学意义(χ2=6.361,P=0.254)。5个地区巴尔通体检测阳性率最高的为茂名市高州市34.62%,其次为云浮市罗定县23.91%,但各地区阳性率差异无统计学意义(χ2=7.778,P=0.100)。见表1。不同性别鼠形动物间巴尔通体阳性率差异无统计学意义(χ2=0.292,P=0.589)。不同生活环境之间阳性率差异无统计学意义(χ2=0.621,P=0.431)。见表2。
2.3巴尔通体分离培养结果 对73份PCR阳性肝组织样本进行巴尔通体分离培养,共有10份样本有明显的菌落生长。接种后每天观察1次,一般接种5~6 d后开始长出菌落,可观察到呈灰白色,略透明,边缘光滑或粗糙的圆形凸起菌落。有时平板可有较多杂菌生长,挑取单个菌落进行克隆,可于最多一周后长出菌落,大小较大于原代,有些呈现菜花样,经接种环刮起后可见圆形小凹陷,与文献中描述形态相符[4]。对菌落进行PCR鉴定后确定为巴尔通体,见图2。
表2 不同性别、栖息环境间巴尔通体阳性率的比较
Tab.2 Comparison of the positive rate of Bartonella infection in different gender and habitats
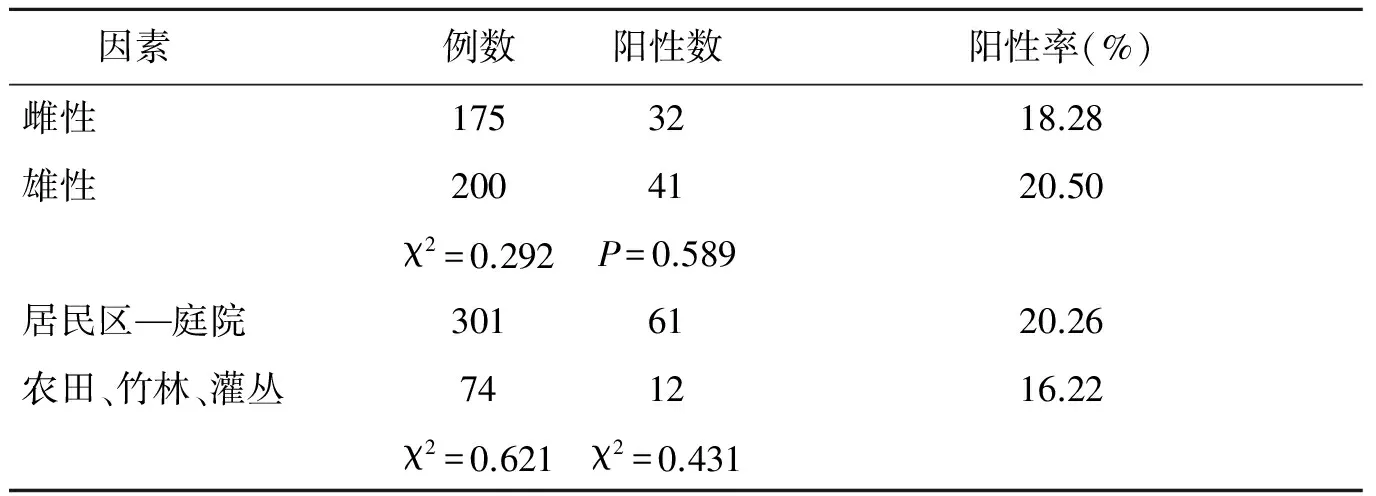
因素例数阳性数阳性率(%)雌性1753218.28雄性2004120.50χ2=0.292P=0.589居民区—庭院3016120.26农田、竹林、灌丛741216.22χ2=0.621χ2=0.431
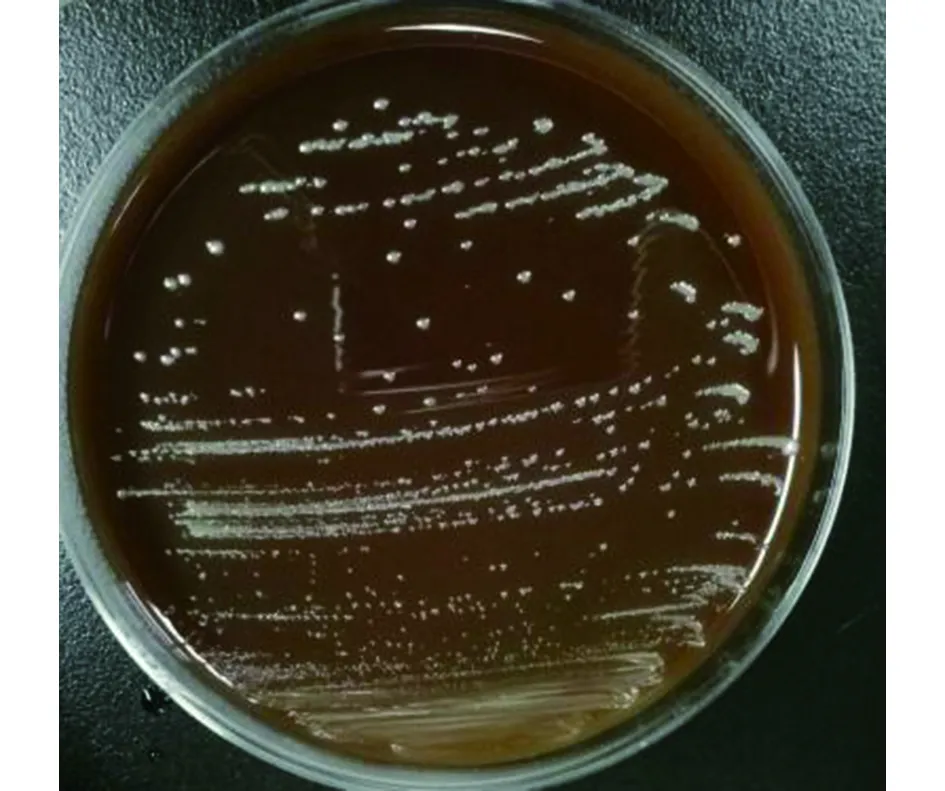
图2 5%羊血TSA培养基上巴尔通体菌落(分离自肝)Fig.2 Culture result of Bartonella isolates(isolated from liver)
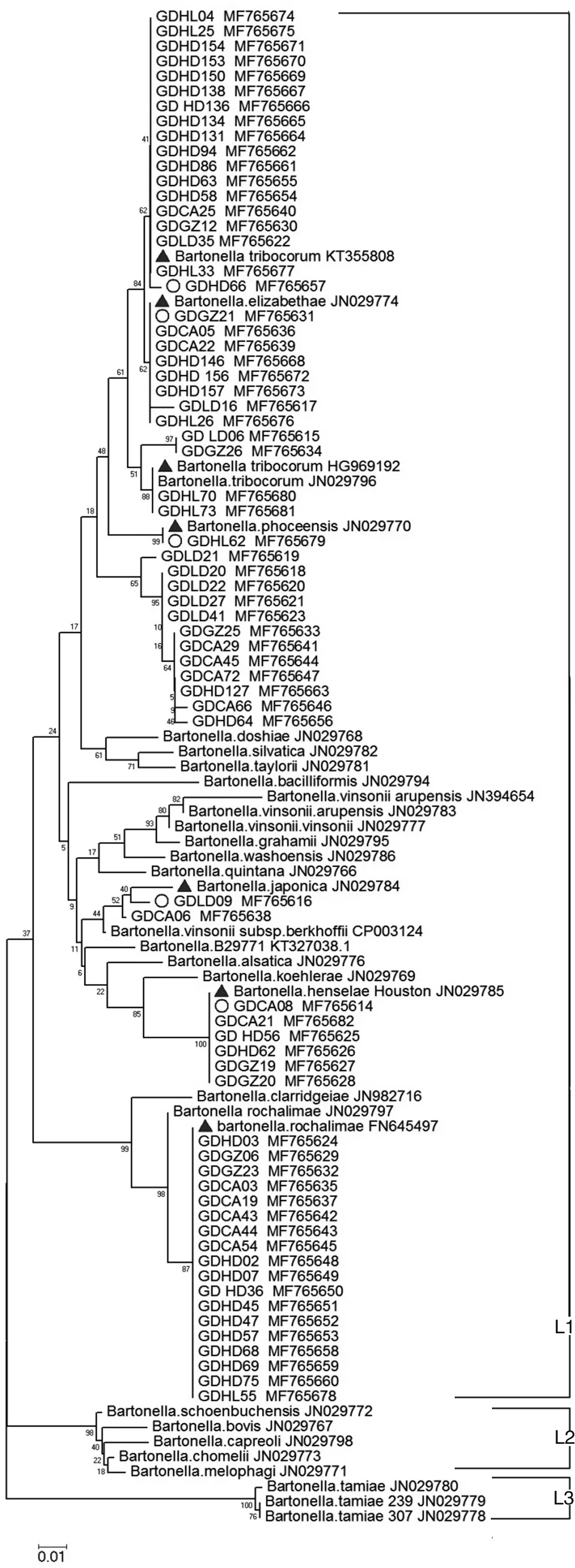
图3 基于巴尔通体ssrA基因片段的系统发育关系Fig.3 Phylogenetic relationships of B. isolates constructed based on Neighbor-Joining for ssrA gene
2.4基因特征分析 对扩增产物进行测序,获得69份有效序列,GenBank序列号为MF765614-MF765682,并基于GenBank中ssrA基因的参考序列构建系统发育树,结果显示共存在6种基因型的巴尔通体,均处于L1(鼠相关巴尔通体)的大分支中;而L2中的巴尔通体主要分离自反刍类动物,L3分支则代表了2014年从泰国分离的新的巴尔通体。每个地区菌株基因型均至少存在3种,其中潮安县存在5种基因型的巴尔通体。从褐家鼠和黄胸鼠分离的菌株基因型多样;而臭鼩鼱和板齿鼠分离的主要为B.elizabethae。以GDHD66为代表的巴尔通体与来自泰国的B.tribocorumKT355808处于同一分支,同源性达到98.8%~100%;以GDGZ21为代表的样本与美国的B.elizabethaeJN029774分为一支;分离自惠来县褐家鼠的GDHL62与B.phoceensisJN029770相聚集;以GDLD09为代表的与日本的B.japonicaJN029784最为亲近;以GDCA08为代表的与分离自美国褐家鼠的B.henselaeHouston JN029785处同一分支;其余的巴尔通体与秘鲁的B.rochalimaeFN645497同源性最高。见图3。
3 讨 论
我国自1999年白瑛[5]等于云南地区鼠形动物中成功分离到B.elizabethae后,越来越多的研究者开始关注这一病原体。从2002-2017年,几乎每年我国均有从不同宿主分离巴尔通体的文献报道,覆盖区域包括云南、山东、北京、河南、福建、浙江、黑龙江、青海、上海、内蒙古、宁夏、山西、广西、台湾等多个地区[4, 6-10],各地区从鼠形动物中检出巴尔通体的阳性率为2.3%~57.26%。其中,我国北部和西南部的阳性率较高,最高可达57.6%[7]。目前还没有人对广东省鼠形动物感染巴尔通体的情况展开调查,而通过本次研究,获得鼠形动物感染巴尔通体的阳性率为19.47%,相比海南和广西的研究数据较高,进一步证实了华南地区鼠形动物中存在巴尔通体感染,填补了广东省对该病原体的研究空白。
目前,已知能检测到巴尔通体的鼠种至少包括褐家鼠,黄胸鼠、黄毛鼠、小家鼠、屋顶鼠、田鼠、大绒鼠、斑胸鼠、大足鼠等以及食虫目动物臭鼩鼱,本研究是我国首次从板齿鼠中检测到巴尔通体。同时,国内外有研究报道证实可从猫、狗、反刍动物,甚至猕猴类动物中检测[11-14]到巴尔通体,提示巴尔通体对哺乳类动物可能有着较强的适应性,而这种广泛的宿主适应性是否对动物和人类健康有着潜在的威胁,值得进一步研究探索。
目前,巴尔通体感染最为高效便捷的手段就是进行PCR检测。SsrA(tmRNA)是存在于细菌中一类稳定的小RNA,同时具备信使RNA和转录RNA的功能。本研究运用文献中[3]ssrA基因引物进行荧光定量检测,该基因与传统的gltA片段具有相同的种属鉴定功能,说明在大量样本的鉴定中,通过扩增ssrA片段并进行序列比对,可作为一种分类巴尔通体的快速准确的方法。
此次研究中,共检测到6种基因型的巴尔通体,分别为B.elizabethae、B.phoceensis、B.japonica、B.henselae、B.rochalimae、B.tribocorum,表明广东省鼠形动物中巴尔通体基因型具有多样性和复杂性。其中B.elizabethae,B.henselae,B.rochalimae,B.tribocorum都已证实与人类疾病有关,可引起猫抓病、杆菌性血管瘤、菌血症、心内膜炎、发热等[15]。人群中巴尔通体感染的血清学调查研究显示,人巴尔通体抗体的血清阳性率大多在3.6%~11.0%之间,而不明原因发热的病人中血清抗体阳性率可达到30.17%[2]。人群中大多因猫抓病引起淋巴结肿大发现感染,而结合这些血清学的调查表明,除了猫抓病,其他症状的巴尔通体感染误诊和隐性感染不容忽视。
鼠形动物可携带多种病原体,同时也是节肢动物的宿主,不同病原体的共生及媒介的传播对疾病的发生起着重要作用。人类和鼠形动物之间直接和间接接触密切,因此做好鼠传疾病的防控工作显得尤为重要。本研究首次证实广东省内鼠形动物存在巴尔通体感染,且板齿鼠也是巴尔通体的易感动物,这为广东省内人兽共患病防控工作提供了新的依据和研究方向。由于巴尔通体对人类潜在的危险性,有必要进一步对巴尔通体在人群中的流行情况和传播途径进行探索研究。
参考文献:
[1] Gutiérrez R, Krasnov B, Morick D, et al.Bartonellainfection in rodents and their flea ectoparasites: an overview[J]. Vector Borne Zoonotic Dis,2015,15(1):27-39. DOI:10.1089/vbz.2014.1606
[2] 姚美琳,叶曦.厦门市海沧区妇幼中汉赛巴尔通体感染的血清学调查[J].中国热带医学,2012,12(11):1386-1387.DOI:10.13604/j.cnki.46-1064/r.2012.11.001
[3] Diaz MH, Bai Y, Malania L, et al. Development of a novel genus-specific real-time PCR assay for detection and differentiation of Bartonella species and genotypes[J]. J Clin Microbiol,2012,50(5):1645-1649. DOI:10.1128/JCM.06621-11
[4] 叶曦,姚美琳,李国伟.福建省鼠形动物巴尔通体感染调查[J].中国人兽共患病学报,2006,22(8):779-781.DOI:10.3969/j.issn.1002-2694.2006.08.024
[5] 白瑛.Kosoy MY,Maupin GO,等.首次证实巴尔通体在我国云南鼠群中流行[J].中国人兽共患病杂志,2002,18(3):5-9.
[6] 鞠文东,杨芳,焦丹,等.黑龙江省牡丹江口岸地区鼠类感染巴尔通体基因多态性调查[J].中国媒介生物学及控制杂志,2017,28(3):251-254.DOI:10.11853/j.issn.1003.8280.2017.03.014
[7] 宋秀平,栗冬梅,贾丽军,等.内蒙古小型兽类巴尔通体感染情况调查[J].中国媒介生物学及控制杂志,2015,26(3):233-237.DOI:10.11853/j.issn.1003.4692.2015.03.004
[8] 陈秀英,雷永良,柳付明,等.浙江省丽水市鼠类巴尔通体的检测研究[J].中国卫生检验杂志,2013,23(1):118-119.
[9] 叶海波,万道正,许佳,等. 广西地区部分口岸鼠传疾病病原体调查[J].中国媒介生物学及控制杂志,2017,28(4):343-346. DOI:10.11853/j.issn.1003.8280.2017.04.009
[10] 姜亚运,鲁亮,宋秀平,等.宁夏不同栖息环境啮齿动物巴尔通体感染状况调查[J].中国媒介生物学及控制杂志,2016,27(3):235-240. DOI:10.11853/j.issn.1003.8280.2016.03.006
[11] Bai Y, Cross PC, Malania L, et al. Isolation ofBartonellacapreoli from elk[J]. Vet Microbiol,2011,148(2-4):329-332. DOI: 10.1016/j.vetmic.2010.09.022
[12] Bergmann M, Englert T, Stuetzer B, et al. Prevalence ofBartonellaspecies infections in cats in Southern Germany[J]. Vet Rec,2017,180(13):325. DOI: 10.1136/vr.103843
[13] Marquez FJ. Detection ofBartonellaalsaticain European wild rabbit and their fleas (SpilopsylluscuniculiandXenopsyllacunicularis) in Spain[J]. Parasit Vectors,2015,8:56. DOI:10.1186/s13071-015-0664-1
[14] 栗冬梅,宋秀平,金圣浩,等. 中国部分地区实验猕猴巴尔通体感染状况及其遗传特征[J].微生物学报,2018,58(1):51-62.DOI:10.13343/j.cnki.wsxb.20170022
[15] Chomel BB,Wey AC,Kasten RW. Isolation ofBartonellawashoensisfrom a dog with mitral valve endocarditis[J]. J Clin Microbiol,2003,41(11):5327-5332.DOI: 10.1128/JCM.41.11.5327-5332.2003
