化脓链球菌金属结合蛋白Dpr的相互作用蛋白筛选
2018-05-28,,
,,
化脓链球菌(Streptococcuspyogenes,S.pyogenes)是一种常见的致病细菌,主要引起较严重的化脓性疾病,如侵袭性感染、急性风湿热、风湿性心脏瓣膜病的后遗症等[1]。研究发现它可以定植于人体血液中,并且能在其中建立自己独特的生存机制[2-3]。
铁离子是细菌代谢过程中所必需的元素之一,是许多蛋白或酶的辅助因子[4-5],也是细菌致病性形成过程中较为关键的因素[6]。当细菌感染宿主并定植于宿主体内时,其生长必须从人体获得铁离子。然而,人体中的铁离子在生理环境下是极度难溶的,加上很容易被人体内的铁蛋白、含血红素蛋白等多种铁离子结合物紧密螯合,所以人体细胞内外游离存在的铁离子非常有限[4-5],这就导致细菌从人体获得铁离子的过程相当艰难。因此,为确保自身的生存,细菌演变出了多种铁转运系统以缓解铁摄取的难题。
目前研究结果显示ABC转运系统是大多数细菌所含有的铁摄取系统,在化脓链球菌中具有高度的保守性,它们是治疗这些细菌引发的感染性疾病的疫苗候选物和药物靶点[7-9]。在化脓性链球菌中,至今报导了3种摄取铁离子的ABC系统,即 MtsABC、 HtsABC 和 FtsABCD,分别负责转运铁离子,血红素和铁色素[10-17]。现有研究大多集中在上述这3种铁转运系统,铁转运机制还存在很多不清楚的地方。而本文中研究的 Dps 样过氧化物抗性蛋白(Dps-like peroxide resistance protein,Dpr)蛋白是化脓链球菌中已发现的除以上3种转运系统之外的铁结合蛋白,它属于 DNA-binding protein from starved cells (Dps) 家族,该蛋白通过参与结合并转运细菌体内的铁离子来调节胞内过氧化氢的浓度,以此缓解细菌体内的氧化压力[18-19]。此外,在肺炎链球菌中,dpr与其下游的几个基因共同构成了一个操纵子,当dpr基因被敲除后,肺炎链球菌在小鼠鼻咽细胞中的定植能力明显减弱,并且会在更短的时间内被清除。另外,Dpr蛋白也是变形链球菌定植牙齿表面的一个关键性因子[20-21]。尽管,Dpr 蛋白对化脓链球菌等细菌的生存和毒性起着至关重要的作用,但其作用的分子机制目前仍不清楚。
本研究基于前期成功构建的重组载体 PGEX-4T-1/GST-dpr(BL21),对Dpr蛋白进行表达纯化,并采用GST-Pull down和质谱联用的方法筛选与Dpr相互作用的蛋白。同时,采用生物信息学手段分析鉴定的相互作用蛋白间的网络通路关系,以探究 Dpr 蛋白在化脓链球菌中发挥作用的新机制。
1 材料与方法
1.1 材料
1.1.1菌株及质粒 本实验所采用的菌株S.pyogenesM5005,重组表达载体 PGEX-4T-1/GST-dpr (BL21) 为本实验室前期构建保藏。
1.1.2主要试剂 Glutathione Sepharose 4B亲和层析填料,胰蛋白胨(Tryptone)、酵母膏(Yeast extract)、Todd-Hewitt Broth(肉汤),琼脂粉(Agar),过硫酸铵,TEMED,NH4HCO3,Na2S2O3,DTT(二硫苏糖醇),IAA(碘乙酰胺),TFA(三氟乙酸),CAN(乙腈),蛋白酶抑制剂 PMSF 和氨苄青霉素,亲和层析柱,超滤浓缩管,一次性过滤膜器,胰蛋白酶等。
1.2 方法
1.2.1化脓链球菌全蛋白的提取 将化脓链球菌M5005菌种按1%的量接种到含有5%的Todd-Hewitt 肉汤培养基中,37 ℃恒温摇床活化过夜。次日,取活化的菌株以1∶100 的体积比接种到新鲜的培养基中。相同条件培养细菌至OD600值为 0.8 左右时, 4 ℃,8 000 r/min 离心 10 min 收集菌体,用预冷的 1×PBS 重悬菌体,同样的条件洗涤菌体沉淀,重复3次。所得的菌体加入 500 μL 裂解液(30 mmol/L Tris,2 mol/L thiourea,4% CHAPS,pH 8.0)混匀后置于液氮和 37 ℃条件下反复冻融3次,再使用细胞超声破碎仪以 5 s 开,5 s 关的模式超声破碎 5 min 充分裂解菌体,随后加入 1% 的核酶以除去溶液中的核酸混合物,冰上静置 30 min 后于 4 ℃,13 200 r/min 离心 30 min,取上清[22]。用 BCA 法测定其中的蛋白浓度后,置于 -80 ℃保存以备后续实验使用[23]。
1.2.2GST-Pull Down[24]
1.2.2.1融合蛋白 GST-Dpr 及 GST 蛋白的获取 根据实验室前期构建的重组表达载体 PGEX-4T-1/GST-dpr(BL21) 以及确定的实验条件获得高纯度的 GST-Dpr 融合蛋白[25]。同时,基于表达载体PGEX-4T-1/GST (BL21),表达纯化获得GST蛋白。采用BCA法测定蛋白浓度后[23],将等量的GST-Dpr融合蛋白及GST蛋白分别与一定量的Glutathione Sepharose 4B亲和层析填料孵育1 h,置于4 ℃保存。
1.2.2.2筛选Dpr的相互作用蛋白[26]按照1∶5的蛋白量比例将结合有GST及GST-Dpr融合蛋白的填料分别与细菌全蛋白进行孵育,其中,GST与细菌全蛋白组作为对照,所有的样品置于旋转仪上4 ℃孵育过夜。次日,于4 ℃,2 500 r/min,离心5 min后轻轻吸去上清,用预冷的1×PBS相同条件轻柔清洗沉淀4次,小心弃上清后每个样品中加入50 μL 1×SDS样品缓冲液,水浴煮沸10 min后进行SDS-PAGE凝胶电泳,之后对完成凝胶电泳后的胶块进行银染显色[27]。显色后的电泳胶块使用Image Scanner扫描仪进行扫描,扫描参数设置为600 dpi,灰阶,8位通道,扫描结果存储为TIF格式。
1.2.2.3用于质谱鉴定的蛋白质样品制备 对照3次独立重复的 GST-Pull down 实验结果,确定共同的差异条带并标记,之后将其切成 1 cm左右的小块置于编号相同的 1.5 mL 的 EP 管中进行胶内酶解[27],即在经脱色去除胶块中的银离子后,对其中的蛋白质进行还原和烷基化,随后加入适当的胰蛋白酶完成酶解的过程。最后,将浓缩冻干的样品置于-80 ℃保存用于后续的质谱鉴定。
1.2.2.4LTQ 质谱鉴定 使用 75 μL A 液将干燥后的肽段进行溶解,之后使用 C18Trap 柱对其进行脱盐,此外,还需用 C18(Michrom, Bioresources, Auburn, CA) 对肽段进行质谱前的进一步除盐处理,处理后的溶液再次冻干后用 10 μL A 液溶解,上样,用质谱 LTQ-Orbitrap 检测。其中,A 液含 2% 的乙腈,0.1% 的甲酸,其余为超纯水。质谱检测完成后,用 SEQUEST 软件在美国国立生物技术信息中心(NCBI)中检索S.pyogenes化脓链球菌 M5005 数据库,用于蛋白的搜库鉴定,搜库参数按照文献[28]设置。
1.2.3质谱鉴定蛋白间的相互作用分析 使用 STRING 网站(http://string.embl.de/)进行在线预测并生成质谱鉴定的相互作用蛋白间的相互作用网络图。STRING 是目前比较常用的蛋白质相互作用分析软件之一,能够提供较为可信的分析结果。分析时所设置的参数如下:物种:化脓链球菌;可信度:0.40。在数据库输入栏中输入质谱鉴定到的蛋白名称,选择化脓链球菌数据库,自动生成蛋白质相互作用网络图[29]。
1.2.4Dpr 相互作用蛋白的功能分类 对于质谱鉴定到的相互作用蛋白我们使用 Gene Ontology (GO) 软件和 Uniprot http://www.uniprot.org/[30]对其进行功能注释,同时,采用 David 和 KEGG 软件在线分析这些蛋白所参与的作用通路,分析过程中的数据库均设定为化脓链球菌。
2 结 果
2.1获得高纯度的 GST-Dpr 融合蛋白 将保藏于-80 ℃的 PGEX-4T-1/GST-dpr (BL-21) 菌株按实验室前期研究确定的实验条件进行表达纯化,获得大量的 GST-Dpr 融合蛋白[25]。经 SDS-PAGE 凝胶电泳检测,发现本次试验得到的蛋白纯度较高(图 1),可用于后序的 GST-Pull down 实验。
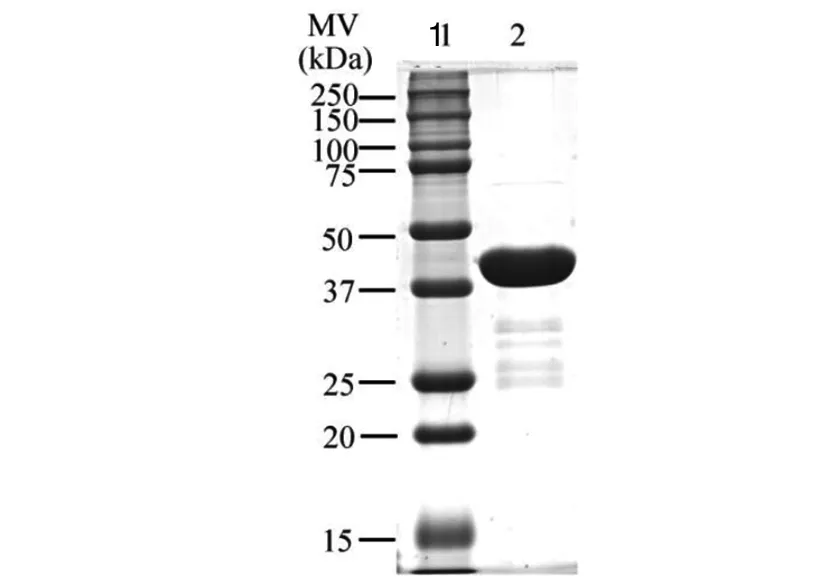
1: 250 (kD) marker; 2: GST-Dpr fusion protein图1 GST-Dpr 融合蛋白的电泳图Fig.1 GST-Dpr analysis on SDS-PAGE gel
2.2金属蛋白 Dpr 的 GST-Pull down 为了探究与金属蛋白 Dpr 相互作用的蛋白,实验中用 SDS-PAGE 凝胶电泳检测经GST-Pull down 方法筛选后的作用结果(图 2)显示:与融合蛋白存在相互作用的蛋白量明显多于对照组。用质谱鉴定凝胶块中被酶解后的差异条带,发现3 次生物学实验中 26 个蛋白被重复鉴定到(表 1)。其中包括三磷酸甘油醛脱氢酶(GAPDH)、乙酰辅酶 A 羧基转移酶(AccD)、烯醇酶(Eno)等多种酶类,转录以及延长因子等,表明本实验数据可信度较高。
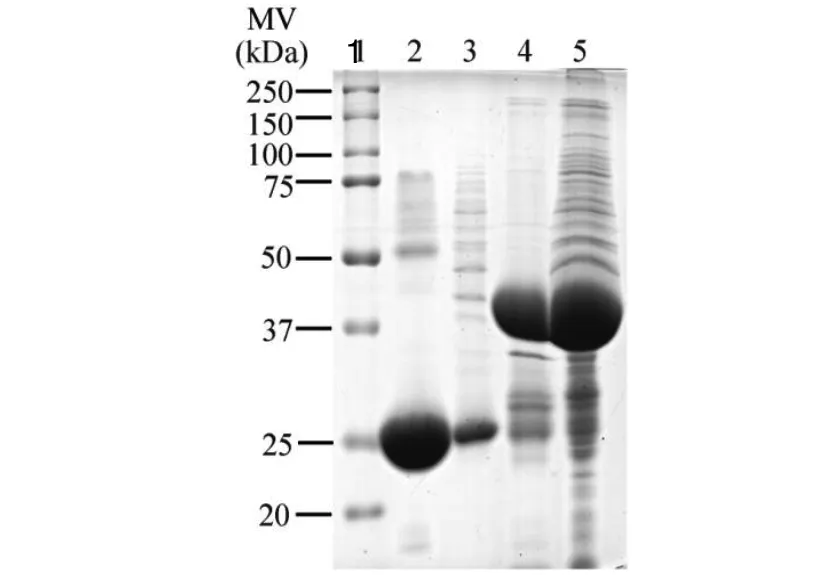
1: Marker; 2: GST; 3: GST + whole protein; 4: fusion protein; 5: fusion protein + whole protein图2 Dpr蛋白的GST-Pull down结果Fig.2 GST-Pull down of Dpr
2.3 利用生物信息学手段分析相互作用蛋白
2.3.1质谱鉴定蛋白的相互作用网络 为了研究质谱鉴定的这些蛋白间的相互作用,用 String 在线分析得到他们与 Dpr 之间对应的相互作用关系网络(图 3)。网络图的结果显示这些蛋白之间存在较
表1 质谱鉴定到的 GST-Pull down中的蛋白
Tab.1 Proteins in GST-Pull down identified with MS
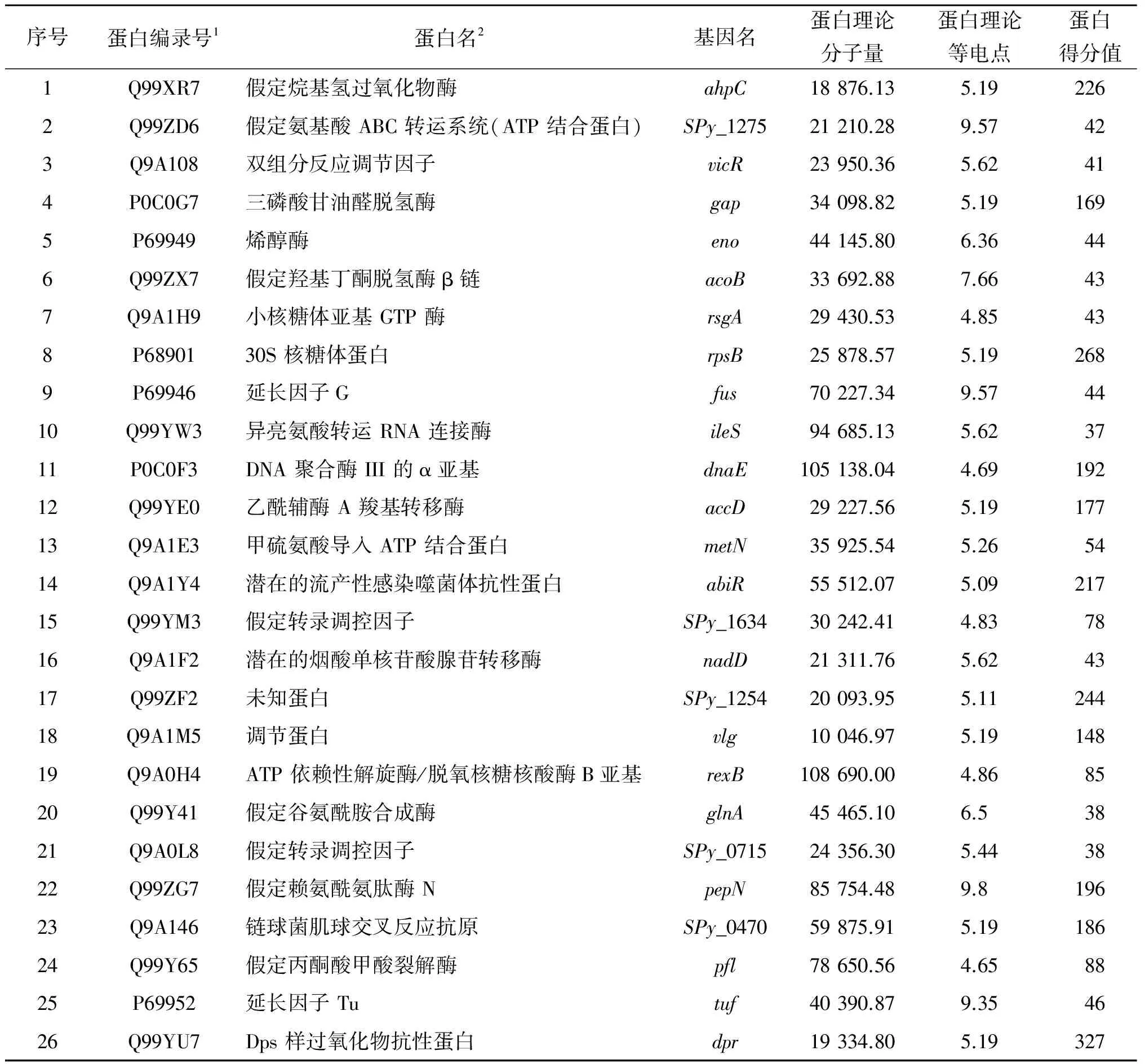
序号蛋白编录号1蛋白名2基因名蛋白理论分子量蛋白理论等电点蛋白得分值1Q99XR7假定烷基氢过氧化物酶ahpC18876.135.192262Q99ZD6假定氨基酸ABC转运系统(ATP结合蛋白)SPy_127521210.289.57423Q9A108双组分反应调节因子vicR23950.365.62414P0C0G7三磷酸甘油醛脱氢酶gap34098.825.191695P69949烯醇酶eno44145.806.36446Q99ZX7假定羟基丁酮脱氢酶β链acoB33692.887.66437Q9A1H9小核糖体亚基GTP酶rsgA29430.534.85438P6890130S核糖体蛋白rpsB25878.575.192689P69946延长因子Gfus70227.349.574410Q99YW3异亮氨酸转运RNA连接酶ileS94685.135.623711P0C0F3DNA聚合酶III的α亚基dnaE105138.044.6919212Q99YE0乙酰辅酶A羧基转移酶accD29227.565.1917713Q9A1E3甲硫氨酸导入ATP结合蛋白metN35925.545.265414Q9A1Y4潜在的流产性感染噬菌体抗性蛋白abiR55512.075.0921715Q99YM3假定转录调控因子SPy_163430242.414.837816Q9A1F2潜在的烟酸单核苷酸腺苷转移酶nadD21311.765.624317Q99ZF2未知蛋白SPy_125420093.955.1124418Q9A1M5调节蛋白vlg10046.975.1914819Q9A0H4ATP依赖性解旋酶/脱氧核糖核酸酶B亚基rexB108690.004.868520Q99Y41假定谷氨酰胺合成酶glnA45465.106.53821Q9A0L8假定转录调控因子SPy_071524356.305.443822Q99ZG7假定赖氨酰氨肽酶NpepN85754.489.819623Q9A146链球菌肌球交叉反应抗原SPy_047059875.915.1918624Q99Y65假定丙酮酸甲酸裂解酶pfl78650.564.658825P69952延长因子Tutuf40390.879.354626Q99YU7Dps样过氧化物抗性蛋白dpr19334.805.19327
1,2来源于化脓链球菌数据库
为紧密的相互作用,在与 Dpr 有相互作用的蛋白中,AccD 蛋白处于网路节点。而 AccD 蛋白属于金属结合蛋白,能够起到金属转运的作用。此外,GAPDH 作为三羧酸循环中的关键酶参与生物体中各种相关代谢,并且具有血红素结合能力[31];假定氨基酸ABC转运系统(ATP结合蛋白)SPy_1275则是 ABC 转运系统中的蛋白,这些蛋白都具有相应的转运铁功能,也都出现在这一相互作用网络中。
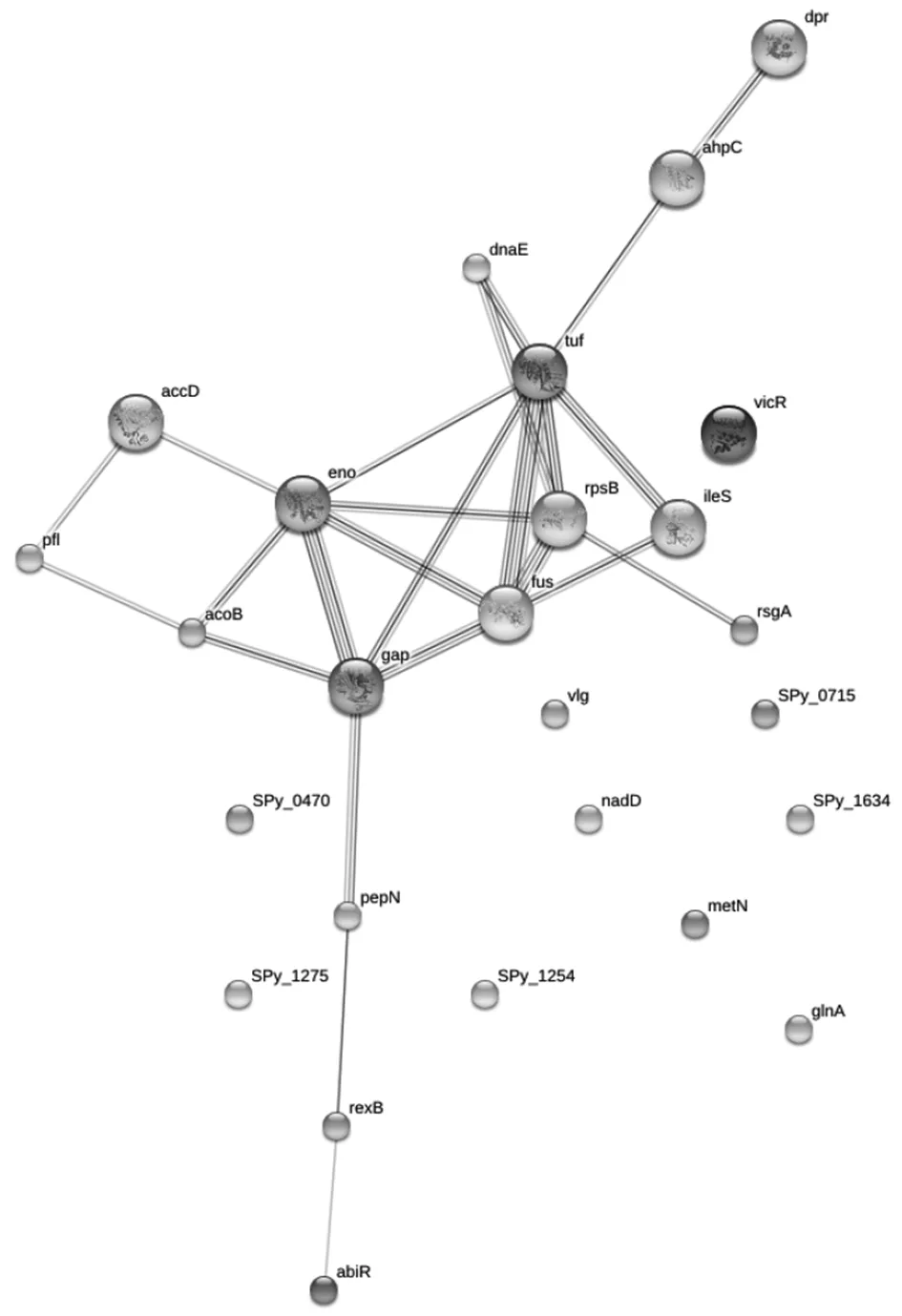
图3 质谱鉴定的差异蛋白间相互作用网络图Fig.3 Protein-protein interaction network of the differential proteins identified with MS
2.3.2Dpr 相互作用蛋白的功能分析 为进一步探究这些相互作用蛋白的功能,用 Gene Ontology (GO) 注释分析与 Dpr 蛋白存在直接或间接相互作用关系的蛋白,发现相互作用网中的这些蛋白大部分都具有结合离子、核酸、有机环化合物等配体的功能。此外,部分蛋白具有水解酶和 GTP 酶催化活性以及促进翻译延长作用(图 4)。这与 Dpr 蛋白已知的金属结合以及能够引起 DNA 损伤等特性一致,进一步说明本实验数据的可靠性,也揭示Dpr蛋白可能也存在与其相互作用蛋白类似的功能。
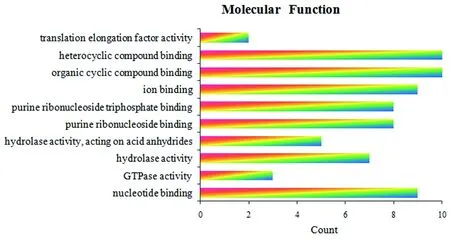
图4 Dpr 相互作用蛋白功能分析Fig.4 Functional classification of the proteins interacting with Dpr
2.3.3Dpr 相互作用蛋白通路分析 为了进一步分析这些相互作用蛋白参与的具体通路,经生物信息学软件 David和 KEGG 分析发现这些相互作用蛋白主要集中在一些代谢通路,且主要参与碳代谢、丙酮酸代谢、糖代谢以及糖异生等生物途径,暗示 Dpr 蛋白可能通过相互作用影响这些代谢通路,从而发挥其作用机制(图 5)。
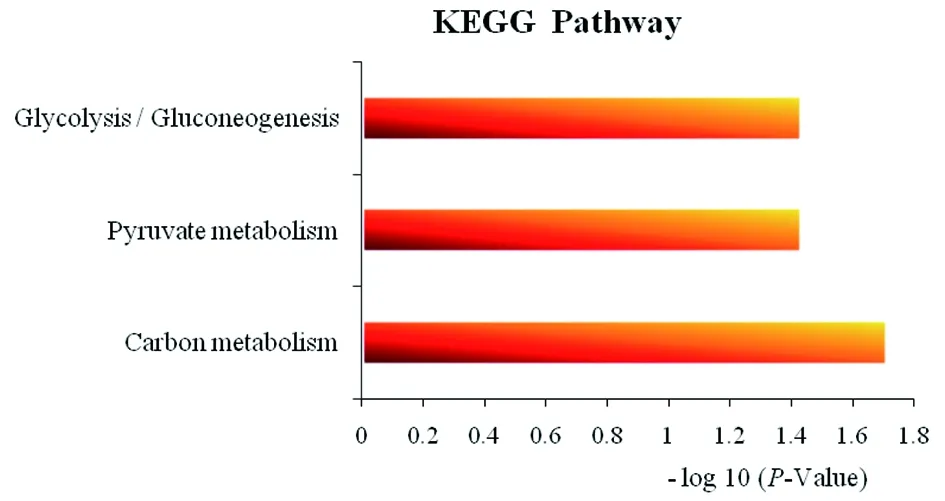
图5 Dpr相互作用蛋白通路分析Fig.5 Metabolic pathways of proteins interacting with Dpr
3 讨 论
铁元素参与生物体中细胞的生物合成、代谢、翻译等众多生物途径[32],对各生物体的生存起着至关重要的作用。宿主应对化脓链球菌乃至其他细菌病原体的入侵时,应对的策略之一就是限制细菌的金属铁离子的摄入,减少细菌摄取生存环境中游离的铁离子,铁色素和血红素铁的量。而与此同时,致病菌为满足自身的生存,也衍生出对抗宿主限制的措施,其中主要是通过快速和稳定的金属转运系统,而蛋白 Dpr 也是化脓链球菌铁转运蛋白中的一种,它对细菌的生存及毒力具有重要作用。
Dpr 蛋白在细菌体内是如何发挥功能,与哪些蛋白相互作用,目前尚不清楚。本文通过 Pull down 与质谱连用的方法筛选可能与 Dpr 相互作用的蛋白,并通过生物信息学手段建立了相互作用网络。网络中的节点蛋白 AccD 是参与脂肪酸合成过程中的第一步关键酶的组成部分,在大肠杆菌中,羧基转移酶通过结合编码其亚基的 mRNA 来调节其自身的翻译,这其中发挥结合作用的便是 AccD 中的锌指结构,而且它也可以结合ATP,金属和核苷酸[33]。此外,有研究在探究化脓链球菌中潜在的血红素结合蛋白的过程中通过血红素亲和层析的方法同时鉴定到了 AccD 蛋白和 Dpr 蛋白[34]。说明 Dpr 蛋白可能通过与 AccD 蛋白结合而影响细菌的脂肪酸代谢。在上述研究中一同被鉴定到的血红素结合相关蛋白 Eno,RpsB 和 Fus 等在本实验中也同样被鉴定到,表明本次研究中质谱鉴定的蛋白确实与血红素存在直接或者间接的关系。
蛋白 Eno 是烯醇酶,糖酵解过程中的一个关键酶,起催化2-磷酸-甘油酸失水而生成磷酸烯醇丙酮酸的作用。有研究发现该酶具有晶状体蛋白,热激蛋白和原癌基因调控蛋白等多重功能,也可以参与多种病原生物对寄主组织的入侵和转移过程。该蛋白也可以通过控制整合素的表达调控胰腺癌的粘附,侵袭和转移[35]。而另一个糖酵解的关键蛋白——三磷酸甘油醛脱氢酶(GAPDH), 在本实验中也被鉴定到。GAPDH 作为生物体内各种代谢和生物合成的关键性酶,能够参与糖酵解和糖异生,具有多种绑定活性,可以结合纤连蛋白,溶菌酶及细胞骨架蛋白等。它也作为致病菌和病毒中的一种重要的毒力因子帮助病原体在宿主体内进行定植[36-37]。而且,已有相关研究报道该蛋白作为血红素结合蛋白,参与铁离子的转运过程[31]。Eno 和 GAPDH 蛋白能够出现在 Dpr 蛋白的相互作用网络中,表明 Dpr 蛋白可能通过与这两个蛋白相互作用影响糖代谢通路,进而影响细菌的毒力。
蛋白 RpsB 属于 Rps 家族,是一种核糖体蛋白,可以作为翻译延长因子潜在的操纵子[38]。而Fus 蛋白为核糖体延长因子可以促进细菌蛋白合成中的迁移过程,该蛋白本身极易被氧化,而当其被氧化后,会伴随细胞中 GTP 酶活性增强和核糖体与延长因子的分离,与此同时,细胞中长肽段的量明显多于短的肽段[39-40]。此外,另一个延伸因子 Tuf 蛋白在 Dpr 的相互作用网络中也被鉴定到。介于上述3个与翻译相关的蛋白在本研究中同时作为 Dpr 相互作用蛋白被筛选到,因此,我们推测 Dpr 蛋白可能与细菌的翻译过程相关。
另外,Ahpc 蛋白是组成烷基氢过氧化物还原酶的亚基,能够缓解过氧化物对细菌的毒害作用,帮助细菌免受 ROS 的毒害,而且 Ahpc蛋白也有助于肠菌素的高效合成[41-42],说明 Dpr 可能与 Ahpc 相互作用发挥抗氧化的功能,这与 Dpr 蛋白已被报道具有缓解细菌体内氧化压力的功能相符,进一步表明本研究数据的可靠性。
4 结 论
本研究在前期构建的 PGEX-4T-1/GST-dpr(BL-21) 重组表达载体的基础上,表达并纯化得到高纯度的 GST-Dpr 融合蛋白,利用 GST-Pull down 实验筛选可能与 Dpr 结合的蛋白,经质谱鉴定后总共得到 26 个蛋白,利用生物信息学手段分析发现,这 26 个蛋白中有 15 个蛋白与化脓链球菌金属结合蛋白 Dpr 存在直接或间接的相互作用关系。其中大部分相互作用蛋白都有结合金属离子的功能,这与 Dpr 蛋白结合并转运金属铁离子的特点存在类似性。综合以上研究,Dpr 蛋白可能通过与这些蛋白相互作用参与细菌的代谢通路,翻译过程以及氧化应激,进而影响到细菌的定植和毒力等。
(感谢何庆瑜教授为该研究提供高水平的质谱平台,感谢对本文中质谱实验给予相应技术指导的银兴峰老师。)
参考文献:
[1] Guilherme L, Ferreira FM, Kohler KF, et al. A vaccine againstStreptococcuspyogenes: the potential to prevent rheumatic fever and rheumatic heart disease[J]. Am J Cardiovasc Drugs, 2013, 13(1): 1-4.
[2] Medina E, Goldmann O, Toppel AW, et al. Survival ofStreptococcuspyogeneswithin host phagocytic cells: a pathogenic mechanism for persistence and systemic invasion[J]. J Infect Dis, 2003, 187(4): 597-603.
[3] Nilsson M, Wasylik S, Morgelin M, et al. The antibacterial activity of peptides derived from human beta-2 glycoprotein I is inhibited by protein H and M1 protein fromStreptococcuspyogenes[J]. Mol Microbiol, 2008, 67(3): 482-492.
[4] Chua AC, Graham RM, Trinder D, et al. The regulation of cellular iron metabolism[J]. Crit Rev Clin Lab Sci, 2007, 44(5/6): 413-459.
[5] Ratledge C. Iron metabolism and infection[J]. Food Nutr Bull, 2007, 28(4 Suppl): S515-523.
[6] Faulkner MJ, Helmann JD. Peroxide stress elicits adaptive changes in bacterial metal ion homeostasis[J]. Antioxid Redox Signal, 2011, 15(1): 175-189.
[7] Hutchings MI, Palmer T, Harrington DJ, et al. Lipoprotein biogenesis in Gram-positive bacteria: knowing when to hold’em, knowing when to fold’em[J]. Trends Microbiol, 2009, 17(1): 13-21.
[8] Rees DC, Johnson E, Lewinson O. ABC transporters: the power to change[J]. Nat Rev Mol Cell Biol, 2009, 10(3): 218-227.
[9] Seeger MA, Van Veen HW. Molecular basis of multidrug transport by ABC transporters[J]. Biochim Biophys Acta, 2009, 1794(5): 725-737.
[10] Brown JS, Holden DW. Iron acquisition by Gram-positive bacterial pathogens[J]. Microbes Infect, 2002, 4(11): 1149-1156.
[11] Hanks TS, Liu M, Mcclure MJ, et al. Differential regulation of iron- and manganese-specific MtsABC and heme-specific HtsABC transporters by the metalloregulator MtsR of group AStreptococcus[J]. Infect Immun, 2006, 74(9): 5132-5139.
[12] Hanks TS, Liu M, Mcclure MJ, et al. ABC transporter FtsABCD ofStreptococcuspyogenesmediates uptake of ferric ferrichrome[J]. BMC Microbiol, 2005, 5: 62.
[13] Janulczyk R, Ricci S, Bjorck L. MtsABC is important for manganese and iron transport, oxidative stress resistance, and virulence ofStreptococcuspyogenes[J]. Infect Immun, 2003, 71(5): 2656-2664.
[14] Li H, Li N, Xu Q, et al. Lipoprotein FtsB inStreptococcuspyogenesbinds ferrichrome in two steps with residues Tyr137 and Trp204 as critical ligands[J]. PLoS One, 2013, 8(6): e65682.
[15] Ran Y, Zhu H, Liu M, et al. Bis-methionine ligation to heme iron in the streptococcal cell surface protein Shp facilitates rapid hemin transfer to HtsA of the HtsABC transporter[J]. J Biol Chem, 2007, 282(43): 31380-31388.
[16] Sun X, Baker HM, Ge R, et al. Crystal structure and metal binding properties of the lipoprotein MtsA, responsible for iron transport inStreptococcuspyogenes[J]. Biochemistry, 2009, 48(26): 6184-6190.
[17] Sun X, Ge R, Chiu JF, et al. Lipoprotein MtsA of MtsABC inStreptococcuspyogenesprimarily binds ferrous ion with bicarbonate as a synergistic anion[J]. FEBS Lett, 2008, 582(9): 1351-1354.
[18] Tsou CC, Chiang-Ni C, Lin YS, et al. An iron-binding protein, Dpr, decreases hydrogen peroxide stress and protectsStreptococcuspyogenesagainst multiple stresses[J]. Infect Immun, 2008, 76(9): 4038-4045.
[19] Tsou CC, Chiang-Ni C, Lin YS, et al. Oxidative stress and metal ions regulate a ferritin-like gene, dpr, inStreptococcuspyogenes[J]. Int J Med Microbiol, 2010, 300(4): 259-264.
[20] Hua CZ, Howard A, Malley R, et al. Effect of nonheme iron-containing ferritin Dpr in the stress response and virulence of pneumococci[J]. Infect Immun, 2014, 82(9): 3939-3947.
[21] Yoshida A, Niki M, Yamamoto Y, et al. Proteome analysis identifies the Dpr protein ofStreptococcusmutansas an important factor in the presence of early streptococcal colonizers of tooth surfaces[J]. PLoS One, 2015, 10(3): e0121176.
[22] Savic DJ, Mcshan WM, Ferretti JJ. Autonomous expression of the slo gene of the bicistronic nga-slo operon ofStreptococcuspyogenes[J]. Infect Immun, 2002, 70(5): 2730-2733.
[23] Sun X, Ge R, Chiu JF, et al. Identification of proteins related to nickel homeostasis in helicobater pylori by immobilized metal affinity chromatography and two-dimensional gel electrophoresis[J]. Met Based Drugs, 2008, 2008: 289490.
[24] Sambrook J,Russell DW. Detection of protein-protein interactions using the GST fusion protein pull down technique[J]. Nat Methods,2006,2006(1):275-276.
[25] 王南杰, 李楠,徐倩,等. 化脓链球菌中金属结合蛋白 Dpr 的表达与纯化[EB/OL]. 北京:中国科技论文在线(2013-04-08)[2017-06-20]. http://www.paper.edu.cn/html /releasepaper/ 2013/04/ 174/
[26] Fletcher S, Bowden SE, Marrion NV. False interaction of syntaxin 1A with a Ca(2+)-activated K(+) channel revealed by co-immunoprecipitation and pull-down assays: implications for identification of protein-protein interactions[J]. Neuropharmacology, 2003, 44(6): 817-827.
[27] He QY, Lau GK, Zhou Y, et al. Serum biomarkers of hepatitis B virus infected liver inflammation: a proteomic study[J]. Proteomics, 2003, 3(5): 666-674.
[28] Sun X, Jia HL, Xiao CL, et al. Bacterial proteome ofStreptococcuspneumoniaethrough multidimensional separations coupled with LC-MS/MS[J]. OMICS, 2011, 15(7/8): 477-482.
[29] Ge F, Lu XP, Zeng HL, et al. Proteomic and functional analyses reveal a dual molecular mechanism underlying arsenic-induced apoptosis in human multiple myeloma cells[J]. J Proteome Res, 2009, 8(6): 3006-3019.
[30] Yu G, Wang LG, Han Y, et al. clusterProfiler: an R package for comparing biological themes among gene clusters[J]. OMICS, 2012, 16(5): 284-287.
[31] Chakravarti R, Aulak KS, Fox PL, et al. GAPDH regulates cellular heme insertion into inducible nitric oxide synthase[J]. Proc Natl Acad Sci U S A, 2010, 107(42): 18004-18009.
[32] Corbin BD, Seeley EH, Raab A, et al. Metal chelation and inhibition of bacterial growth in tissue abscesses[J]. Science, 2008, 319(5865): 962-965.
[33] Meades GJ, Benson BK, Grove A, et al. A tale of two functions: enzymatic activity and translational repression by carboxyltransferase[J]. Nucleic Acids Res, 2010, 38(4): 1217-1227.
[34] Wang N, Zhang J, Zhang L, et al. Proteomic analysis of putative heme-binding proteins inStreptococcuspyogenes[J]. Metallomics, 2014, 6(8): 1451-1459.
[35] Principe M, Borgoni S, Cascione M, et al. Alpha-enolase (ENO1) controls alpha v/beta 3 integrin expression and regulates pancreatic cancer adhesion, invasion, and metastasis[J]. J Hematol Oncol, 2017, 10(1): 16.
[36] Pancholi V, Fischetti VA. A major surface protein on group A streptococci is a glyceraldehyde-3-phosphate-dehydrogenase with multiple binding activity[J]. J Exp Med, 1992, 176(2): 415-426.
[37] Seidler KA, Seidler NW. Role of extracellular GAPDH inStreptococcuspyogenesvirulence[J]. Mo Med, 2013, 110(3): 236-240.
[38] Bendiak DS, Friesen JD. Organization of genes in the four minute region of theEscherichiacolichromosome: evidence that rpsB and tsf are co-transcribed[J]. Mol Gen Genet, 1981, 181(3): 356-362.
[39] Nagano T, Yutthanasirikul R, Hihara Y, et al. Oxidation of translation factor EF-G transiently retards the translational elongation cycle inEscherichiacoli[J]. J Biochem, 2015, 158(2): 165-172.
[40] Zhao J, Hu X, Li Y, et al. Overexpression of ribosome elongation factor G and recycling factor increases L-isoleucine production in Corynebacterium glutamicum[J]. Appl Microbiol Biotechnol, 2015, 99(11): 4795-4805.
[41] Dip PV, Kamariah N, Subramanian Manimekalai MS, et al. Structure, mechanism and ensemble formation of the alkylhydroperoxide reductase subunits AhpC and AhpF fromEscherichiacoli[J]. Acta Crystallogr D Biol Crystallogr, 2014, 70(Pt 11): 2848-2862.
[42] Ma L, Payne SM. AhpC is required for optimal production of enterobactin byEscherichiacoli[J]. J Bacteriol, 2012, 194(24): 6748-6757.
