自水解后杨木边材木片化学组分和结构特性的变化及其对木片碱液浸渍的影响
2018-05-25江骁雅陈雪峰侯庆喜张宏雷
江骁雅 陈雪峰 侯庆喜 岳 珍 张宏雷 刘 苇
(1. 天津科技大学天津市制浆造纸重点实验室,天津,300457; 2. 中国制浆造纸研究院有限公司,北京,100102;3. 制浆造纸国家工程实验室,北京,100102)
在化学机械法制浆(Chemi-mechanical pulping, CMP)的碱液浸渍段,木质纤维原料对碱液的吸收程度对后续工艺的进行及产品质量起着重要作用。木质纤维原料的碱液浸渍过程主要涉及两种不同行为,即碱液与木质纤维原料间的质量传递及二者发生的化学反应[1]。
影响碱液与木质纤维原料间质量传递的主要因素有3个[2- 3]:木质纤维原料本身特性、浸渍液性能及浸渍过程的工艺条件,其中木质纤维原料的毛细管结构至关重要[2]。木质纤维原料的毛细管结构是由大毛细管系统和微毛细管系统相互串并联而成的复合毛细管结构,属多孔介质[4- 6]。对阔叶木而言,其导管细胞是木片内部流体传输的主要通道[7- 8]。导管内部可能存在基质/侵填体,这些物质将阻碍流体在导管内的流动。基质主要是一些囊状薄膜,是由其他薄壁细胞的细胞壁等通过纹孔进入到导管内形成的,常见于心材及树龄较长的边材[9- 10]。除导管外,纤维细胞腔也是阔叶木内部的主要传输通道之一[11]。相邻的纤维细胞腔之间通过纹孔相互连接。所有的纹孔都具有纹孔腔和纹孔膜,而其中纹孔膜是阻碍流体在纤维细胞腔内传输的主要结构[12- 13]。
影响木质纤维原料与碱液反应的主要因素与木质纤维原料的化学组分有关。有研究表明,在CMP过程中,木质纤维原料与碱液反应的主要基团为乙酰基、糖醛酸基等弱酸性基团[14- 15]。随着化学反应的进行,反应产物不断溶出,进入木片内部的碱液不断消耗,木片内外浓度差增大,又促使外部碱液更快地进入木片内部。因此,碱液与木片间的质量传递及碱液与木片组分间的化学反应这两种行为同时发生又相互促进[16]。
在CMP前,利用自水解预处理抽提出木质纤维原料中的部分半纤维素不仅能够充分利用半纤维素资源,还能降低磨浆能耗及废液污染负荷[17- 18]。因此,在CMP前对木质纤维原料进行自水解预处理已得到一定的应用[19]。然而有研究表明,木质纤维原料经过自水解预处理后,其化学组分和结构特性均会发生一定改变[20- 21]。但这些研究针对性不强,真正影响木质纤维原料对碱液反应性吸收的化学组分及结构特性发生了怎样的变化,且这些变化对后续碱液的吸收带来怎样的影响,相关研究尚未出现。基于此,本研究以经不同强度的自水解预处理后的杨木边材木片为研究对象,分析影响木质纤维原料对碱液反应性吸收的结构特性和化学组分在自水解预处理过程中的变化。然后对自水解预处理后的木片进行碱液浸渍处理,进一步研究浸渍液碱浓和浸渍温度对不同强度自水解预处理后木片浸渍效果的影响。
1 实 验
1.1 原料
本研究选取速生107杨为原料,产自唐山市滦南县林场,树龄7~8年。在其主干胸径处取一段约 2 m高的木段,并截成数段100 mm高的木桩,自然风干至木桩含水率为10%左右。按照颜色区分边材与心材,将其中的边材部分切割成30 mm× 30 mm× 10 mm(轴向×径向×弦向)的木片。剔除掉腐败的木片后,用清水冲洗木片上的木屑和杂质,在室温条件下将木片风干,装入自封袋中,并置于阴凉处密封储存。
1.2 木片的自水解预处理
木片的自水解预处理在容积为6 L的CN3000型双缸蒸煮锅(美国M/K Systems公司)中进行。通过改变水解温度和时间得到不同的自水解强度。本研究使用联合水解因子(Combined hydrolysis factor, CHF)来定量表征自水解预处理的强度,其计算公式为[22]:
CHF=t×exp(25.6-11000/T)
(1)
式中,T为水解温度,K;t为保温时间,min。
所选取的自水解条件如表1所示,具体实验操作参照本课题组已发表文献中的实验方法进行[23]。
在自水解预处理开始前,选取部分木片并称取质量,做好标记。自水解预处理结束后将做好标记的木片取出,洗净后置于105℃的烘箱(天津市天宇实验室仪器有限公司)内烘干,平衡水分并称取质量,用于计算自水解后木片的得率。

表1 自水解预处理工艺参数及对应的CHF
1.3木片化学组分分析
原料木片和自水解预处理后木片的综纤维素含量的测定参见GB/T 2677.10—1995,聚戊糖含量的测定参见 GB/T 2677.9—1994,酸不溶木素、酸溶木素、乙醇抽出物及乙酰基含量的测定参见美国再生能源实验室(National Renewable Energy Laboratory, NREL)的相关标准NREL/TP- 510- 42618、NREL/TP- 510- 42619[24- 25]。

图1 试样的电导滴定曲线示例图
弱酸性基团含量的测定方法采用电导滴定法[26]。选取部分原料木片和自水解预处理后的木片经磨粉机(美国亚瑟托马斯公司)粉碎,收集其中40~60目的木粉,用密封袋密封储存,室温下平衡水分。准确称量3 g(绝干)木粉样品,置于100 mL的0.1 mol/L HCl中浸泡2次,磁力搅拌器搅拌。而后用煮沸并冷却的蒸馏水洗涤样品至电导稳定。过滤后再将样品倒入盛有450 mL的0.001 mol/L NaCl溶液的烧杯中,用带孔的有机玻璃板盖住烧杯口。通入氮气10 min左右,以保证环境无二氧化碳。滴定在AT- 510型自动电荷滴定仪(日本京都电子制造有限公司)中进行,滴定液为0.1 mol/L的NaOH溶液,滴定速度为0.5 mL/5 min。记录滴定的电导曲线,示例图如图1所示,该曲线的平衡数据点的切线与电导上升部分数据点的切线的交点(图1中圆圈表示的点)所对应的横坐标值即为样品的弱酸性基团消耗的NaOH溶液量。最后用去离子水洗涤木粉样品,置于105℃烘箱中烘干至质量恒定并称量。
1.4 原料木片和自水解预处理后木片的导管及纹孔形态
利用日本电子株式会社的JSM-IT300LV型扫描电镜(Scanning electron microscope, SEM)对原料木片和自水解预处理后木片的导管及纹孔形态进行观察。将部分自水解并洗涤干净的木片放入超低温冰箱内保存至少24 h以上。取出后沿木片不同方向(轴向、径向和弦向)进行切片。首先用美工刀切取成3~5 mm厚的小木片后,将其固定在冷冻切片机的载物台上,用冷冻切片法切去木片表面不平整部分,而后置于干燥器内干燥数小时。接着对样品进行多次不同角度的喷金处理,使样品具有导电性。最后将样品放置于SEM内部进行观察。
1.5 原料木片及自水解预处理后木片的碱液浸渍处理
木片的碱液浸渍过程在塑料自封袋中进行。碱液浸渍液为NaOH溶液,浸渍时间为60 min,浸渍液固比为10∶1,每组浸渍木片的质量约为50 g(绝干)。在研究浸渍温度对自水解预处理后杨木边材木片浸渍效果的影响时,选取碱液浸渍温度为60、70、80和90℃。在研究浸渍液碱浓对自水解预处理后杨木边材木片浸渍效果的影响时,所选取的浸渍液碱浓为0.25、0.50、0.75和1.00 mol/L。以浸渍温度80℃为例,首先将原料木片及自水解预处理后木片的含水率都调节为10%左右;接着将各组木片和对应的NaOH溶液分别装入不同自封袋中,放入80℃的恒温水浴锅(上海一恒科技有限公司)中预热;当浸渍液温度上升至80℃时,迅速将木片与碱液混合密封,并在水浴锅中继续保温。在此期间,每隔10~15 min摇匀一次。60 min后取出自封袋,将木片和药液分离,并将木片浸入液氮,迅速冷却停止反应。将分离出的药液倒入事先充满氮气的塑料瓶内,盖好塑料瓶并放入冰水浴中冷却。冷藏储存,备用。
1.6 碱液浸渍效果的测定
本研究使用碱液浸渍过程中木片对NaOH溶液的吸收量及NaOH消耗量来表征木片的碱液浸渍效果[27]。
1.6.1NaOH溶液吸收量的测定
将液氮冷却后的浸渍木片装入塑料袋中不密封称重,浸渍前后的木片质量差即为该木片的NaOH溶液吸收量。由于每块木片的质量都不同且为与NaOH消耗量单位保持一致,需换算成每100 g绝干木片的NaOH溶液吸收量,单位为g/100 g(相对于绝干木片)。
1.6.2NaOH消耗量的测定
浸渍后碱液的NaOH浓度的检测参照相关文献[28]方法进行。取2 mL浸渍液,用100 mL的去离子水稀释,再加入25 mL质量浓度为100 g/L的BaCl2溶液混合后,用0.1 mol/L的HCl标准溶液进行滴定,通过自动电荷滴定仪滴定至pH值为8.3为止,记录HCl消耗量,并计算NaOH的浓度。木片的NaOH消耗量的计算公式为:
(2)
式中,m为木片的NaOH消耗量,g/100 g(相对于绝干木片);C0为浸渍前NaOH的浓度,mol/L;C1为浸渍后NaOH的浓度,mol/L;M为NaOH的摩尔质量,即40 g/mol;V为浸渍液的体积,L;m木为木片的绝干质量,g。
2 结果与讨论
2.1 自水解预处理后杨木边材木片化学组分的变化
根据自水解预处理对木质纤维原料的作用机理可知,半纤维素的降解溶出及大量乙酰基的脱落会使原料的化学组分发生较大变化。表2所示为不同自水解预处理后杨木边材木片的化学组分。由表2可知,随着CHF的增大,杨木边材木片的综纤维素和聚戊糖含量均有较大幅度的下降,当CHF上升到73.63时,聚戊糖含量为12.18%,相对于原料木片的22.42%降低了45.7%。随着自水解强度的增大,酸不溶木素含量呈下降趋势,但降低的幅度并不大。与酸不溶木素相比,木片中酸溶木素含量在自水解后出现了明显下降,这主要是自水解过程的弱酸性造成的。乙醇抽出物的含量则随自水解强度的增大而增加,当CHF上升到73.63时,木片中乙醇抽出物含量是原料木片的4倍多。造成乙醇抽出物含量增大的原因可能有以下两个方面:①“假木素”的溶出,Ragauskas课题组[29- 31]在对脱木素后的杨木综纤维素进行稀酸预处理时发现,碳水化合物在酸性条件下会形成类木素化合物,在水解结束后以球状颗粒的形态沉积在细胞壁表面;他们通过红外光谱及核磁共振波谱证实了这些颗粒主要是碳水化合物由于酸催化脱水产生饱和碳键而形成的多酚结构,这些多酚类物质是能够被有机溶剂抽提出来的;②部分木素结构发生了变化,使之易溶于有机溶剂而被抽提出来[32]。
木质纤维原料中乙酰基、糖醛酸基及其他弱酸性基团将会在浸渍过程中与碱液发生反应而消耗NaOH[15],因此弱酸性基团的含量对木片的碱液浸渍过程有较大影响。自水解后木片乙酰基含量大幅降低,且下降幅度随着自水解强度增强而增大(表2)。当CHF上升到73.63时,乙酰基含量为 3.78%,相对于原料木片的5.98%降低了36.8%。本研究测定的乙酰基含量普遍偏高(阔叶木中乙酰基含量通常在3%~5%),可能是由于用于分析的原料为边材所致[33]。而自水解预处理后木片中总的弱酸性基团的变化趋势却与乙酰基有一定差异,呈先增大后减小的趋势。这可能是因为当自水解强度低时,半纤维素或木素会在氢离子的攻击下暴露出某些弱酸性基团。随着自水解强度的逐渐增大,这些弱酸性基团也逐渐脱落。
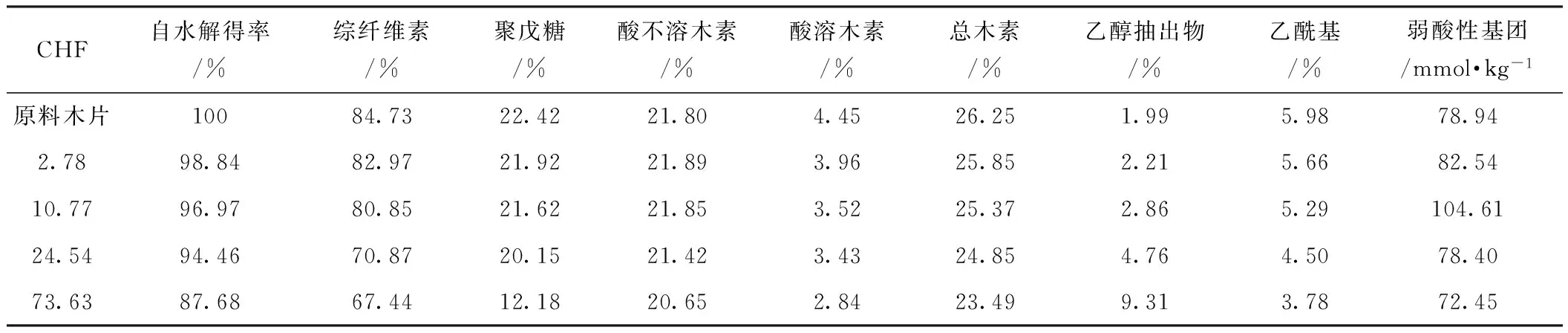
表2 自水解预处理后杨木边材木片化学组分
注 相对于绝干原料计。

图2 杨木边材木片导管的SEM图

图3 杨木边材木片纹孔形态SEM图
2.2 自水解预处理后杨木边材木片导管和纹孔形态的变化
组成木质纤维原料内部流体流通通道的大毛细管系统主要由木材各类型细胞的细胞腔及连接各细胞的纹孔构成[4],导管、纤维细胞腔及其连接彼此的纹孔等都是影响流体浸渍的主要因素。导管内部可能存在少量基质/侵填体,这些基质/侵填体主要为囊状薄膜或一些树脂、树胶和碳酸钙等物质,如图2(a) 中箭头所示。本研究所选取的原料为速生107杨,树龄仅为7~8年,因此在树木成长过程中很难形成大量的侵填体。然而,根据图2(b)、图2(c)和图2(d)可发现,在自水解预处理后的杨木边材内部较为“干净”,即使是自水解强度较低的木片内部,也几乎找不到基质/侵填体的存在。造成上述现象的原因可能并不是因为自水解过程发生的化学反应,而是因为导管是木片实现内外物质交换的主要通道,在自水解预处理的高温高压条件下木片导管内的物质与木片外界实现了快速的质量交换导致的。上述猜想还需进一步证实。
纹孔是连接相邻导管细胞(通常称为穿孔板)或纤维细胞的特征结构,其直径范围在1~10 μm之间,远比导管和纤维细胞的直径要小。因此可以说纹孔是影响流体传输的决定因素之一。Jacobs 等[34]考察了木材种类、扩散方向及酶水解对NaOH溶液扩散进入木片内部的平均速率的影响,并用SEM对处理前后纹孔膜的形态进行了分析。结果表明,酶处理前后扩散速率的巨大差别主要归结为纹孔膜的溶解。图3(a)表征的是原料木片的纹孔状态。由图3(a)可知,杨木边材木片纹孔的纹孔膜都是完整的,有些纹孔膜上甚至有纹孔塞的存在。在CHF为10.77的自水解预处理后,纹孔膜上出现了开口及裂缝(如图3(b)所示);而当CHF上升到73.63时,大量纹孔的纹孔膜都已经破裂(如图3(c)所示)。纹孔膜由初生壁和相邻细胞的胞间层构成,为随机交织的微细纤维网[35],半纤维素是其主要化学组分之一。在自水解预处理后,部分半纤维素溶解脱除,导致微细纤维聚集而暴露出孔隙[36],这些孔隙随自水解强度的增大而逐渐增多变大,纹孔膜开始破裂、塌陷,甚至完全脱除。不过,由图3(d)可以发现,也有部分纹孔的纹孔膜较厚而并未破裂。
2.3 浸渍温度对自水解预处理后杨木边材木片浸渍效果的影响
碱液浸渍温度对自水解预处理后杨木边材木片浸渍效果的影响如图4所示。由图4可知,自水解预处理后的杨木边材木片的NaOH溶液吸收量及NaOH消耗量是随着浸渍温度的升高逐渐增加的,且二者与浸渍温度都呈现良好的线性正相关,变化趋势与原料木片类似。这与Zanuttini等对杨木木粉在不同温度、碱浓及时间下碱液浸渍效果的研究成果类似[37]。在Zanuttini等的研究中,他们使用浸渍得率和保水值(WRV)来表征杨木木粉的碱液浸渍效果。在所选温度范围内,木粉的WRV存在最大值,这表明木粉的浸渍达到了饱和。而在本研究中,NaOH溶液吸收量及NaOH消耗量并未出现饱和状态,这表明该浸渍条件下木片的浸渍效果并未达到极限。这与碱液浸渍所选取的浸渍时间(60 min)及选取的研究对象(杨木边材木片)有关。木片为多孔毛细材料,木片内部的浸渍液瞬时浓度和温度分布会因毛细管结构的不同而存在一定的差异。所以木片的浸渍效果较木粉更差。

注 其他浸渍条件:浸渍时间60 min,浸渍液碱浓0.5 mol/L。图4 浸渍温度对自水解预处理后杨木边材木片浸渍效果的影响
此外,由图4可知,在所选温度范围内自水解预处理后杨木边材木片的NaOH溶液吸收量和NaOH消耗量都是随着CHF的增大而增加的,表明自水解能够提升杨木边材木片的碱液浸渍效果。这与自水解预处理使得杨木边材木片结构特性和化学组分发生变化而导致杨木边材木片的可及性提高有关。
2.4 浸渍液碱浓对自水解预处理后杨木边材木片浸渍效果的影响

注 其他浸渍条件:浸渍时间60 min,浸渍温度80℃。图5 浸渍液碱浓对自水解预处理后杨木边材木片浸渍效果的影响
图5所示为浸渍液碱浓对不同强度自水解预处理后的杨木边材木片浸渍效果的影响。由图5可知,自水解预处理后的杨木边材木片的NaOH溶液吸收量和NaOH消耗量是随着浸渍液碱浓的增大逐渐增加的,且二者与浸渍液碱浓都呈现良好的线性关系,变化趋势与原料木片类似。该结论也与Zunattini等[37]的研究成果一致。且在所选NaOH浓度范围内,杨木边材木片的NaOH溶液吸收量和NaOH消耗量是随着CHF的增大而增加的,表明自水解能够促进杨木边材木片的碱液浸渍效果。此外,对比图5(a)、图5(b)还可以发现,浸渍液碱浓越大,不同强度自水解预处理后杨木边材木片的NaOH溶液吸收量和NaOH消耗量越接近。这表明在碱液浸渍条件温和时,自水解预处理对杨木边材木片的作用体现得更加明显。
3 结 论
本研究分析了影响杨木边材木片对碱液反应性吸收的化学组分和结构特性在自水解预处理过程中的变化。杨木边材木片的综纤维素和乙酰基含量都随自水解强度的增大而降低,而总的弱酸性基团含量则先增加后减少。杨木边材木片导管内部的基质/侵填体在自水解预处理过程中得以清除,且部分纹孔的纹孔膜被溶解破坏。杨木边材木片的NaOH溶液吸收量和NaOH消耗量随自水解强度的增大而增加,这表明自水解预处理改善了杨木边材木片的碱液浸渍效果。自水解预处理后木片与原料木片的NaOH溶液吸收量和NaOH消耗量均随浸渍液碱浓的增大和浸渍温度的升高而增加,且都呈现良好的线性相关性。
参 考 文 献
[1] Zanuttini M, Citroni M, Marzocchi V. Pattern of alkali impregnation of proper wood at moderate conditions[J]. Holzforschung, 2000, 54: 631.
[2] Malkov S. Studies on liquid penetration into softwood chips: experiments, models and applications[D]. Helsinki: Helsinki University of Technology, 2002.
[3] Bao F, Lv J. A study on the principle of permeability control of wood[J]. Scientia Silvae Sinicae, 1992, 28: 336.
[4] Bao Fu-cheng, Hu rong. Studies on the fluid permeability and diffusion of the Paulownia wood[J]. Scientia Silvar Sinicae, 1990, 26(3): 239.
鲍甫成, 胡 荣. 泡桐木材流体渗透性与扩散性的研究[J].林业科学, 1990, 26(3): 239.
[5] Stamm A. Permeability of wood to fluids[J]. Journal of Forest Product, 1963, 13(6): 503.
[6] Greenkorn R. Flow phenomena in porous media: fundamentals and applications in petroleum, water and food production[M]. New York: Marcel Dekker, 1983: 21.
[7] Bao F, Lu J, Avramidis S. On the permeability of main wood species in China[J]. Holzforschung, 1999, 53: 350.
[8] Tomoyuki F, Lee S, Kuroda N, et al. Conductive function of intervessel pits through a growth ring boundary of Machilusthunbergii[J]. IAWA Journal, 2001, 22: 1.
[9] Stone J, Green H. Penetration and diffusion into hardwoods[J]. TAPPI Journal, 1958, 42: 700.
[10] Zhou Yin, Jiang Xiao-mei. Ultrastructure and its effects on the permeability of the wood of LarixOlgensis Henry[J]. Scientia Silvar Sinicae, 1986, 22(3): 260.
周 崟, 姜笑梅. 黄花落叶松木材超微结构及其对渗透性的影响[J].林业科学, 1986, 22(3): 260.
[11] Thomas R. Anatomical features affecting liquid permeability in three hardwood species[J]. Wood Fiber, 1976, 7: 256.
[12] Iida I, Yusuf S, Watanabe U, et al. Liquid penetration of precompressed wood VII: combined treatment of precompression and extraction in hot water on the liquid penetration of wood[J]. Journal of Wood Science, 2002, 48(1): 81.
[13] Watanabe U, Imamura Y, Iida I. Liquid penetration of precompressed wood VI: Anatomical characterization of pit fractures[J]. Journal of Wood Science, 1998, 44(2): 158.
[14] Katz S, Liebergott N, Scallan A. A mechanism for the alkali strengthening of mechanical pulps[J]. TAPPI Journal, 1981, 64: 97.
[15] Zanuttini M, Citroni M, Martínez M, et al. Chemimechanical Pulping of Poplar Wood. Alkaline Wood Pretreatment at Low Temperature[J]. Holzforschung, 1998, 52: 405.
[16] Egas A, Simão J, Costa I, et al. Experimental methodology for heterogeneous studies in pulping of wood[J]. Industrial & Engineering Chemistry Research, 2002, 41: 2529.
[17] Johnsen I A, Stenius P. Effects of selective wood resin adsorption on paper properties[J]. Nordic Pulp and Paper Research Journal, 2007, 22(4): 452.
[18] Boluk Y, Yuan Z, Tosto F, et al. Dilute acid prehydrolysis and extraction of hemicellulose prior to aspen chemi-thermomechanical pulping[C]// AIChE Annual Meeting, New York: American Institute of Chemical Engineers, 2008.
[19] Hou Q X, Wang Y, Liu W, et al. An application study of autohydrolysis pretreatment prior to poplar chemi-thermomechanical pulping[J]. Bioresource Technology, 2014, 169(5): 155.
[20] Malkov S. Studies on liquid penetration into softwood chips-experiments, models and applications[D]. Helsinki: Helsinki University of Technology Laboratory of Pulping Technology, 2002.
[21] Zhao You-ke, Bao Fu-cheng. Theoretical analysis on the relationship between softwood longitudinal permeability and its structure[J]. Scientia Silvar Sinicae, 1998, 34(4): 88.
赵有科, 鲍甫成. 针叶树木材流体纵向渗透性与其构造关系的理论分析[J].林业科学, 1998, 34(4): 88.
[22] Zhu W, Houtman C, Zhu J Y, et al. Quantitative predictions of bioconversion of aspen by dilute acid and SPORL pretreatments using a unified combined hydrolysis factor(CHF)[J]. Process Biochemistry, 2012, 47: 785.
[23] Hou Q X, Liu L H, Liu W, et al. Achieving refining energy savings and pulp properties for poplar chemi-thermomechanical pulp improvement through optimized autohydrolysis pretreatment[J]. Industrial & Engineering Chemistry Research, 2014, 53: 17843.
[24] NREL/TP- 510- 42619. Determination of extractives in biomass[S]. Golden: National Renewable Energy Laboratory, 2008.
[25] NREL/TP- 510- 42618. Determination of structural carbohydrates and lignin in biomass[S]. Golden: National Renewable Energy Laboratory, 2012.
[26] Katz S, Beatson R, Scallan A. The determinationofstrong and weak acidic groups in sulfite pulps[J]. Svensk Papperstidn, 1984, 87(6): 48.
[27] Maattanen M, Tikka P. Determination of phenomena involved in impregnation of softwood chips. Part 2: Alkali uptake, alkali consumption and impregnation yield[J]. Nordic Pulp & Paper Research Journal, 2012, 27(3): 559.
[28] Santos A, Rodriguez F, Gilarranz M, et al. Kinetic Modeling of Kraft Delignification of Eucalyptus globulus[J]. Industrial & Engineering Chemistry Research, 1997, 36(10): 4114.
[29] Sannigrahi P, Kim D, Jung S, et al. Pseudo-lignin and pretreatment chemistry[J]. Energy & Environmental Science, 2011, 4(4): 1306.
[30] Li H, Pu Y, Kumar R, et al. Investigation of lignin deposition on cellulose during hydrothermal pretreatment, its effect on cellulose hydrolysis, and underlying mechanisms[J]. Biotechnology and Bioengineering, 2014, 111(3): 485.
[31] Hu F, Jung S, Ragauskas A. Pseudo-lignin formation and its impact on enzymatic hydrolysis[J]. Bioresource Technology, 2012, 117: 7.
[32] Rowe J, Conner A. Extractives in Eastern Hardwoods: A Review[R]. Forest Products Lab Madison Wis, 1979.
[33] Pei Ji-cheng. Lignocellulosic Chemistry[M]. Beijing: China Light Industry Press, 2012: 269.
裴继诚. 植物纤维化学[M].北京: 中国轻工业出版社, 2012: 269.
[34] Jacobs-Young C, Venditti R, Joyce T. Effect of enzymatic pretreatment on the diffusion of sodium hydroxide in wood[J]. TAPPI Journal, 1998, 81(1): 260.
[35] Siau J F. Transport processes in wood[M]. New York: Springer-Verlag, 1984: 73.
[36] Kerr A, Goring D. The role of hemicelluloses in the delignification of wood[J]. Canadian Journal of Chemistry, 1975, 53: 952.
[37] Zanuttini M, Marzocchi V, Citroni M. Alkaline treatment of poplar wood[J]. European Journal of Wood and Wood Products, 1999, 57(3): 185.
