溶剂交换法制备纳米纤维素多孔薄膜及其结构表征
2018-05-25龙克莹王华山马晓红查瑞涛
龙克莹 王华山,* 马晓红 查瑞涛
(1. 天津科技大学化工与材料学院,天津,300457;2. 吴忠市回民中学,宁夏吴忠,751100; 3. 国家纳米科学中心,北京,100190)
在环境污染和能源短缺的当今,开发和应用生物友好、可全生物降解的薄膜类材料越来越被重视。纤维素基生物质资源是地球上最丰富的可再生资源,植物每年通过光合作用能产生高达1550亿t纤维素类生物质[1]。目前,纤维素薄膜主要采用有机溶剂法制备,其生产成本高、溶剂污染性高、回收困难。
纳米纤维素(Nanocellulose)是在某一维度上具有纳米尺寸及其效应的纤维素,其生物相容性好、可生物降解、密度低、强度高且易于获得[2]。纳米纤维素的主要制备方法有化学法、生物法和机械法。按照制备方法的不同,纳米纤维素可分为纳米微晶纤维素(Nanocrystalline cellulose,NCC)、微纤化纤维素(Microfibrillated cellulose,MFC)、纳纤化纤维素(Nanofibrillated cellulose,NFC)和细菌纤维素(Bacterial cellulose,BC)。与传统的可再生纤维素相比,NFC薄膜可在条件非常温和的水性介质中成形,不需要使用二硫化碳等有机溶剂,这简化了产品生产工艺、极大地降低了污染,具有广阔的应用前景。本实验采用溶剂交换法制备NFC多孔薄膜,并对其表面形貌、孔隙结构、润湿性和热稳定性进行了研究。
1 实 验
1.1 试剂和仪器
漂白硫酸盐针叶木浆(打浆度:15°SR),山东华泰纸业股份有限公司;2, 2, 6, 6-四甲基哌啶氧化物(TEMPO),分析纯,北京普益华科技有限公司;次氯酸钠,分析纯,6%~14%活性氯,上海阿拉丁生化科技股份有限公司;溴化钠,分析纯,纯度99%,上海阿拉丁生化科技股份有限公司;NaOH,分析纯,纯度96%,上海阿拉丁生化科技股份有限公司;醋酸双氧铀,质量分数3%,北京生东科技有限公司;乙醇,分析纯,纯度≥99.7%,北京化工厂;叔丁醇,分析纯,纯度≥99.0%,上海阿拉丁生化科技股份有限公司。其他试剂均为分析纯,未经纯化直接使用。
可调高速匀浆机,FSH- 2,江苏省金坛市精达仪器制造厂;高压均质机,Y-QY,天津市特斯达食品机械科技有限公司;超声波清洗机,SB- 120D,宁波新芝生物科技股份有限公司;冷冻干燥机,LGD- 0.1,上海堪鑫仪器设备有限公司;超高分辨冷场发射扫描电子显微镜,Hitachi-SU8220,日本日立公司;六硼化镧透射电子显微镜,Tecnai G2 20 S-TWIN,美国FEI公司;自动快速扫描探针显微镜,Dimension 3100,美国Veeco公司;离子溅射仪,E- 1010,日本日立公司;纳米粒度及Zeta电位分析仪,Zetasizer Nano ZS,英国马尔文仪器有限公司;X射线衍射仪,TZY-Xrd,日本理学公司;全自动接触角测量仪,DSA100,德国克吕士公司;高性能全自动压汞仪,AutoPore IV 9500,美国麦克默瑞提克仪器有限公司;热重分析仪,TG 209F3,德国耐驰公司。
1.2 NFC的制备
取10 g漂白硫酸盐针叶木浆,加入去离子水,搅拌分散并调节浆浓至1%。依次向浆料中加入TEMPO(0.015 g/g绝干浆)、NaClO(5.2 mmol/g绝干浆)和NaBr(0.1 g/g绝干浆),持续搅拌,转速设置为300 r/min,反应体系温度控制为25℃;用0.5 mol/L的NaOH溶液调节反应体系的pH值至9.9。反应结束后停止搅拌,用去离子水洗涤氧化浆料。将氧化浆料按以下条件进行高压均质处理:浆料进样浓度0.5%,操作压力160 MPa,循环3次。将高压均质后得到的NFC分散液调节至固含量1.2%,然后放入4℃冰箱中储存备用。
1.3 NFC的结构表征
1.3.1形貌表征
透射电子显微镜表征:配制不同浓度的NFC分散液,并超声分散处理10 min。取10 μL超声分散后的NFC分散液并滴加到铜网中,待分散液干燥后,再加入质量分数为3%的醋酸双氧铀染色液染色,以提高衬度。2 min后,用滤纸将多余的醋酸双氧铀染色液吸出,风干。最后用六硼化镧透射电子显微镜在200 kV的加速电压下对NFC进行形貌表征。
扫描探针显微镜表征:配制不同浓度的NFC分散液,并超声分散处理10 min。取10 μL超声分散后的NFC分散液并滴加到干净的硅片中。充分风干后,用自动快速扫描探针显微镜对NFC进行形貌表征。
1.3.2Zeta电位表征
将NFC分散液用去离子水稀释至浓度0.1%,并超声分散处理10 min。取1 mL超声后的样品置于样品池中,用纳米粒度及Zeta电位分析仪测定其Zeta电位。
1.3.3X射线衍射表征
将NFC分散液在-20℃下冷冻固化,然后在冷冻干燥机中干燥,得到NFC固体。将NFC固体置于石英玻璃模具的凹槽中,压平,放入X射线衍射仪中,在2θ=5°~50°的范围内进行扫描。
1.4 NFC多孔薄膜的制备
将NFC分散液用去离子水稀释至浓度为0.3%,用匀浆机在约1.6万r/s的速度下均质处理10 min。取45 mL均质后的NFC分散液并倒入垫有醋酸纤维素滤膜、直径为4 cm的布氏漏斗中进行真空抽滤,得到NFC湿膜。
采用下述不同溶剂交换和干燥方法制备NFC多孔薄膜:
(1)将真空抽滤后的NFC湿膜室温风干。
(2)将真空抽滤后的NFC湿膜冷冻干燥。
(3)将真空抽滤后的NFC湿膜置于乙醇中进行溶剂交换24 h,室温风干。
(4)将真空抽滤后的NFC湿膜置于乙醇中进行溶剂交换24 h,冷冻干燥。
(5)将真空抽滤后的NFC湿膜先置于乙醇中进行溶剂交换24 h,再置于叔丁醇中溶剂交换24 h,最后室温风干。
(6)将真空抽滤后的NFC湿膜先置于乙醇中进行溶剂交换24 h,再置于叔丁醇中溶剂交换24 h,最后冷冻干燥。
将不同方法制得的NFC多孔薄膜置于干燥器中,备用。
1.5 NFC多孔薄膜的表征
1.5.1形貌表征
将不同方法制备的NFC多孔薄膜,用导电胶固定在样品台上,用离子溅射仪对样品进行喷金处理以提高其表面导电性,喷金时间为30 s。然后用超高分辨冷场发射扫描电子显微镜在5 kV加速电压的条件下观察NFC多孔薄膜表面与截面形貌。
1.5.2NFC多孔薄膜孔隙率和比表面积表征
NFC多孔薄膜的孔隙率和比表面积是在AutoPore IV 9500高性能全自动压汞仪上测定的。称取一定量裁剪好的NFC多孔薄膜,将其装入膨胀计中。将膨胀计密封好后安装到全自动压汞仪上,真空条件下将汞注入装有样品的膨胀计中,然后将膨胀计放入高压站进行分析,最高压力为30 000 Psia (1 Psia=6.895 kPa)。在压汞过程中,随着压力的升高,汞逐渐被压至样品的孔隙中,所产生的电信号通过传感器输入计算机中进行数据处理,从而计算出NFC多孔薄膜的孔隙率及比表面积。
1.5.3水接触角表征
通过去离子水与NFC多孔薄膜的接触角大小来衡量薄膜的表面润湿性能。实验采用全自动接触角测量仪,测试过程中水滴量为3 μL。
1.5.4热失重表征
样品的热稳定性能通过TG进行测定。升温速率为5℃/min,载气为氮气,温度范围为25~800℃。
2 结果与讨论
2.1 NFC的结构表征
2.1.1NFC的微观形貌与Zeta电位分析
图1为NFC的微观形貌图。由图1可知,NFC具有较大的长径比,直径为10~20 nm,呈高度网状缠结结构,这种结构显著提高了NFC的流动性,从而表现出凝胶状行为[3]。

图1 NFC的TEM图(a);NFC的AFM图(b)
Zeta电位是评价分散体系稳定性能的重要参数。Zeta电位的绝对值越高,分散体系越稳定;当Zeta电位的绝对值大于61时,分散体系稳定性较好。Zeta电位绝对值越低,分散体系越趋于团聚,当Zeta电位的绝对值小于5时,分散体系会快速凝结[4]。图2为NFC的Zeta电位图,由图2可知,NFC分散液的Zeta电位为-30.1 mV,表明NFC在水介质中呈负电性,且具有较好的胶体稳定性。

图2 NFC的Zeta电位检测图
2.1.2NFC的晶体结构分析


图3 NFC的X射线衍射谱图
2.2 NFC多孔薄膜性能分析
2.2.1不同制备方法对NFC多孔薄膜表面形貌的影响
图4为6种不同方法制得的NFC多孔薄膜的表面形貌。真空抽滤得到的NFC湿膜未经任何处理直接室温风干或冷冻干燥得到的NFC多孔薄膜表面均有皴裂纹(见图4a和图4d)。NFC湿膜经乙醇溶剂交换并冷冻干燥得到的NFC多孔薄膜表面形成均匀致密的孔(孔径约为50 nm),而经乙醇溶液交换并自然风干得到的NFC多孔薄膜表面的孔数量较少(见图4b和图4e)。NFC湿膜经乙醇溶剂交换后,再将其浸泡于叔丁醇中进行二次溶剂交换,最后冷冻干燥得到的NFC多孔薄膜孔径(孔径100~200 nm)较仅进行乙醇溶剂交换并冷冻干燥的NFC多孔薄膜孔径大(见图4f);与冷冻干燥得到的NFC多孔薄膜相比,自然风干的NFC多孔薄膜孔径小而少(见图4c)。与乙醇相比,叔丁醇的凝固点(25.7℃)高得多。叔丁醇在冻结中占据了乙醇分子的位置,容易形成针状结晶。与水和乙醇相比,叔丁醇更易于升华,因此形成更大孔径的薄膜。
大孔径的纤维素薄膜有更好的毛细作用和较高的层析速度,具有较好的润湿性和吸附性能,在高效过滤[6]、分析检测[7]和生物医药[8]等领域有广泛的应用前景。因此,本实验对先用乙醇后用叔丁醇溶剂交换并冷冻干燥得到的NFC多孔薄膜(简写为:叔丁醇-NFC薄膜)进行了详细表征,研究其孔隙率、比表面积、润湿性和热稳定性能。

图4 不同溶剂交换和干燥方法制得的NFC多孔薄膜的表面形貌
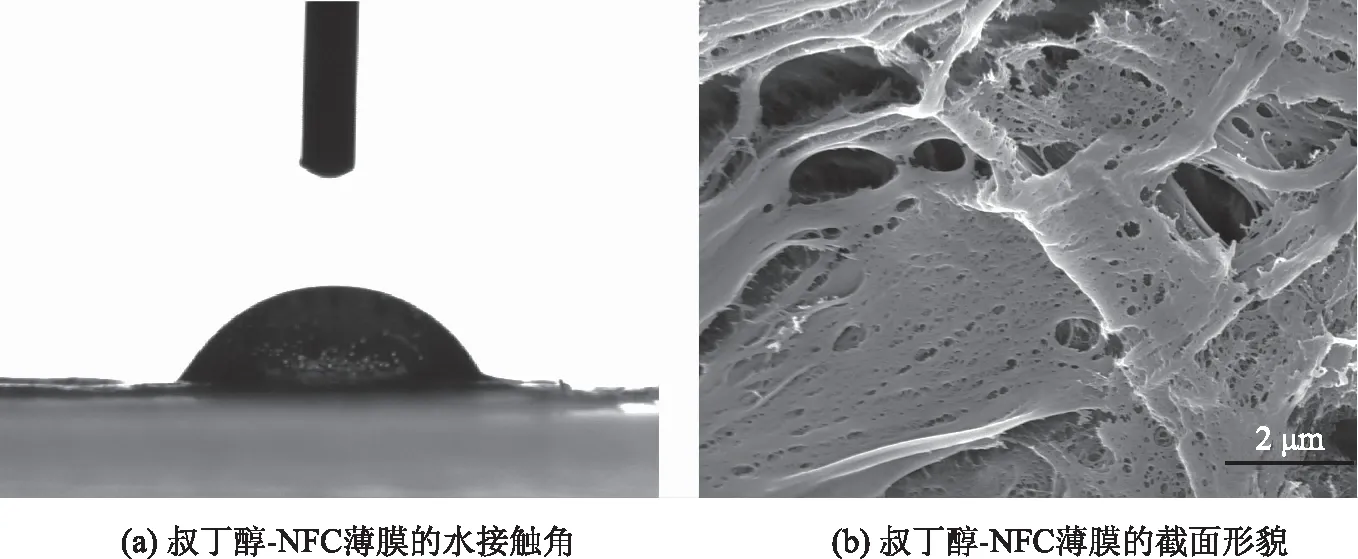
图5 叔丁醇-NFC薄膜的水接触角(a);叔丁醇-NFC薄膜的截面形貌(b)
2.2.2叔丁醇-NFC薄膜的孔隙率及比表面积分析
叔丁醇-NFC薄膜在100~200 nm范围内有较大体积的孔分布,中值孔径为140 nm,与图4f相吻合;样品孔隙率为42.95%,比表面积为87.73 m2/g,适合作为分离膜材料。
2.2.3叔丁醇-NFC薄膜的润湿性分析
叔丁醇-NFC薄膜的水接触角为61.6°(见图5a),表明叔丁醇-NFC薄膜的润湿性较强。叔丁醇-NFC薄膜具有三维多孔结构(见图5b),这主要是由于在冷冻干燥过程中,NFC湿膜中的叔丁醇直接从固态升华到气态,有效地阻止了干燥过程中产生的毛细管压力,避免了薄膜内部结构的坍塌,保持其三维网状结构[9],从而促进薄膜的润湿作用。
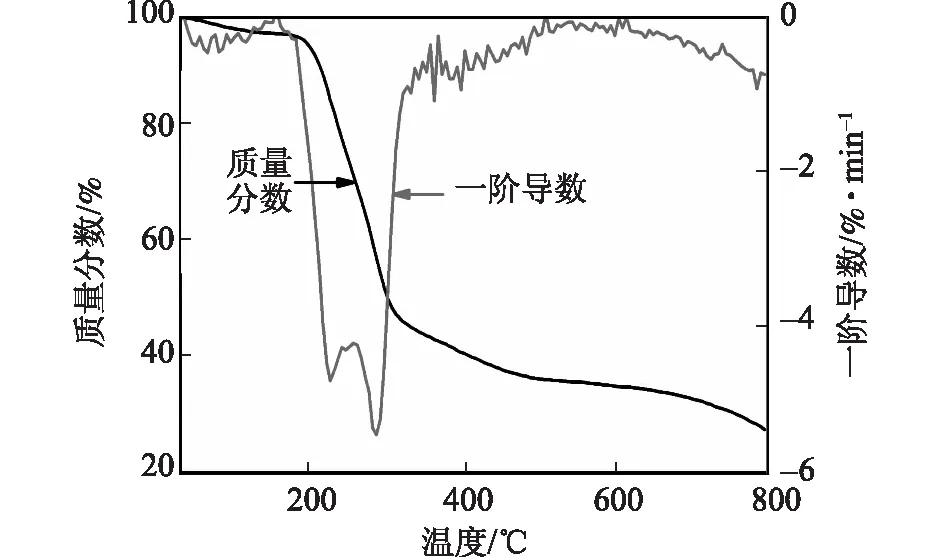
图6 叔丁醇-NFC薄膜的热失重一阶导数曲线
2.2.4叔丁醇-NFC薄膜的热稳定性
图6为叔丁醇-NFC薄膜在氮气气氛下的TG和DTG曲线。当温度低于160℃时,叔丁醇-NFC薄膜的质量损失主要是样品中吸附的水蒸发和解吸[10]。从220℃开始,叔丁醇-NFC薄膜发生剧烈热分解,最大降解速率温度为291.3℃,在330℃左右降解终止,这一阶段叔丁醇-NFC薄膜的质量损失率达54%。经过化学处理和机械力的作用,纤维素结构中的糖苷键发生断裂,结晶区受到破坏,从而暴露出更多的缺陷。暴露在纳米纤维素颗粒外部表面的分子链段先受热分解,产生非可燃气体(CO2)和其他相对分子质量低的易挥发性化合物等,致使分解速率较快。当温度大于330℃时,叔丁醇-NFC薄膜分解速率变慢,最终残留物比例约为30%[11]。
3 结 论
3.1将经真空抽滤得到的纳纤化纤维素(NFC)湿膜先用乙醇后用叔丁醇溶剂交换,最后冷冻干燥得到叔丁醇-NFC薄膜,其表面孔径分布均匀、孔隙率为42.95%、比表面积为87.73 m2/g;与水和乙醇相比,叔丁醇更易于升华,有利于形成更大孔径的薄膜。
3.2叔丁醇-NFC薄膜的水接触角为61.6,具有良好的润湿性和热稳定性,在高效过滤、分析检测和生物医药等领域具有广泛的应用前景。
参 考 文 献
[1] Feng Y, Li D, Ren N. Study on saccharification and fermentation of lignocellulose to ethanol using mixed microbial species [J]. Acta Energiae Solaris Sinica, 2007, 28(4): 375.
冯玉杰, 李冬梅, 任南琪. 混合菌群用于纤维素糖化和燃料酒精发酵的试验研究[J]. 太阳能学报, 2007, 28(4): 375.
[2] XiaoNan Hao, KaiWen Mou, XingYu Jiang, et al. High-value Applications of Nanocellulose[J]. Paper and Biomaterials, 2017, 2(4): 58.
[3] Xu X, Liu F, Jiang L, et al. Cellulose nanocrystals vs. cellulose nanofibrils: a comparative study on their microstructures and effects as polymer reinforcing agents [J]. ACS Applied Materials & Interfaces, 2013, 5(8): 2999.
[4] Salas C, Nypelö T, Rodriguez-Abreu C, et al. Nanocellulose properties and applications in colloids and interfaces [J]. Current Opinion in Colloid & Interface Science, 2014, 19(5): 383.
[5] Mohamed M A, Salleh W N W, Jaafar J, et al. Physicochemical properties of “green” nanocrystalline cellulose isolated from recycled newspaper [J]. RSC Advances, 2015, 5(38): 29842.
[6] Bai H, Zan X, Juay J, et al. Hierarchical heteroarchitectures functionalized membrane for high efficient water purification [J]. Journal of Membrane Science, 2015, 475: 245.
[7] Chee G. A novel whole-cell biosensor for the determination of trichloroethylene [J]. Sensors & Actuators B. Chemical, 2016, 237: 836.
[8] Zhang H, Luo X, Tang H, et al. A novel candidate for wound dressing: Transparent porous maghemite/cellulose nanocomposite membranes with controlled release of doxorubicin from a simple approach [J]. Materials Science & Engineering C, Materials for Biological Applications, 2017, 79: 84.
[9] Wang L, Xu H. Preparation of nano porous TiO2material using freeze-drying method [J]. New Building Materials, 2010, 37(6): 5.
王立久, 徐海珣. 冷冻干燥法制备纳米TiO2多孔材料的研究[J]. 新型建筑材料, 2010, 37(6): 5.
[10] Yue Y, Zhou C, French A D, et al. Comparative properties of cellulose nano-crystals from native and mercerized cotton fibers [J]. Cellulose, 2012, 19(4): 1173.
[11] Liu Q. Study on controlling pore structure of nanofibrillated cellulose based foam materials [D]. Xi’an: Shaanxi University of Science and Technology, 2017.
刘强. 纳米纤维素泡沫材料孔结构调控技术的研究[D]. 西安: 陕西科技大学, 2017.
