上调GDF-15表达对H2O2诱导的H9C2心肌细胞生物学特性及PI3K/AKT信号通路的影响①
2018-05-25张松林和旭梅范粉灵
王 军 张松林 和旭梅 何 璐 范粉灵
(西安交通大学第一附属医院结构性心脏病科,西安 710061)
心血管疾病是由多种信号途径调控的病理过程,目前已发现多个经典的心血管疾病相关的风险因子,其中氧化应激对其发生起到了重要的调控作用[1,2]。生长分化因子-15(Growth differentiation factor-15,GDF-15)是TGF-β家族中的一员,在炎症、外伤、心脑血管疾病、肿瘤等应激状态下可大量表达[3-5]。有研究显示,GDF-15在缺血/再灌注模型心肌中有强烈表达,心肌细胞在缺血/再灌注损伤中也可检测到GDF-15表达水平的升高[6,7],因此研究者推测心脏中GDF-15的表达可能是避免缺血/再灌注损伤的新型防御机制;GDF-15基因敲除可明显增加小鼠的心肌肥厚,并伴随舒张和收缩功能的恶化[8]。也有研究发现,GDF-15在缺血损伤的心肌中表达强烈,并可诱导心肌细胞凋亡[9,10]。以上的研究说明,GDF-15基因可能是一个新的心脏保护因子。但关于GDF-15对心肌细胞生物学特性的影响及机制尚未清楚。因此,本研究通过制备H2O2诱导损伤H9C2心肌细胞模型,检测细胞的增殖及凋亡情况及机制,为心血管疾病的治疗提供理论基础。
1 材料与方法
1.1试剂和仪器 大鼠心肌细胞H9C2购自上海博谷生物细胞库;LipofectamineTM2000转染试剂盒、RNA提取试剂盒、逆转录试剂盒均购自美国Invitrogen公司;增强型ECL化学发光检测试剂盒、CCK8试剂盒、二喹啉甲酸(Bicinchoninic acid,BCA)试剂盒、膜联蛋白V(Annexin V)-异硫/碘化丙锭(PI)细胞凋亡试剂盒、DCFH-DA探针均购自中国碧云天试剂公司;GDF-15、Ki67、B细胞淋巴瘤/白血病-2(B cell lymphoma/lewkmia-2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2 Associated X Protein,Bax)、磷脂酰肌醇3-激酶(Phosphatidylinositol 3-kinase,PI3K)、磷酸化的丝氨酸苏氨酸激酶(Phosphorylated Serine/threonine kinase,p-AKT)均购自美国SANTA CRUZ;酶标仪购自美国Molecular Devices;实时荧光定量PCR仪购自瑞士Roche;流式细胞仪购自美国BD公司。
1.2方法
1.2.1细胞培养 H9C2心肌细胞用DMEM培养基(含10%胎牛血清),于37℃、5%CO2培养箱中培养。每2~3 d传代1次。
1.2.2H2O2对H9C2心肌细胞增殖的影响 将H9C2心肌细胞1 000个/孔接种于96孔板中,培养24 h后,0、25、50、100、200、400 μmol/L的H2O2作用于细胞24 h,每孔中加入CCK8试剂10 μl,置于培养箱继续孵育2 h,收集细胞。利用空白对照孔调零,酶标仪测定570nm的吸光度A,实验重复3次。细胞增殖率=(实验组细胞A/对照组细胞A)×100%。
1.2.3分组及转染 实验分为4组,即Control组(细胞不经特殊处理)、NC组(细胞转染不具有任何干扰作用的pcDNA3.1载体)、H2O2组(加入H2O2200 μmol/L)、GDF-15+H2O2组(细胞中转染pcDNA3.1-GDF-15,然后加入终浓度为200 μmol/L的H2O2)。根据LipofectamineTM2000脂质体介导法进行转染。24 h后对各组细胞进行检测。
1.2.4各组细胞GDF-15的表达检测 采用RT-PCR及Western blot检测GDF-15的表达。RT-PCR基本步骤如下:收集转染后培养24 h的细胞,利用Trizol提取细胞中的总RNA并进行逆转录,以GAPDH作为内参基因,用SYBR Green qPCR试剂盒对GAPDH和GDF-15进行荧光定量PCR扩增。GAPDH和GDF-15的引物序列如下:GDF-15 F:5′-CATTGCCTGAGCAGCGACG-3′,R:5′-GGTAGGCTTCGGGGAGACC-3′。GAPDH F:5′-GAAGGTGAAGGTCGGAGTC-3′,R:5′-GAAGATGGTGATGGGATT-TC-3′。PCR反应条件及反应体系按照试剂盒的说明进行。实验重复3次,取Ct均值,通过2-ΔΔCt法进行统计。Western blot简要步骤如下:提取各组细胞中的蛋白,BCA试剂盒对蛋白进行定量,取40 μg蛋白样品进行SDS-PAGE电泳,电转膜1.5 h至硝基纤维素膜,37℃、5%的脱脂奶粉封闭1 h,4℃孵育GDF-15、GAPDH(皆按照1∶1 000稀释)一抗过夜,次日加入二抗,37℃孵育2 h。增强型化学法(ECL)显影,Quantity one软件对蛋白灰度值进行分析。
1.2.5各组细胞活力检测 按照1.2.3分组处理细胞,24 h后收集细胞,每孔中加入CCK8试剂10 μl,培养箱内孵育2 h,酶标仪于570 nm处测定吸光值(A)。每组设置6个复孔,实验重复3次。
1.2.6各组细胞凋亡率检测 收集按照1.2.3处理后的细胞,采用Annexin V/PI双染法检测细胞凋亡。预冷的PBS洗涤细胞,再加入300 μl结合缓冲液悬浮细胞,取100 μl细胞悬液至流式管中,加入Annexin V-FITC及PI 各5 μl,混匀后室温避光孵育15 min,反应管中再加入400 μl的PBS。1 h内上流式细胞仪,检测细胞的凋亡情况。
1.2.7各组细胞活性氧簇(Reactive oxygen species,ROS)检测 收集按照1.2.3处理后的细胞,继续培养24 h,加入磷酸盐缓冲液洗涤细胞,再加入含有20 μmol/L的2′,7′-二氯二氢荧光素黄二乙酸酯(DCFH-DA)的磷酸盐缓冲液于37℃、5%CO2培养箱中孵育2 h,加入不含胎牛血清的培养液洗涤细胞以去掉未反应的DCFH-DA,重悬细胞,流式细胞仪检测各组细胞的荧光强度(激发波长为488 nm和发射波长为525 nm)。以荧光强度反映细胞内的ROS水平。实验重复3次。
1.2.8各组细胞Ki67、Bcl-2、Bax、PI3K、p-AKT蛋白表达检测 参照1.2.4方法检测增殖相关蛋白Ki67、凋亡相关蛋白Bcl-2和Bax及PI3K/AKT信号通路相关蛋白PI3K和p-AKT的蛋白表达。
1.2.9PI3K/AKT信号通路抑制剂对心肌细胞的影响 10 μmol/L的PI3K/AKT信号通路抑制剂LY294002处理H9C2心肌细胞,通过CCK8法及流式细胞术分别检测GDF-15+H2O2组及PI3K/AKT信号通路抑制剂组的细胞活力及凋亡率,Western blot检测Ki67、Bcl-2、Bax、PI3K、p-AKT蛋白表达。
2 结果
2.1不同浓度H2O2对H9C2心肌细胞增殖的影响 由表1可知,不同浓度H2O2处理H9C2心肌细胞后,细胞活力均受到抑制,且有浓度依赖性(t25=2.867,P25=0.046;t50=4.628,P50=0.010;t100=8.457,P100=0.001;t200=15.084,P200=0.000;t400=19.574,P400=0.000)。由于200 μmol/L的H2O2处理H9C2心肌细胞后可抑制将近一半的细胞增殖,因此选择200 μmol/L的H2O2作为研究对象。
2.2各组细胞GDF-15表达检测 通过RT-PCR检测各组细胞中GDF-15的mRNA表达,Western blot检测GDF-15蛋白表达,结果如图1和表2所示,与Control组比较,H2O2组GDF-15的mRNA及蛋白表达均显著升高(tmRNA=12.802,PmRNA=0.000;t蛋白=6.590,P蛋白=0.003),NC组GDF-15的mRNA及蛋白表达均无明显变化(P>0.05);与H2O2组比较,GDF-15+H2O2组GDF-15的mRNA及蛋白表达均显著升高(tmRNA=8.183,PmRNA=0.001;t蛋白=6.086,P蛋白=0.004)。
2.3各组细胞活力检测 Control组、NC组、H2O2组和GDF-15+H2O2组的细胞活力分别为(100.00±4.62)%、(96.88±4.21)%、(55.12±3.69)%、(73.65±5.23)%,4组间比较差异有统计学意义(F=66.783,P<0.01)。与Control组比较,H2O2组细胞活力显著降低(t=13.147,P=0.000),NC组细胞活力无明显变化(P>0.05);与H2O2组比较,GDF-15+H2O2组的细胞活力显著升高(t=5.014,P=0.007)。见图2。
2.4各组细胞凋亡率检测 Control组、NC组、H2O2组和GDF- 15+H2O2组的细胞凋亡率分别为(3.65±0.53)%、(3.44±0.62)%、(23.26±1.65)%、(14.31±1.36)%,4组比较差异显著(F=207.989,P<0.01)。H2O2组细胞凋亡率显著高于Control组(t=19.599,P=0.000),而GDF-15+H2O2组细胞凋亡显著低于H2O2组(t=7.250,P=0.002)。见图3。
表1不同浓度H2O2对H9C2心肌细胞增殖的影响
Tab.1EffectsofdifferentconcentrationsofH2O2onproliferationofH9C2cardiomyocytes
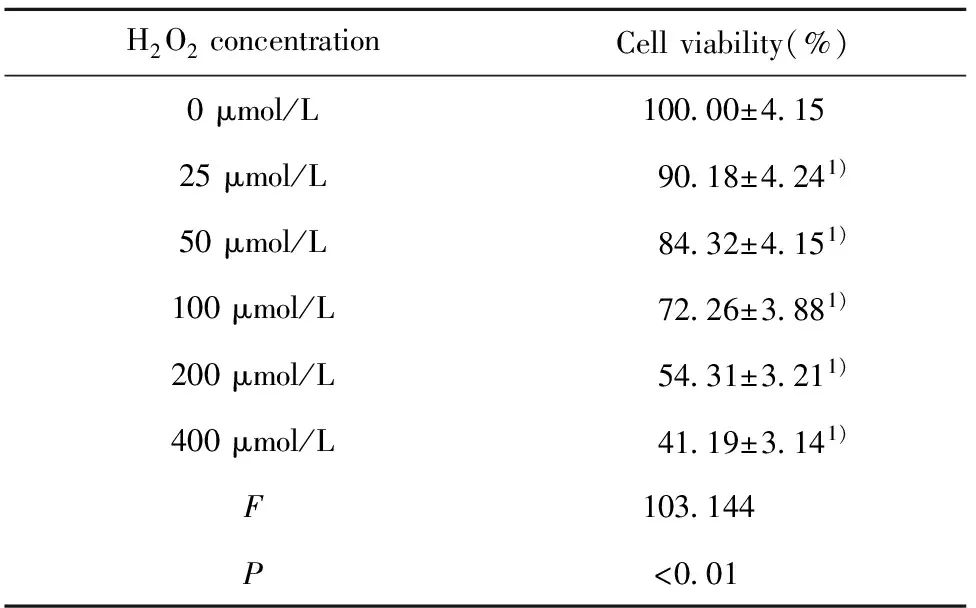
H2O2concentrationCellviability(%)0μmol/L10000±41525μmol/L9018±4241)50μmol/L8432±4151)100μmol/L7226±3881)200μmol/L5431±3211)400μmol/L4119±3141)F103144P<001
Note:Compared with 0 μmol/L,1)P<0.05.
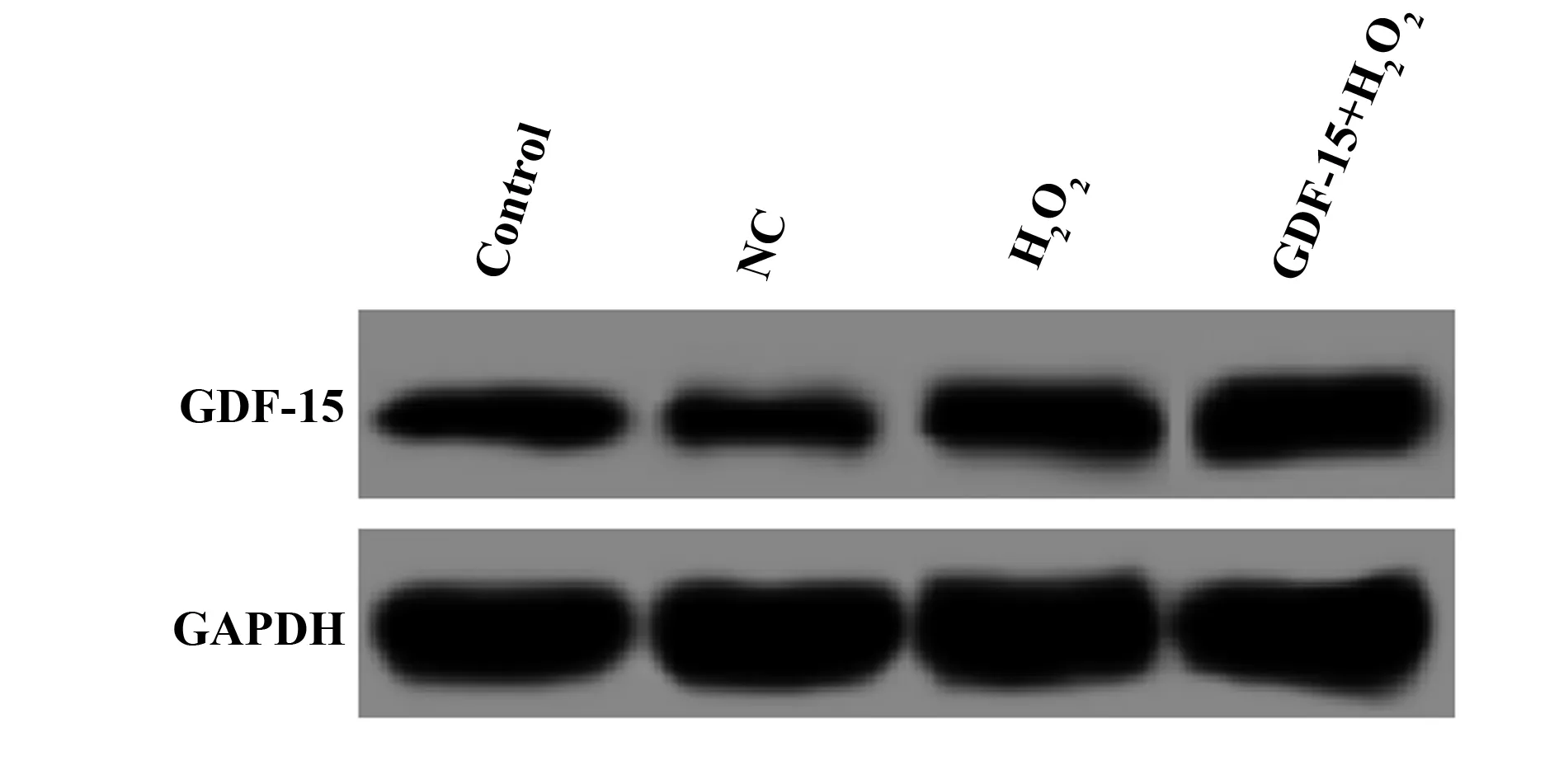
图1 Western blot检测细胞中GDF-15的蛋白表达Fig.1 Western blot was used to detect protein expression of GDF-15 in cells
2.5各组细胞ROS水平检测 ROS水平检测结果如图4所示,Control组、NC组、H2O2组和GDF-15+H2O2组的ROS相对水平分别为(17.62±2.65)、(18.88±3.12)、(59.68±6.18)、(32.15±5.41),4组比较差异具有显著统计学意义(F=54.388,P<0.01) 。H2O2组ROS水平显著高于Control组(t=10.831,P=0.000),而GDF-15+H2O2组的ROS水平显著低于H2O2组(t=5.806,P=0.004)。
2.6各组细胞增殖凋亡相关蛋白表达检测 Control组、NC组、H2O2组和GDF-15+H2O2组Ki67的蛋白表达分别为(0.688±0.053)、(0.681±0.064)、(0.111±0.014)、(0.362±0.042),Bcl-2的蛋白表达分别为(0.321±0.029)、 (0.335±0.032)、(0.097±0.010)、(0.212±0.021),Bax的蛋白表达分别为(0.131±0.016)、(0.139±0.020)、(0.415±0.036)、(0.297±0.021),H2O2组Ki67、Bcl-2的蛋白表达显著低于Control组(tKi67=18.231,PKi67=0.000;tBcl-2=12.648,PBcl-2=0.000),Bax的蛋白表达显著高于Control组(t=12.486,P=0.000);而GDF-15+H2O2组Ki67、Bcl-2的蛋白表达显著高于H2O2组(tKi67=9.820,PKi67=0.001;tBcl-2=8.564,PBcl-2=0.001),Bax的蛋白表达显著低于H2O2组(t=4.904,P=0.008)。见图5。
表2各组细胞中GDF-15的mRNA表达及蛋白表达
Tab.2mRNAandproteinexpressionofGDF-15ineachgroupofcells
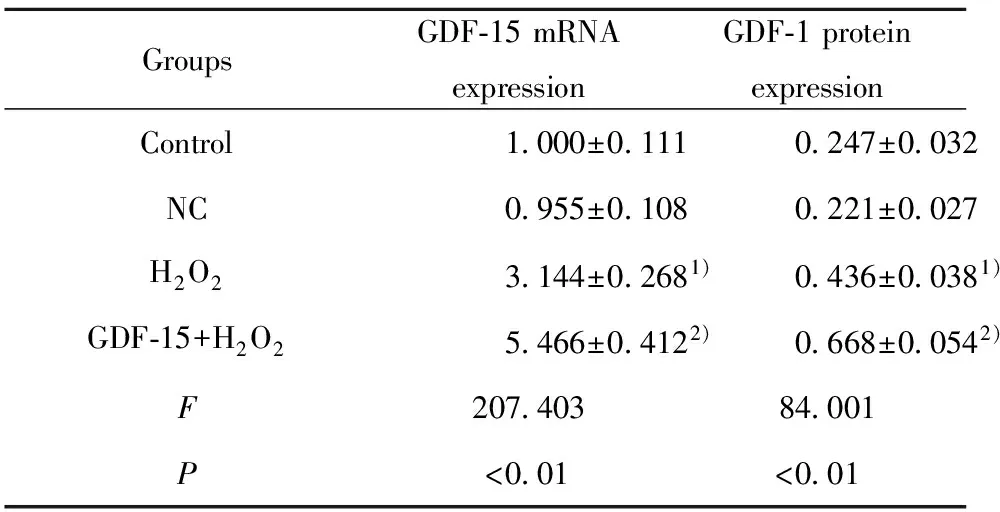
GroupsGDF⁃15mRNAexpressionGDF⁃1proteinexpressionControl1000±01110247±0032NC0955±01080221±0027H2O23144±02681)0436±00381)GDF⁃15+H2O25466±04122)0668±00542)F20740384001P<001<001
Note:Compared with Control group,1)P<0.05;compared with H2O2group,2)P<0.05.
2.7各组细胞PI3K/AKT信号通路PI3K、p-AKT的蛋白表达 Control组、NC组、H2O2组和GDF-15+H2O2组PI3K的蛋白表达分别为(0.462±0.041)、(0.445±0.048)、(0.118±0.012)、(0.302±0.021),p-AKT的蛋白表达分别为(0.277±0.031)、(0.292±0.032)、(0.074±0.009)、(0.132±0.018),4组的PI3K和p-AKT蛋白比较差异具有显著统计学意义(F1=66.840,F2=47.342,P<0.01),H2O2组PI3K、p-AKT的蛋白表达均显著低于Control组(tPI3K=13.947,PPI3K=0.000;tp-AKT=10.892,Pp-AKT=0.000),而GDF-15+H2O2组PI3K、p-AKT的蛋白表达均显著高于H2O2组(tPI3K=13.177,PPI3K=0.000;tp-AKT=4.992,Pp-AKT=0.008)。见图6。
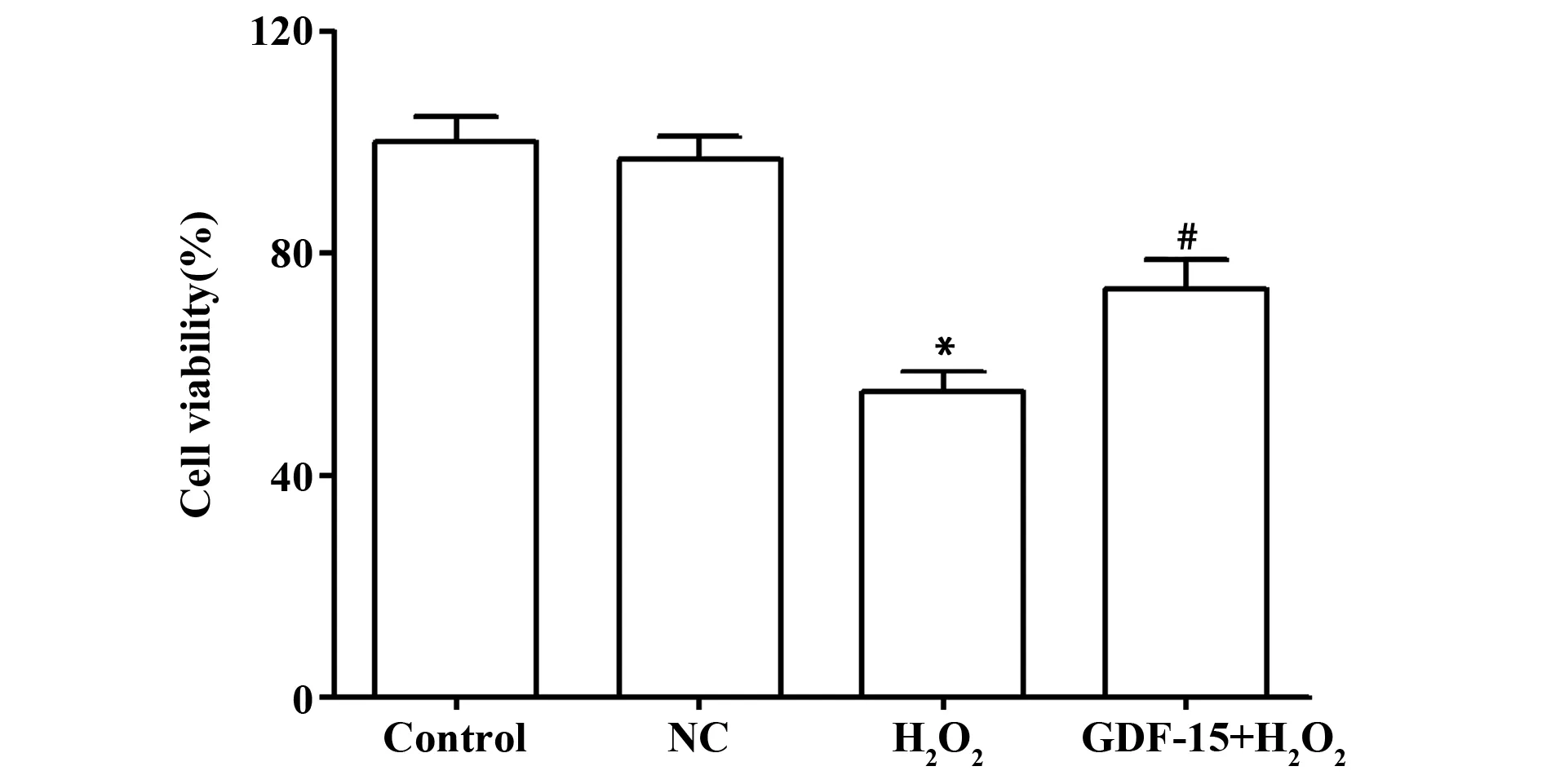
图2 各组细胞活力检测结果Fig.2 Cell viability test results of each groupNote:Compared with Control group,*.P<0.05;compared with H2O2 group,#.P<0.05.
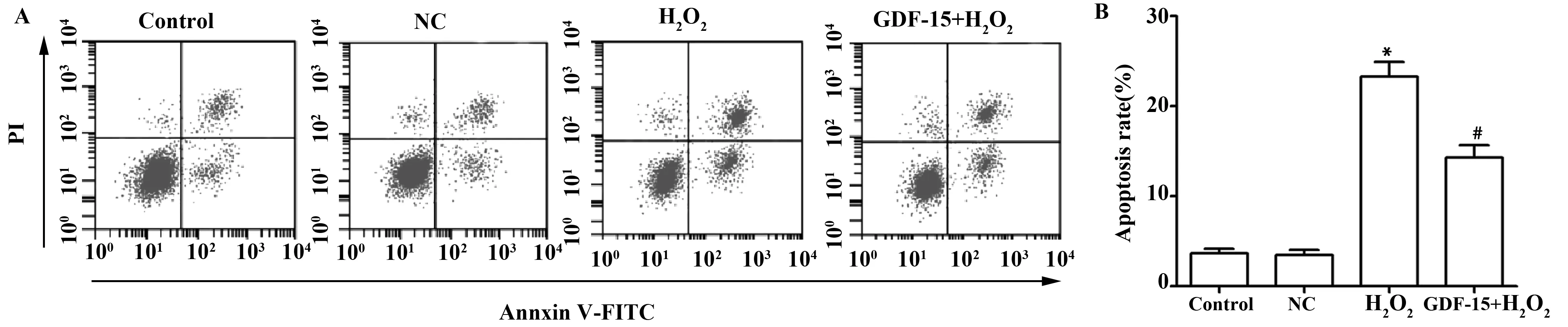
图3 各组细胞凋亡率检测结果Fig.3 Apoptosis rate of each groupNote:A.The apoptosis rate of each group was detected by flow cytometry;B.The apoptosis rate of each group;compared with Control group,*.P<0.05;compared with H2O2 group,#.P<0.05.
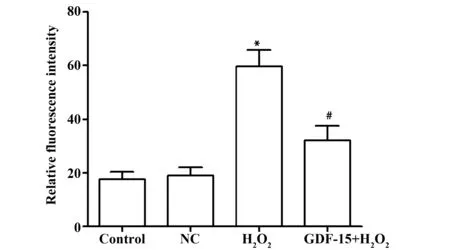
图4 各组细胞ROS水平检测结果Fig.4 ROS levels in each group of cellsNote:Compared with Control group,*.P<0.05;compared with H2O2 group,#.P<0.05.
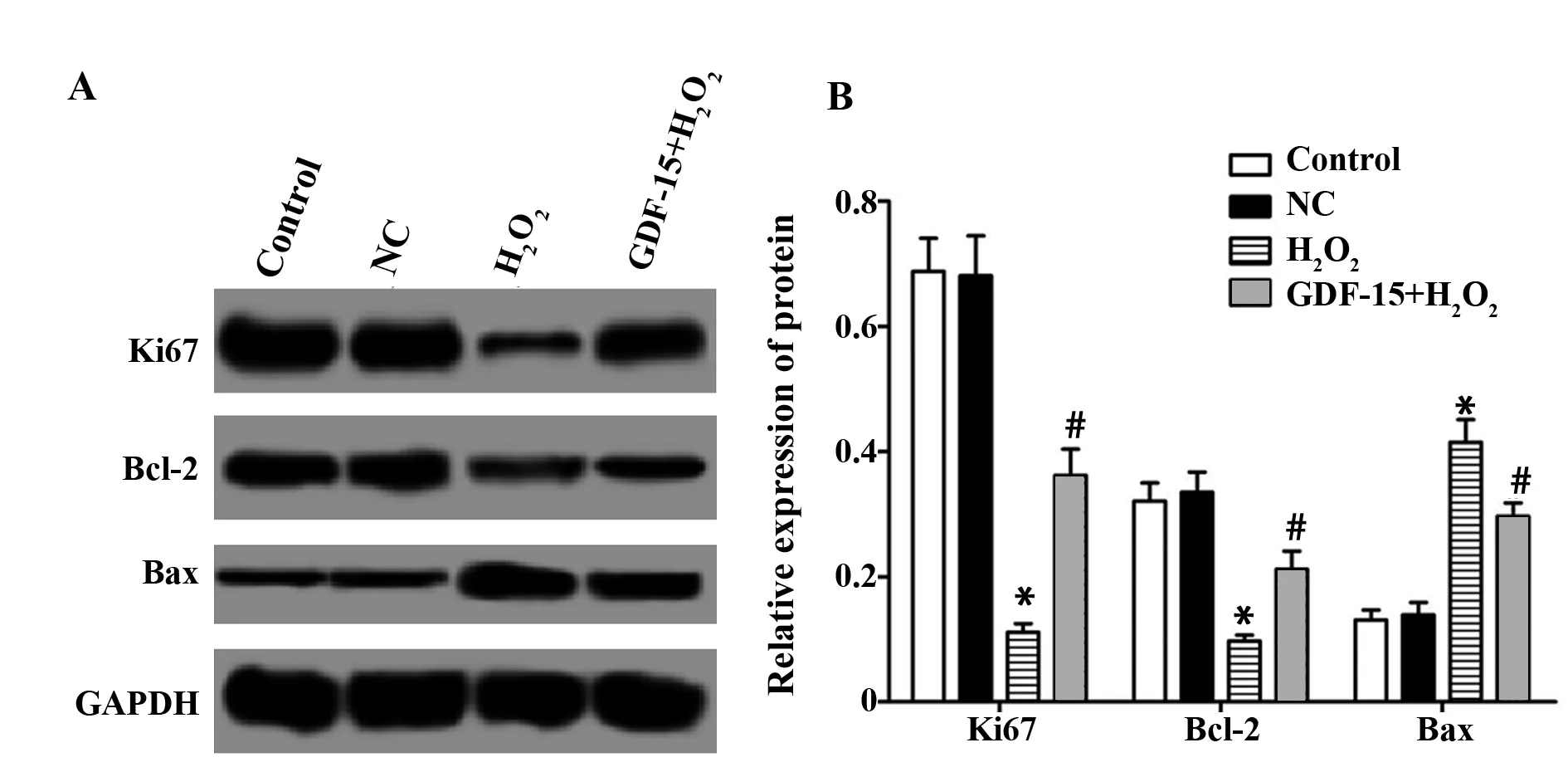
图5 各组细胞Ki67、Bcl-2、Bax蛋白表达检测结果Fig.5 Expression of Ki67,Bcl-2 and Bax proteins in each groupNote:A.Western blot test result diagram;B.The relative expression of protein;compared with Control group,*.P<0.05;compared with H2O2 group,#.P<0.05.
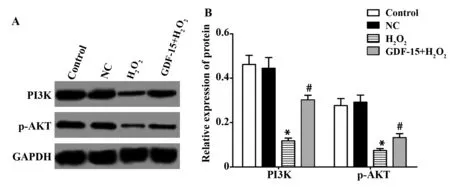
图6 各组细胞PI3K、p-AKT蛋白表达检测结果Fig.6 Expression of PI3K and p-AKT proteins in each groupNote:A.Western blot test result diagram;B.The relative expression of protein;compared with control group,*.P<0.05;compared with H2O2 group,#.P<0.05.
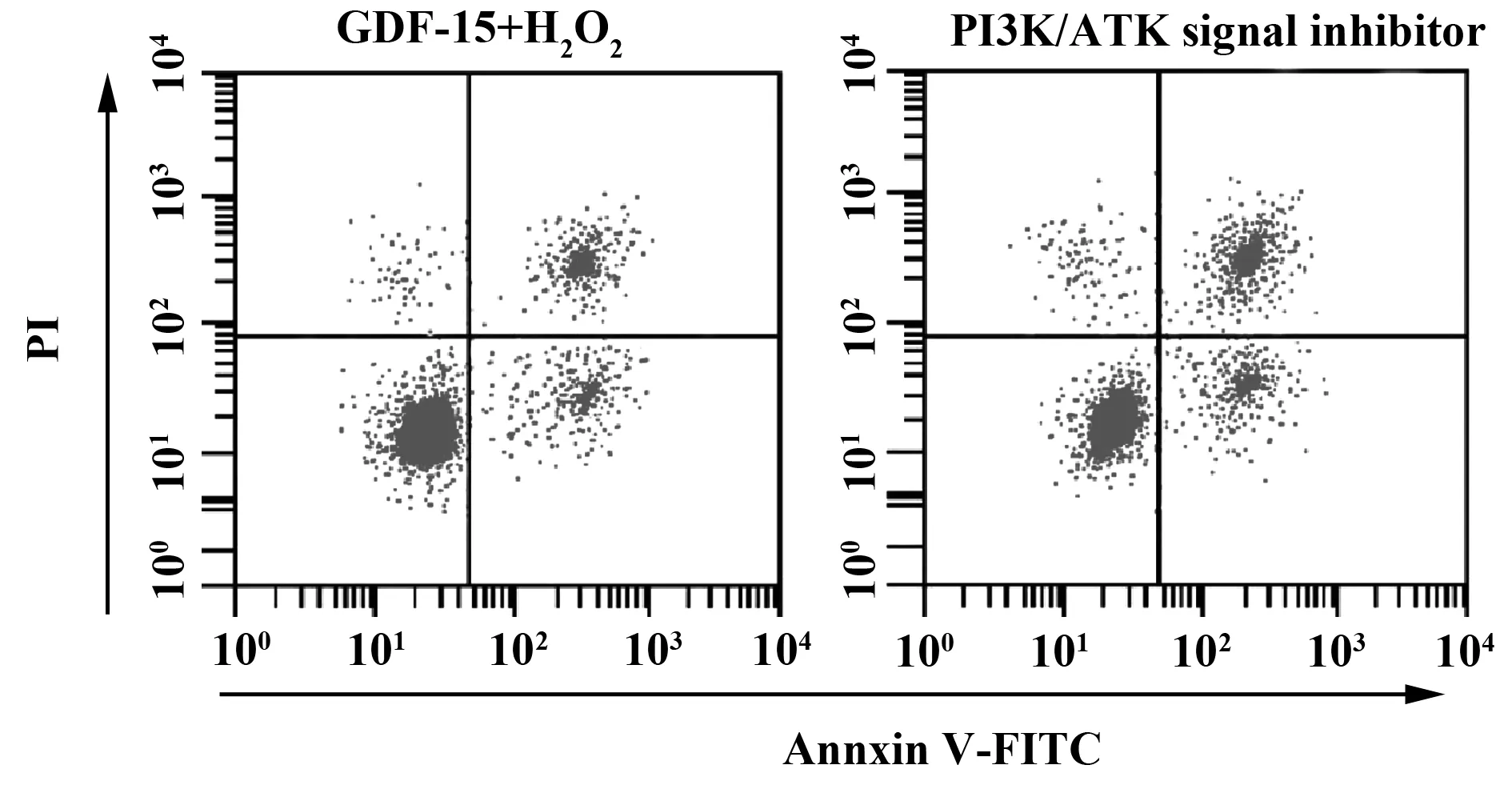
图7 PI3K/AKT信号通路抑制剂对心肌细胞凋亡的影响Fig.7 Effects of inhibitors of AKT signaling pathway on cardiomyocyte apotosis
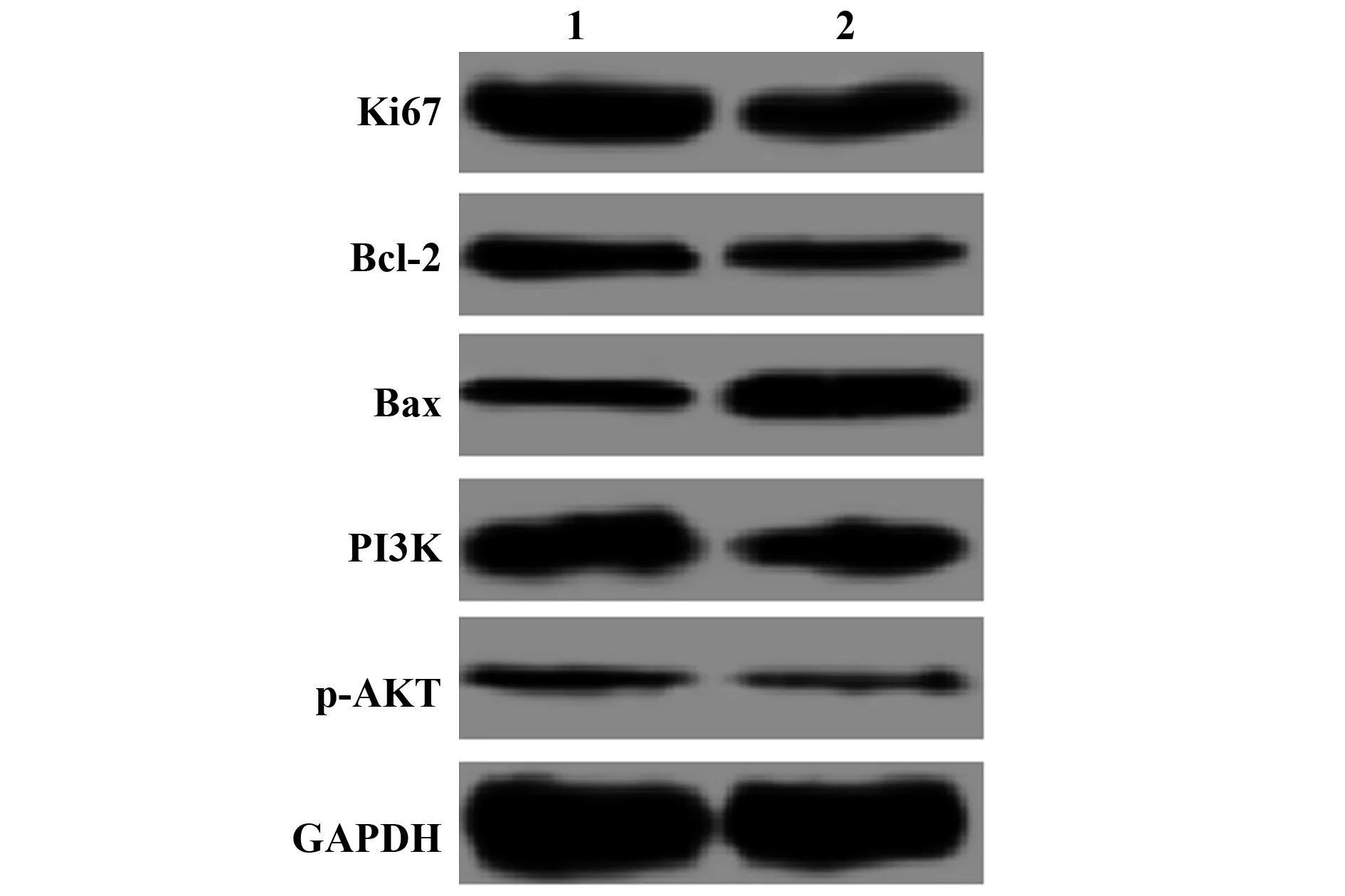
图8 PI3K/AKT信号通路抑制剂对Ki67、Bcl-2、Bax、PI3K、p-AKT蛋白表达的Fig.8 Effects of inhibitors of PI3k/AKT signaling pathway on Ki67,Bcl-2,Bax,PI3K and p-AKT protein expressionNote: 1.GDF-15+H2O2 group;2.PI3K/AKT signaling pathway inhibitor group.
2.8PI3K/AKT信号通路抑制剂对心肌细胞的影响 GDF-15+H2O2组及PI3K/AKT信号抑制剂组的细胞活力分别为(97.88±2.45)%、(80.21±4.37)%,凋亡率分别为(13.75±1.02)%、(20.13±1.43)%,Ki67的蛋白表达分别为(0.352±0.036)、(0.215±0.026),Bcl-2的蛋白表达分别为(0.182±0.020)、(0.115±0.013),Bax的蛋白表达分别为(0.120±0.016)、(0.306±0.032),PI3K的蛋白表达分别为(0.335±0.037)、(0.223±0.034),p-AKT的蛋白表达分别为(0.091±0.011)、(0.037±0.008),PI3K/AKT信号抑制剂组细胞活力及Bcl-2、PI3K和p-AKT的蛋白表达均显著低于GDF-15+H2O2组(t细胞活力=6.109,P细胞活力<0.05;tBcl-2=4.865,PBcl-2<0.05;tp-AKT=6.877,Pp-AKT<0.05),细胞凋亡率及Bax蛋白表达显著高于GDF-15+H2O2组(t凋亡率=6.291,P凋亡率<0.05;tBax=9.005,PBax<0.05)。见图7,图8。
3 讨论
大量研究显示,多种心血管疾病在病理条件下会产生大量的活性氧及氧自由基,引起心肌细胞及组织的氧化应激损伤,从而诱导心肌细胞的凋亡[11-13]。降低由氧化应激导致的心肌细胞凋亡有重要的研究意义。GDF-15是一个分泌蛋白,是TGF-β家族成员之一,正常情况下在心脏中不表达或微量表达,而在心血管疾病的心脏中GDF-15的表达明显升高[14,15]。临床研究证实,GDF-15在外周血中的浓度与冠心病的发生发展相关,并且与心血管事件的发生和死亡率密切相关[16,17];在小鼠的梗死心肌内,GDF-15蛋白快速诱导表达,这可能说明在梗死后的创面修复和愈合中GDF-15起到重要作用[18,19];在心肌梗死诱导的心力衰竭大鼠心肌组织,心肌收缩功能LVEF指标可随心肌组织中GDF-15表达升高而降低[20,21]。以上的研究说明GDF-15在心血管疾病中的作用,但GDF-15对H2O2诱导的心肌细胞增殖凋亡的影响尚未清楚。
H2O2是常用的氧化应激损伤模型[22,23]。因此,本研究首先用不同浓度的H2O2处理心肌细胞,通过CCK8检测细胞增殖情况,以此确定H2O2的最佳浓度。接下来检测上调GDF-15表达对H2O2诱导的心肌细胞增殖凋亡的影响,发现上调GDF-15表达后心肌细胞的增殖显著升高,凋亡降低。这提示GDF-15可通过提高心肌细胞活力及降低凋亡对心肌细胞起保护作用。
GDF-15对心肌细胞增殖凋亡的影响是通过何种方式,目前也尚未明确。多种基因均可影响心肌细胞的增殖,如Ki67、PCNA等,ROS及Bcl-2和Bax可影响心肌细胞的凋亡。研究发现,病理状态下,ROS产生量增多,导致生物功能缺失及线粒体功能障碍,进而引起心肌细胞的损伤[24,25]。心肌细胞中长期有大量的ROS暴露时,也会引起心肌细胞的凋亡、纤维化、坏死,最后导致心律失常、心肌重构等[26,27]。Ki67是一种细胞增殖抗原,可以作为检测细胞增殖活性的一个重要指标,目前已得到广泛应用[28,29]。Bcl-2和Bax是Bcl-2家族的抑凋亡蛋白和促凋亡蛋白,在细胞凋亡过程中,Bax移位到线粒体膜上,导致膜电位发生变化,Bax空间构象变大从而发生活化。Bax发生活化后可诱导线粒体释放细胞色素C,从而诱导细胞的凋亡。Bcl-2和Bax可结合形成二聚体,抑制或促进细胞的凋亡[30,31]。已有多项研究证实可通过上调Bcl-2和下调Bax以降低心肌细胞的凋亡[32,33]。因此,本研究检测各组细胞中ROS水平及Ki67、Bcl-2和Bax蛋白表达,发现上调GDF-15表达后ROS水平降低,Ki67、Bcl-2表达上调,Bax表达下调。通过以上实验可初步推断上调GDF-15表达影响心肌细胞增殖凋亡的机制可能与降低ROS水平,上调Ki67、Bcl-2表达和下调Bax表达有关。
PI3K/AKT信号可影响细胞的增殖凋亡,通过调控下游的Bcl-2、Bax等多种靶蛋白,从而调控细胞的生物学过程[34,35]。研究显示,在H2O2诱导的心肌细胞氧化损伤中,可通过激活PI3K/AKT信号通路促进细胞的增殖及降低细胞凋亡[36-38]。PI3K激活的AKT可通过磷酸化作用抑制或激活下游的P21、Caspase9等靶蛋白,从而介导多种细胞因子、胰岛素等促进细胞增殖,并发挥抗凋亡作用[39,40]。本研究中为了证实上调GDF-15表达是否可引起心肌细胞PI3K/AKT信号的变化,通过Western blot检测PI3K和p-AKT的蛋白表达,结果显示,PI3K和p-AKT的蛋白表达均显著升高。这提示上调GDF-15表达可通过激活PI3K/AKT信号通路降低心肌细胞的氧化损伤。
综上所述,上调GDF-15表达可促进H2O2诱导的H9C2心肌细胞增殖,降低细胞凋亡,其机制可能与调节细胞中ROS水平,Ki67、Bcl-2、Bax表达及PI3K/AKT信号通路有关。本研究为GDF-15在心血管疾病心肌细胞增殖凋亡机制的研究奠定了一定基础。后续的研究将在体内对GDF-15的作用进一步实验验证。
参考文献:
[1] Moon HH,Joo MK,Mok H,etal.MSC-based VEGF gene therapy in rat myocardial infarction model using facial amphipathic bile acid-conjugated polyethyleneimine[J].Biomaterials,2014,35(5):1744-1754.
[2] Neri M,Fineschi V,Di Paolo M,etal.Cardiac oxidative stress and inflammatory cytokines response after myocardial infarction[J].Current Vascular Pharmacol,2015,13(1):26-36.
[3] Lambert JR,Whitson RJ,Iczkowski KA,etal.Reduced expression of GDF-15 is associated with atrophic inflammatory lesions of the prostate[J].Prostate,2015,75(3):255-265.
[4] Xu X,Nie Y,Wang F,etal.Growth differentiation factor (GDF)-15 blocks norepinephrine-induced myocardial hypertrophy via a novel pathway involving inhibition of epidermal growth factor receptor transactivation[J].J Biol Chem,2014,289(14):10084-10094.
[5] Jakubowska K,Pryczynicz A,Dymicka-Piekarska V,etal.The growth differentiation factor-15 (GDF-15) can be useful in the detection of distant metastases in sera of colorectal cancer patients[J].Prog Health Sci,2016,6(1):40-49.
[6] Kahli A,Guenancia C,Zeller M,etal.Growth differentiation factor-15 (GDF-15) levels are associated with cardiac and renal injury in patients undergoing coronary artery bypass grafting with cardiopulmonary bypass[J].PloS One,2014,9(8):e105759.
[7] Zhang Y,Moszczynski LA,Liu Q,etal.Over-expression of growth differentiation factor 15 (GDF15) preventing cold ischemia reperfusion (I/R) injury in heart transplantation through Foxo3a signaling[J].Oncotarget,2017,8(22):36531-36544.
[8] Gaggin HK,Szymonifka J,Bhardwaj A,etal.Head-to-head comparison of serial soluble ST2,growth differentiation factor-15,and highly-sensitive troponin T measurements in patients with chronic heart failure[J].JACC:Heart Failure,2014,2(1):65-72.
[9] Ikeda Y,Kumagai H,Motozawa Y,etal.Growth Differentiation Factor 15 (GDF15) as a Reliable Biomarker for Cardiovascular Risk Assessment[J].International Heart J,2016,57(1):1-2.
[10] Schopfer D W,Ku I A,Regan M,etal.Growth differentiation factor 15 and cardiovascular events in patients with stable ischemic heart disease (The Heart and Soul Study)[J].American Heart J,2014,167(2):186-192.
[11] 王全伟,凡文博,王智昊,等.氧化应激与心血管疾病关系的研究进展[J].中国老年学杂志,2014,34(1):270-273.
Wang QW,Fan WB,Wang ZH,etal.Progression on the relationship between oxidative stress and cardiovascular disease [J]. Chin J Gerontol,2014,34(1):270-273.
[12] Arslan F,Lai R C,Smeets M B,etal.Mesenchymal stem cell-derived exosomes increase ATP levels,decrease oxidative stress and activate PI3K/Akt pathway to enhance myocardial viability and prevent adverse remodeling after myocardial ischemia/reperfusion injury[J].Stem Cell Res,2013,10(3):301-312.
[13] 史晓静,王高频,陶贵周.阿托伐他汀通过激活 Nrf2 通路对抗大鼠缺血再灌注心肌氧化应激损伤和凋亡[J].临床心血管病杂志,2015,31(6):677-679.
Shi XJ,Wang GP,Tao GZ.Prevention of atorvastalin against myocardium oxidative stress and apoptosis of the rats with myocardial ischemia-reperfusion injury through activation of Nrf2 pathway[J].J Clin Cardiol,2015,31(6):677-679.
[14] 刘冬冬,梅岩艾.生长分化因子-15 在神经系统,心血管疾病以及癌症进程中的作用[J].生理学报,2017,69(1):109-121.
Liu DD,Mei YA. Effects of growth differentiation factor-15 (GDF-15) on neurological systems,cardiovascular diseases,and cancer progression[J]. Acta Physiologica Sinica,2017,69(1):109-121.
[15] 徐 璇,于世鹏.生长分化因子-15 在甲状腺乳头状癌中的表达及意义[J].中国免疫学杂志,2014,30(4):468-471.
Xu X,Yu SP. Expression and significance of growth differentiation factor 15 in papillary thyroid carcinoma [J]. Chin J Immunol,2014,30(4):468-471.
[16] Dallmeier D,Brenner H,Mons U,etal.Growth differentiation factor 15,its 12-month relative change,and risk of cardiovascular events and total mortality in patients with stable coronary heart disease:10-year follow-up of the KAROLA study[J].Clin Chem,2016,62(7):982-992.
[17] 武德梅,陈 超,胡安梅,等.冠心病患者血清生长分化因子-15,脑钠肽,超敏 C 反应蛋白水平的变化[J].中国老年学杂志,2013,33(12):2753-2754.
Wu DM,Chen C,Hu AM,etal.The changes of serum growth differentiation factor-15,brain natriuretic peptide,hypersensitive c-reactive protein level in coronary heart disease patients [J]. Chin J Gerontol,2013 (12) :2753-2754.
[18] Chen B,Lu D,Fu Y,etal.Olmesartan prevents cardiac rupture in mice with myocardial infarction by modulating growth differentiation factor 15 and p53[J].Br J Pharmacol,2014,171(15):3741-3753.
[19] Tzikas S,Palapies L,Bakogiannis C,etal.GDF-15 predicts cardiovascular events in acute chest pain patients[J].PLoS One,2017,12(8):e0182314.
[20] 刘灿君.GDF-15 与心肌梗死后心室重塑指标的相关性分析[J].心血管康复医学杂志,2014,23(4):408-411.
Liu CJ. Correlation analysis between growth differentiation factor-15 and ventricular remodeling indexes after myocardial infarction. [J]. Chin J Cadiovasc Rehab Med,2014,23(4):408-411.
[21] Cotter G,Voors AA,Prescott MF,etal.Growth differentiation factor 15 (GDF-15) in patients admitted for acute heart failure:results from the RELAX-AHF study[J].Eur J Heart Failure,2015,17(11):1133-1143.
[22] Rodriguez-Rodriguez A,Jose Egea-Guerrero J,Murillo-Cabezas F,etal.Oxidative stress in traumatic brain injury[J].Curr Med Chem,2014,21(10):1201-1211.
[23] Pan Y,Shi X,Zhang S,etal.miR-210 inhibits oxidative stress damage in myocardial cell injury model[J].Int J Clin Exp Pathol,2017,10(3):3077-3084.
[24] 刘苍龙,王宇光,马增春,等.藜芦碱对 HepG2 细胞的毒性作用及其机制[J].中国药理学与毒理学杂志,2014,28(3):391-397.
Liu CL,Wang YG,Ma ZC,etal.Cytotoxic effect of veratrine hydrochloride on HepG2 cells and its possible mechanism [J]. Chin J Pharmacol Toxicol,2014,28(03):391-397.
[25] Pisarenko O,Shulzhenko V,Studneva I,etal.Structural apelin analogues:mitochondrial ROS inhibition and cardiometabolic protection in myocardial ischaemia reperfusion injury[J].Br J Pharmacol,2015,172(12):2933-2945.
[26] Kim TY,Terentyeva R,Roder KHF,etal.SK channel enhancers attenuate Ca2+-dependent arrhythmia in hypertrophic hearts by regulating mito-ROS-dependent oxidation and activity of RyR[J].Cardiovascular Res,2017,113(3):343-353.
[27] Li B,Tian J,Sun Y,etal.Activation of NADPH oxidase mediates increased endoplasmic reticulum stress and left ventricular remodeling after myocardial infarction in rabbits[J].Biochim Biophysica Acta (BBA)-Mol Basis Dis,2015,1852(5):805-815.
[28] 罗进芳,朱瑞丽,易 浪,等.青藤碱对 LPS,IL-4 诱导的小鼠 RAW264.7 巨噬细胞极化的影响[J].中国免疫学杂志,2015,31(1):56-60.
Luo JF,Zhu RL,Yi L,etal.Effect of sinomenine on mouse RAW264. 7 macrophage cells line polarization induced by LPS or IL-4 [J]. Chin J Immunol,2015,31(1):56-60.
[29] Warth A,Cortis J,Soltermann A,etal.Tumour cell proliferation (Ki-67) in non-small cell lung cancer:a critical reappraisal of its prognostic role[J].British J Cancer,2014,111(6):1222-1229.
[30] 刘 芳,赵世敏,张 威,等.沙棘多糖对急性肝损伤小鼠氧化应激的抑制作用及其对 BCL-2/Bax 和 PPAR-γ 的调控[J].中国免疫学杂志,2016,32(3):358-361.
Liu F,Zhao SM,Zhang W,etal.Inhibitory effects of seabuckthorn polysaccharide on oxidative stress in mice with actue liver injury and modulatory effect on BCL-2 /Bax and PPAR-γ expression [J]. Chin J Immunol,2016,32(3):358-361.
[31] Zhou S,Wang Y,Zhu JJ.Simultaneous detection of tumor cell apoptosis regulators Bcl-2 and Bax through a dual-signal-marked electrochemical immunosensor[J].ACS Applied Materials Interfaces,2016,8(12):7674-7682.
[32] Yin Y,Guan Y,Duan J,etal.Cardioprotective effect of Danshensu against myocardial ischemia/reperfusion injury and inhibits apoptosis of H9c2 cardiomyocytes via Akt and ERK1/2 phosphorylation[J].Eur J Pharmacol,2013,699(1):219-226.
[33] Ghiasi P,Hosseinkhani S,Ansari H,etal.Comparison of BAX and Bcl-2 expression during human embryonic stem cell differentiation into cardiomyocytes and doxorubicin-induced apoptosis[J].Biomacromolecular J,2016,2(2):162-168.
[34] Liang K,Ye Y,Wang Y,etal.Formononetin mediates neuroprotection against cerebral ischemia/reperfusion in rats via downregulation of the Bax/Bcl-2 ratio and upregulation PI3K/Akt signaling pathway[J].J Neurol Sci,2014,344(1):100-104.
[35] Fan Y,Yang F,Cao X,etal.Gab1 regulates SDF-1-induced progression via inhibition of apoptosis pathway induced by PI3K/AKT/Bcl-2/BAX pathway in human chondrosarcoma[J].Tumor Biol,2016,37(1):1141-1149.
[36] Liu H,Li X,Qin F,etal.Selenium suppresses oxidative-stress-enhanced vascular smooth muscle cell calcification by inhibiting the activation of the PI3K/AKT and ERK signaling pathways and endoplasmic reticulum stress[J].JBIC J Biol Inorganic Chem,2014,19(3):375-388.
[37] Wang R,Peng L,Zhao J,etal.Gardenamide A protects RGC-5 cells from H2O2-induced oxidative stress insults by activating PI3K/Akt/eNOS signaling pathway[J].Int J Mol Sci,2015,16(9):22350-22367.
[38] Song Q,Gou WL,Zhang R.FAM3A protects HT22 cells against hydrogen peroxide-induced oxidative stress through activation of PI3K/Akt but not MEK/ERK pathway[J].Cell Physiol Biochem,2015,37(4):1431-1441.
[39] Bai M,Zhang M,Long F,etal.Circulating microRNA-194 regulates human melanoma cells via PI3K/AKT/FoxO3a and p53/p21 signaling pathway[J].Oncol Reports,2017,37(5):2702-2710.
[40] Zhao Z,Li C,Xi H,etal.Curcumin induces apoptosis in pancreatic cancer cells through the induction of forkhead box O1 and inhibition of the PI3K/Akt pathway[J].Mol Med Reports,2015,12(4):5415-5422.