戊型肝炎病毒衣壳蛋白特异性人源单克隆抗体的筛选与鉴定①
2018-05-25温桂平唐自闽王思令陈佳昕郑子峥夏宁邵
张 旭 温桂平 唐自闽 王思令 陈佳昕 应 东 刘 畅 郑子峥 夏宁邵
(厦门大学分子疫苗学与分子诊断学国家重点实验室,厦门大学国家传染病诊断试剂与疫苗工程技术研究中心,厦门大学公共卫生学院,厦门 361102)
戊型肝炎(Hepatitis E,HE)是由戊型肝炎病毒(Hepatitis E virus,HEV)所引起的病毒性肝炎。HEV是单股正链RNA病毒,基因组全长7.2 kb,包含3个开放阅读框(Open reading frame,ORF),其中ORF2编码戊型肝炎病毒唯一的衣壳蛋白,共包含660个氨基酸,该蛋白参与了病毒组装、免疫及病毒细胞相互作用[1]。ORF2包含3个结构域(Structural domain),分别为P、M、S结构域(P domain即等同于E2s domain)。E2s是宿主识别病毒所必需的结构域,同时也含有免疫优势表位[2]。类病毒颗粒p239(a.a.368-606)是本实验室对E2s(a.a.457-602)进行改造后得到的,并利用大肠杆菌表达系统表达了可在体外组装成颗粒的p239[3]。
近年来,HEV已逐渐成为全球范围内引发急性病毒性肝炎的最主要原因之一。戊型肝炎病毒感染在许多发展中国家是一个严重的公共卫生问题。20世纪以来在中国[4-6]、印度[7]等10多个国家均发生过暴发流行。同时,在发达国家报道的戊肝散发病例呈逐年增加的趋势[8,9]。孕妇与老年人是主要的高危人群。戊型肝炎病例的病死率约为0.2%~4%,孕妇感染HEV的病死率可高达10%~25%[10]。单克隆抗体治疗可能是现代医学中最主要的治疗/诊断方法之一。目前单克隆抗体药物已经被批准用于治疗多种疾病[11-14]。传统的单克隆抗体主要通过免疫小鼠B细胞同骨髓瘤细胞系融合的杂交瘤技术来获得,但将鼠源单抗用于临床治疗有诸多弊端,如人体对鼠源单抗作为外源蛋白的有害免疫效应发病率较高,同时人体免疫对于鼠源抗体缺乏足够的效能。通过将抗原结合所必需的小鼠氨基酸移植到人抗体框架上,再应用体外或体内抗体生产技术可以得到人源化抗体[15,16],但由于小鼠本身的遗传背景限制,导致所得单抗对抗原加工及B细胞免疫调节仍存差异,这种方法仍保留一定的异源性。而全人源抗体有特异性高、亲和力强、临床效果好、不良反应少等优势,成为近年来抗体研究的热点。目前,还没有识别戊型肝炎病毒衣壳蛋白的全人源抗体研究的相关报道。
本研究从接种戊肝疫苗志愿者的外周血中分选得到识别戊型肝炎病毒类病毒颗粒p239的特异性记忆B细胞[17],获得6株识别戊型肝炎病毒衣壳蛋白的单克隆抗体,并对获得的抗体性质进行了初步的鉴定。为之后快速生产全人源抗体以及研究疫苗免疫后体内抗体演化提供了技术支持。
1 材料与方法
1.1材料
1.1.1实验材料 获得一例全程接种戊肝疫苗的35岁健康男性接种者的外周血,以及一名未接种疫苗的且为HEV阴性的25岁男性健康志愿者的外周血,存储于抗凝管中待用。
1.1.2主要试剂及耗材 戊肝疫苗Hecolin®为北京万泰公司产品,主要成分为p239类病毒颗粒。常用质粒pTT5购自Invitrogen公司。常用菌株DH5α、Top10均为本实验室保存。细胞株HEK293T、293Expi购自ATCC。PCR扩增及分子克隆试剂购自Promega公司。细胞培养及转染试剂购自Invitrogen公司。质粒及样品核酸提取试剂购自QIAGEN公司。抗原、抗体、酶标记抗体及显色底物主要购自Sigma公司及北京万泰。Anti-Human IgG(Fab specific)、羊抗人IgG购自PIERCE公司,4#抗体-HRP购自北京万泰。CD20-FITC、CD27-PE、IgG-BV421等荧光抗体购自BD公司。其他常规试剂如抗体纯化介质购自GE公司,DNA、Protein Marker购自Thermo公司,各种常规化学试剂为国产分析纯。
1.1.3巢式PCR引物 本研究所涉及的引物均由Invitrogen公司合成。具体引物设计方案参照已报道的方法[18]。
1.2方法
1.2.1单细胞分选 从选出的接种志愿者和非接种志愿者体内分别抽取10 ml的外周血,采用常规Ficoll-Paque密度梯度离心,获得外周血单核细胞(PBMC)。采用CD20+、CD27+、IgG+和抗原这四个指标对抗原特异的记忆B细胞进行特异性标记并分选,用96孔U底细胞板进行细胞收集。
1.2.2反转录PCR 使用Random Hexamers进行逆转录操作。按照每孔1 μl Random Hexamers(50 ng/μl)和1 μl dNTPs(10 mmol/L)进行溶液配置。每孔加入2 μl上述溶液,65℃ 5 min,然后迅速将PCR板置于冰上5 min;配置cDNA合成Mixture:每孔加入2 μl 10×RT buffer,4 μl 25 mmol/L MgCl2,2 μl 0.1 mol/L DTT,1 μl RNase OUT,1 μl SuperScripeⅢRT,25℃ 10 min;50℃ 60 min;85℃ 5 min。逆转录结束后,将PCR板保存于-80℃冰箱。采用的反应体系为Temp(cDNA)2 μl,FP (10 μm) 1 μl,RP (10 μm) 1 μl,2×HiFi PCR MixⅡ 20 μl,DEPC H2O 16 μl。反应条件为94℃ 5 min,(94℃ 30 s,55℃ 30 s,72℃ 1 min)30 cycles,72℃ 7 min。
1.2.3Nested-PCR 第一轮 PCR:以 2 μl cDNA 为模版,实验过程冰上操作且整个过程需要满足DNase & RNAase free 条件,反应体系为Temp(cDNA) 2 μl,FP (10 μm) 2 μl,RP(10 μm)2 μl,2×HiFi PCR MixⅡ 12.5 μl,DEPC H2O 6.5 μl,反应条件为:94℃ 5 min,(94℃ 30 s,55℃30 s,72℃ 1 min)50 cycles,72℃ 10 min;第二轮 PCR:以 4 μl第一轮PCR 产物为模板,再次进行 PCR,反应体系为DNA 5 μl,FP (10 μm) 2 μl,RP(10 μm)2 μl,2×HiFi PCR MixⅡ 25 μl,DEPC H2O 16 μl,反应条件为:94℃ 5 min,(94℃ 30 s,57℃30 s,72℃45 s)50 cycles,72℃10 min;第二轮PCR 产物取5 μl进行 1.5%琼脂糖核酸电泳,判断 PCR 是否成功;若条带大小正确,则电泳割胶回收。
1.2.4PCR产物纯化和克隆鉴定 取2 μl扩增产物经2%琼脂糖凝胶电泳检测,目的片段约500 bp。将余下产物用PCR产物回收试剂盒纯化,克隆至pTT5载体,转化DH5α感受态细胞,涂板,每个平板挑选5个菌斑进行菌液PCR验证,将阳性重组质粒摇菌,送上海生工测序。
1.2.5抗体基因序列分析 将测序结果用MEGA7读取,并将测序结果正确的序列在IMGT数据库中进行重链以及轻链的家系分析。
1.2.6抗体的表达及纯化 表达所用的载体为pTT5,采用AgeⅠ及SalⅠ对重链载体进行酶切,采用AgeⅠ及BsiWⅠ对轻链载体进行酶切,采用Gibson装配的方式将抗体基因构建到表达载体上。将克隆至pTT5载体的阳性重组质粒采用脂质体法瞬时转染 HEK293T 细胞,进行识别戊型肝炎病毒衣壳蛋白的人源抗体的小量表达。应用商品化HEV-IgG检测试剂盒(北京万泰)以及自制的包被Anti-Human IgG的酶标板,按照说明书对小量表达上清进行验证。将小量表达验证阳性的质粒采用PEI法转染293Expi细胞,进行识别戊型肝炎病毒衣壳蛋白的人源抗体的大量表达。收集细胞上清,5 000 g 离心10 min,回收上清;用0.22 μm滤器过滤上清;使用AKTA仪器以及Protein A柱子对细胞上清进行纯化,纯化得到穿透峰和洗脱峰样品经过沸水煮5 min后进行SDS-PAGE鉴定。纯化的单克隆抗体用20 mmol/L PBS(pH7.0)缓冲液透析过夜,并分装至1.5 ml管中,存放于-20℃备用。
1.2.7抗体结合活性测定 利用ELISA检测抗体与类病毒颗粒p239的结合活性,通过包被p239,制成抗原板,随后进行酶联免疫吸附实验。在抗原板中加入得到的抗体0.02 μg/μl,37℃孵育30 min,加入羊抗人IgG 10 μg/孔,37℃孵育30 min,加入显色底物,37℃显色15 min;终止并读取吸光度参数。根据读值,计算其抗体与抗原的结合活性。
1.2.8抗体中和活性测定 通过p239类病毒颗粒HepG2细胞吸附模型对抗体的中和能力进行评价。在96孔细胞板接种5×104细胞/孔,12 h后贴壁用于检测;抗体应用PBS进行两倍梯度稀释;将PBS缓冲液稀释的抗体和类病毒颗粒在37℃下孵育30 min,将混合液加入到HepG2细胞板中,37℃孵育 30 min,用PBS清洗细胞3次;加入0.5%戊二醛,室温,10 min,固定细胞,用PBS清洗细胞3次;加入4#抗体-HRP 10 μg/孔,37℃孵育30 min,用PBS清洗细胞3次;加入显色底物,37℃显色15 min;终止并读取吸光度参数。
2 结果
2.1HEV特异性记忆B细胞分选 在本研究中,我们选择记忆B细胞作为获得抗原特异性单克隆抗体基因的来源。结果如图1所示,在接种了疫苗的志愿者的外周血中CD20+、CD27+、IgG+及Ag+的比例为0.32%。从10 ml外周血中共分选得到43个单细胞,用于后续的单细胞PCR。
2.2单细胞PCR抗体基因分析 对得到的43个B细胞进行单细胞PCR调取抗体轻重链基因。通过琼脂糖凝胶电泳鉴定,共得到6株抗体轻重链基因配对。
以单细胞PCR的第二轮反向引物作为测序引物对成功调取的6株抗体的轻重链基因进行测序,并通过IMGT网站进行序列比对分析。调取的抗体轻重链V区与人源抗体原始家系同源性均达到90%以上,说明调取的均为人源抗体的基因序列,未受到其他物种抗体基因序列的污染。抗体重链来源家系广泛,包括了IGHV1-69、4-61、4-59、3-30家系,具体信息如表1。
2.3克隆及抗体的表达 采用通用引物将载体酶切位点两端的序列构建到抗体轻重链两端。之后采用Gibson装配方法将抗体轻重链可变区序列构建到含有轻重链恒定区的pTT5表达载体上。挑取克隆后,通过菌液PCR鉴定,测序结果与原始序列比对,最终成功构建6株抗体的表达克隆。将获得质粒采用293T细胞系瞬时转染抗体轻重链,3 d后收集细胞上清,应用酶联免疫吸附法检测总IgG与HEV特异IgG。结果显示,6株抗体均可以正常表达,且均为HEV特异性抗体。为了获得足够的抗体量完成抗体结合活性、中和活性分析,应用悬浮细胞293Expi对于小量表达为阳性的6株抗体进行大量表达。通过Protein A介质对抗体进行纯化。对纯化浓缩后的抗体进行SDS-PAGE鉴定,结果如图2所示:显示各抗体的轻重链均可很好表达,重链分子量大小为50 kD左右,轻链分子量大小为25 kD左右。
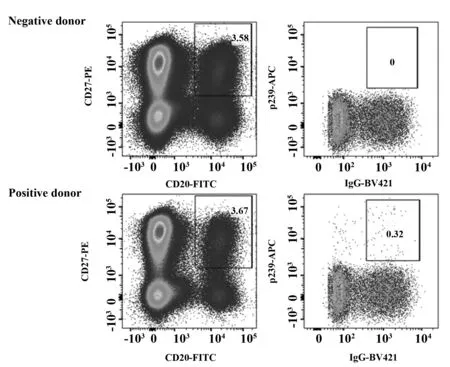
图1 HEV特异记忆B细胞群分析Fig.1 Analysis of HEV-specific memory B cells
表1不同抗体的轻重链VDJ基因家系分析
Tab.1AnalysisofVDJgenefamilyoflightandheavychainswithdifferentantibodies,whichwasaccessiblefromIMGT
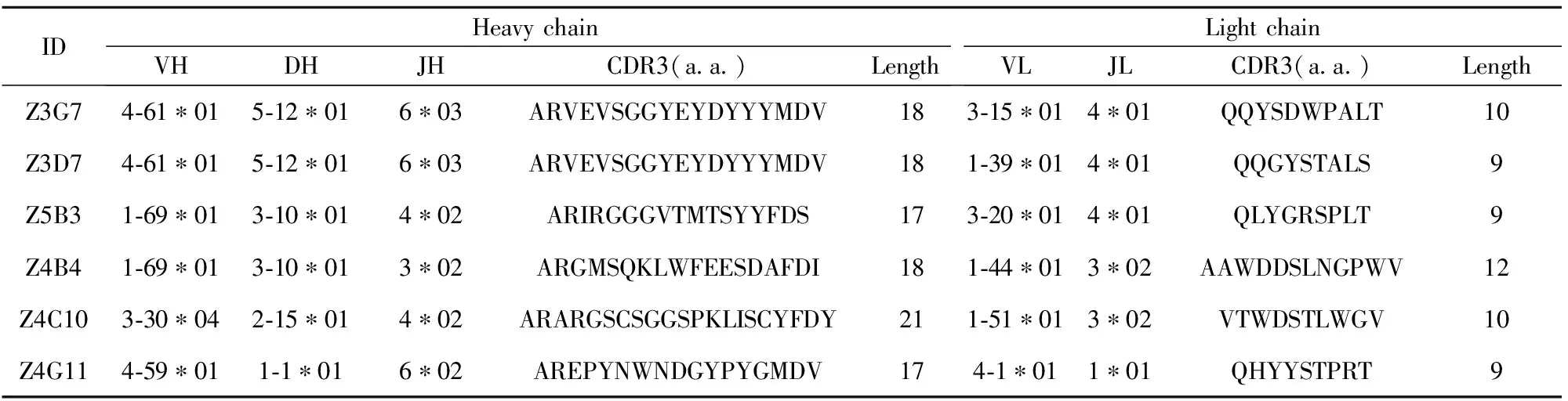
IDHeavychainVHDHJHCDR3(aa)LengthLightchainVLJLCDR3(aa)LengthZ3G74⁃61∗015⁃12∗016∗03ARVEVSGGYEYDYYYMDV183⁃15∗014∗01QQYSDWPALT10Z3D74⁃61∗015⁃12∗016∗03ARVEVSGGYEYDYYYMDV181⁃39∗014∗01QQGYSTALS9Z5B31⁃69∗013⁃10∗014∗02ARIRGGGVTMTSYYFDS173⁃20∗014∗01QLYGRSPLT9Z4B41⁃69∗013⁃10∗013∗02ARGMSQKLWFEESDAFDI181⁃44∗013∗02AAWDDSLNGPWV12Z4C103⁃30∗042⁃15∗014∗02ARARGSCSGGSPKLISCYFDY211⁃51∗013∗02VTWDSTLWGV10Z4G114⁃59∗011⁃1∗016∗02AREPYNWNDGYPYGMDV174⁃1∗011∗01QHYYSTPRT9
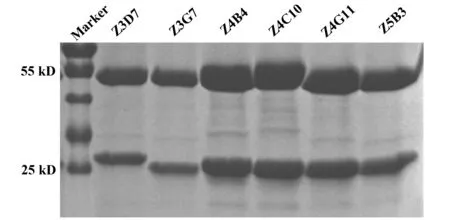
图2 SDS-PAGE凝胶电泳分析抗体轻重链表达Fig.2 Antibodies were characterized using SDS-PAGE
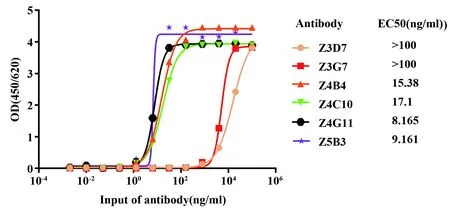
图3 基于p239类病毒颗粒对抗体反应性进行检测Fig.3 Reactivity test of HEV-specific antibodies
2.4抗体结合活性检测 采用间接ELISA方法对抗体与p239类病毒颗粒结合活性进行了检测,对EC50进行统计分析,结果如图3所示:Z4G11结合活性明显优于其他抗体,EC50为8.165 ng/ml。Z3D7、Z3G7反应性较差,EC50均大于100 ng/ml。
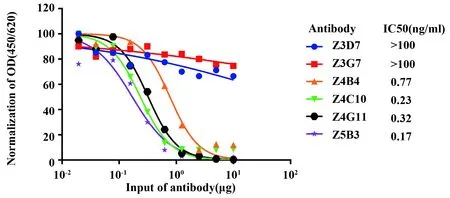
图4 基于p239类病毒颗粒对抗体中和活性进行检测Fig.4 Neutralization test of HEV-specific antibodies
2.5抗体中和活性检测 通过检测不同抗体加入量下p239类病毒颗粒吸附HepG2细胞量的变化,对抗体中和能力进行评价。图4表明除Z3D7、Z3G7外,随着抗体加入量的增加p239吸附细胞的量逐渐降低。其中Z3D7和Z3G7无中和能力,其他抗体均具有中和能力,Z5B3具有最强的中和能力。
3 讨论
本研究主要通过应用抗原特异IgG+记忆B细胞流式筛选平台,对HEV疫苗接种者PBMC中的HEV特异IgG+记忆B 细胞进行分选。通过单细胞PCR共得到6对轻重链配对抗体基因,应用293T细胞进行瞬时转染表达,经鉴定该6株单克隆抗体为识别戊型肝炎病毒衣壳蛋白的人源抗体。综合以上结果表明人源抗体筛选平台建立成功并初步应用到识别HEV衣壳蛋白的特异人源抗体的筛选当中。得到6株识别戊型肝炎病毒衣壳蛋白的人源单克隆抗体,中和能力较强的Z5B3以及Z4B4抗体重链VH区来源于1-69家系,无中和能力的Z3G7以及Z3D7来源于4-61家系。重链CDR3区氨基酸数目多为17-18,其中Z4C10可达21,与其他研究中的人源抗体CDR3区氨基酸数目相类似[19]。得到6株抗体中,结合能力强的都具有较强的中和能力。
本次研究制备的人源单克隆抗体具有很好的科研价值和应用前景,可用于识别表位分析,通过获得更多的人源抗体,可确定HEV的免疫优势表位,以弥补利用鼠源单克隆抗体寻找表位的缺陷,从而更深入准确地了解疫苗的免疫进程及抗体在人体内的演化情况。同时这些抗体不仅能够很好地满足科研需求,也可作为诊断试剂和临床药物研发的重要原料,随着科研水平的提高与制备工艺的完善,治疗性单克隆抗体药物逐渐发挥着越来越重要的作用。在过去二十多年中,已有超过30种IgG抗体及其衍生物获批应用于临床,多种人源化和人源抗体也进一步丰富了治疗靶点。同样也可将其应用于反向指导疫苗结构的合理设计中。人源抗体在临床上也有多方面的应用,如感染性疾病和肿瘤的治疗、体内定位诊断、免疫调节等。随着肿瘤免疫治疗研究的逐渐深入,人源单克隆抗体应用范围不断拓展,市场需求也不断增加。而通过建立基于流式细胞分选和单细胞PCR技术的人源抗体筛选平台,能够高效地获得抗原特异性的人源抗体。因此,基于流式细胞分选及单细胞PCR技术的人源抗体筛选方法具有相当广阔的发展前景和开发价值。
参考文献:
[1] Tam AW,Smith MM,Guerra ME,etal.Hepatitis E virus (HEV):molecular cloning and sequencing of the full-length viral genome[J].Virology,1991,185(1):120-131.
[2] Tang X,Yang C,Gu Y,etal.Structural basis for the neutralization and genotype specificity of hepatitis E virus[J].Proc Natl Acad Sci U S A,2011,108(25):10266-10271.
[3] Li S W,Zhang J,Li YM,etal.A bacterially expressed particulate hepatitis E vaccine:antigenicity,immunogenicity and protectivity on primates[J].Vaccine,2005,23(22):2893-2901.
[4] Zhuang H,Cao XY,Liu CB,etal.Epidemiology of hepatitis E in China[J].Gastroenterol Jpn,1991,26 Suppl 3:135-138.
[5] Bi SL,Purdy MA,Mccaustland KA,etal.The sequence of hepatitis E virus isolated directly from a single source during an outbreak in China[J].Virus Res,1993,28(3):233-247.
[6] 庄 辉,毕胜利,王佑春,等.我国戊型肝炎研究[J].北京大学学报(医学版),2002,34(5):434-439.
Zhuang H,Bi SL,Wang YC,etal.Studies on hepatitis E in China[J].Peking Univ(Health Sci),2002,34(5):434-439.
[7] Naik SR,Aggarwal R,Salunke PN,etal.A large waterborne viral hepatitis E epidemic in Kanpur,India[J].Bull World Health Organ,1992,70(5):597-604.
[8] Kamar N,Bendall R,Legrand-Abravanel F,etal.Hepatitis E[J].Lancet,2012,379(9835):2477-2488.
[9] Ahmed A,Ali IA,Ghazal H,etal.Mystery of hepatitis e virus:recent advances in its diagnosis and management[J].Int J Hepatol,2015,2015:8724-8731.
[10] Jaiswal SPB,Jain AK,Naik G,etal.Viral hepatitis during pregnancy[J].International Journal of Gynecology & Obstetrics,2001,72(2):103-108.
[11] Desai NR,Giugliano RP,Zhou J,etal.AMG 145,a monoclonal antibody against PCSK9,facilitates achievement of national cholesterol education program-adult treatment panel III low-density lipoprotein cholesterol goals among high-risk patients:an analysis from the LAPLACE-TIMI 57 trial (LDL-C assessment with PCSK9 monoclonal antibody inhibition combined with statin thErapy-thrombolysis in myocardial infarction 57)[J].J Am Coll Cardiol,2014,63(5):430-433.
[12] Mizutani N,Nabe T,Yoshino S.IgE/antigen-mediated enhance-ment of IgE production is a mechanism underlying the exacerba-tion of airway inflammation and remodelling in mice[J].Immunology,2015,144(1):107-115.
[13] Gallagher-Colombo SM,Miller J,Cengel KA,etal.Erlotinib Pretreatment Improves Photodynamic Therapy of Non-Small Cell Lung Carcinoma Xenografts via Multiple Mechanisms[J].Cancer Res,2015,75(15):3118-3126.
[14] Savic S,Diebold J,Zimmermann AK,etal.Screening for ALK in non-small cell lung carcinomas:5A4 and D5F3 antibodies perform equally well,but combined use with FISH is recommended[J].Lung Cancer,2015,89(2):104-109.
[15] Jones PT,Dear PH,Foote J,etal.Replacing the complementarity-deter mining regions in a human antibody with those from a mouse[J].Nature,1986,321(6069):522-525.
[16] Riechmann L,Clark M,Waldmann H,etal.Reshaping human antibodies for therapy[J].Nature,1988,332(6162):323-327.
[17] 吕 进,宋秀军,宿 娟,等.记忆B细胞免疫应答机制研究进展[J].中国免疫学杂志,2015,31(2):267-273.
Lv J,Song XJ,Su J,etal.Advances in research of meomory B cell immune response mechanism[J].Chin J Immunol,2015,31(2):267-273.
[18] Tiller T,Meffre E,Yurasov S,etal.Efficient generation of monoclonal antibodies from single human B cells by single cell RT-PCR and expression vector cloning[J].J Immunol Methods,2008,329(1-2):112-124.
[19] Zemlin M,Klinger M,Link J,etal.Expressed murine and human CDR-H3 intervals of equal length exhibit distinct repertoires that differ in their a mino acid composition and predicted range of structures[J].J Mol Biol,2003,334(4):733-749.