PKM2影响鼻咽癌细胞增殖凋亡及机制研究
2018-05-25丁元平郝妮妮赵立民
丁元平 孙 丽 郝妮妮 远 洋 赵立民
(潍坊医学院附属医院耳鼻咽喉科,潍坊 261031)
鼻咽癌多发生于我国南方,是一种从鼻黏膜起源的恶性肿瘤,目前手术治疗、放化疗及综合治疗是其主要治疗方法,但由于鼻咽癌发展速度快,恶性程度高,中晚期患者经过治疗后5年内的生存率低于70%[1,2]。近年来随着研究的不断深入,基因靶向治疗已经成为研究的重点,其具有靶向性高,副作用小等优点,寻找有效的靶基因对于提高鼻咽癌患者的生存率具有重要意义[3]。丙酮酸激酶M2亚型(Pyruvate kinase M2 isoform,PKM2)是糖酵解途径中的关键限速酶,而肿瘤细胞以糖酵解为主要功能方式[4]。研究表明,PKM2在多种肿瘤中表达下调,能够促进肿瘤细胞糖酵解,加快肿瘤的发生和发展[5]。本研究为了明确PKM2在鼻咽癌细胞生长和凋亡中的作用,通过细胞转染的方法下调CNE-1细胞中PKM2水平,以期为探讨鼻咽癌的发病机制和寻找有效的靶基因治疗鼻咽癌提供理论依据。
1 材料与方法
1.1材料 鼻咽癌细胞CNE-1购自上海生命科学研究院细胞库。细胞蛋白提取试剂盒购自碧云天生物技术研究所;RNA提取试剂盒购自美国Thermo;荧光定量PCR试剂盒购自大连TaKaRa;活性氧(Reactive oxygen species,ROS)水平检测试剂盒购自美国Sigma;PKM2小干扰RNA(PKM2 siRNA1和PKM2 siRNA2)和阴性对照(siRNA control)均购自上海吉玛公司;甘油醛-3-磷酸脱氢酶(Glyceral-dehyde-3-phosphate dehydrogenase,GAPDH)和PKM2引物由上海生工合成;p38MAPK一抗、磷酸化的p38MAPK(p-p38MAPK)一抗、C-myc一抗购自美国Abcam;活化的含半胱氨酸的天冬氨酸蛋白水解酶3(Cleaved cysteinyl aspartate specific proteinase 3,Cleaved Caspase-3)一抗、β-连环蛋白(β-catenin)一抗购自美国CTS。
1.2方法
1.2.1细胞分组 CNE-1细胞培养用含有10%胎牛血清的RPMI1640培养液培养,培养条件为37℃、5%CO2培养箱。培养至对数期的CNE-1细胞分别转染PKM2 siRNA1和PKM2 siRNA2,命名为PKM2 Si1、PKM2 Si2,同时以转染siRNA control的CNE-1细胞为Si-NC,以不做转染的Si-NC细胞为Con,转染步骤参照Lipofectamine2000。
1.2.2转染后细胞中PKM2 mRNA水平检测 Con、Si-NC、PKM2 Si1、PKM2 Si2细胞分别培养48 h后,提取细胞中的RNA,取1 μg的RNA用反转录合成试剂盒合成cDNA,荧光定量PCR分析PKM2水平,以GAPDH为内参。反应条件为:95℃,10 min,95℃ 15 s;60℃ 1 min;共40个循环,72℃延伸10 min。GAPDH上游引物为5′-CGGAGTCAACGGA-TTTGGTCGTAT-3′,下游引物5′-AGCCTTCTCCATGGTGGTGAAGAC-3′。PKM2上游引物为5′-ATTATTTGAGGAACTCCGCCGCCT-3′,下游引物5′-GTTGAAGGTAGTTTCGTGGA-3′。实验重复3次,取均值。
1.2.3转染后细胞中PKM2 蛋白水平检测 Con、Si-NC、PKM2 Si1、PKM2 Si2细胞分别培养48 h后,提取细胞总蛋白,二喹啉甲酸(Bicinchoninic acid,BCA)法对蛋白进行定量检测。用10%分离胶和5%的浓缩胶进行电泳,每孔加入50 μg的蛋白样品,用80 V电压电泳30 min后,100 V电压电泳2 h。90 V电压转膜80 min,用5%牛血清白蛋白封闭60 min后,放在1 000倍稀释的一抗中,4℃过夜反应。加入3 000倍稀释的二抗在室温孵育2 h,ECL发光,拍照,以GAPDH为内参,分析目的蛋白表达水平。实验重复3次,取均值。
1.2.4细胞增殖活性检测 Con、Si-NC、PKM2 Si2细胞接种到96孔细胞培养板中,每孔中加入200 μl(约为1 000个细胞),每组设置5个复孔,培养48 h。每孔中加入20 μl的MTT溶液,放在37℃孵育4 h,将上清液吸除后,加入150 μl的二甲基亚砜溶液,在室温条件下孵育10 min,酶标仪检测490 nm每孔的光密度值(Optical density,OD值)。实验重复3次,取均值。
1.2.5细胞克隆形成能力检测 Con、Si-NC、PKM2 Si2细胞培养至对数期以后,用0.25%的胰蛋白酶消化传代后,用磷酸盐缓冲液(Phosphate Buffered Saline,PBS)洗涤细胞2次,按照每孔中加入200个细胞种植到6孔细胞培养板中,轻轻晃动,37℃培养14 d,观察出现肉眼可见的细胞克隆后,将培养液吸除以后,干燥,用甲醇固定,滴加结晶紫染色,将染液冲洗掉以后,在显微镜下观察细胞个数大于50的克隆数目,计算细胞克隆形成率。克隆形成率=(克隆数目÷接种细胞数目)×100%。实验重复3次,取均值。
1.2.6细胞凋亡检测 Con、Si-NC、PKM2 Si2细胞培养48 h后,用胰蛋白酶消化传代,用冰预冷的PBS洗涤细胞3次后,在细胞中加入200 μl的结合缓冲液,加入膜联蛋白 V-FITC(Annexin V-FITC)和5 μl碘化丙啶(Propidium iodide,PI)各5 μl,避光反应10 min,加入150 μl的缓冲液,流式细胞仪检测细胞凋亡水平。实验重复3次,取均值。
1.2.7ROS水平检测 Con、Si-NC、PKM2 Si2细胞培养48 h后,用胰蛋白酶消化传代,用ROS水平检测试剂盒(DCFH-DA法)检测细胞内的ROS水平,以Con为对照统计各组细胞ROS水平,实验重复3次,取均值。
1.2.8p38MAPK、p-p38MAPK、C-myc、β-catenin、Cleaved Caspase-3水平检测 Con、Si-NC、PKM2 Si2细胞培养48 h后,用胰蛋白酶消化传代,Western blot法检测p38MAPK、p-p38MAPK、C-myc、β-catenin、Cleaved Caspase-3水平,p38MAPK、p-p38MAPK、C-myc、β-catenin、Cleaved Caspase-3一抗分别稀释1 000、500、800、800、1 000倍,步骤参照1.2.3。
2 结果
2.1转染后细胞中PKM2表达水平 Con、Si-NC、PKM2 Si1、PKM2 Si2细胞中PKM2 mRNA和PKM2蛋白表达水平见图1和表1。Si-NC细胞中PKM2 mRNA和蛋白水平与Con相比,差异没有统计学意义(P>0.05)。PKM2 Si1、PKM2 Si2细胞中PKM2 mRNA和蛋白水平与Con相比明显降低,差异具有统计学意义(t1=8.195,t2=11.945,t3=7.517,t4=11.275,P<0.05)。PKM2 Si2细胞中PKM2 mRNA和蛋白水平与PKM2 Si1相比明显降低,差异具有统计学意义(t1=3.750,t2=3.759,P<0.05)。PKM2 siRNA1、PKM2 siRNA2能够明显抑制鼻咽癌细胞中PKM2表达,并且PKM2 siRNA2抑制效果更好,后续选用PKM2 Si2细胞继续研究。
2.2细胞增殖活性和克隆形成能力检测结果 Con、 Si-NC、 PKM2 Si2细胞OD值和克隆形成率见表2。Si-NC细胞OD值和克隆形成率与Con相比,差异无统计学意义(P>0.05)。PKM2 Si2细胞OD值和克隆形成率与Con相比明显降低,差异具有统计学意义(t1=5.484,t2=4.924,P<0.05)。下调PKM2表达可以抑制鼻咽癌细胞的增殖活性和克隆形成能力,抑制鼻咽癌细胞生长。

图1 Western blot检测转染后细胞中PKM2表达水平Fig.1 Western blot detection of PKM2 expression in transfected cells
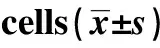

GroupsPKM2mRNAPKM2proteinCon100±009108±012Si⁃NC102±014106±013PKM2Si1041±0051)052±0041)PKM2Si2014±0031)2)024±0021)2)F7419661922P00000000
Note:Compared with Con,1)P<0.05;compared with PKM2 Si1,2)P<0.05.
2.3细胞凋亡检测结果 Con、Si-NC、PKM2 Si2细胞凋亡率见图2和表3。Si-NC细胞凋亡率与Con相比,差异无统计学意义(P>0.05)。PKM2 Si2细胞凋亡率与Con相比明显升高,差异具有统计学意义(t=15.172,P<0.05)。下调PKM2表达可以促进鼻咽癌细胞凋亡。
2.4ROS水平检测结果 Con、Si-NC、PKM2 Si2细胞ROS水平见表4。Si-NC细胞ROS水平与Con相比,差异无统计学意义(P>0.05)。PKM2 Si2细胞ROS水平与Con相比明显升高,差异具有统计学意义(t=9.896,P<0.05)。下调PKM2表达可以提高鼻咽癌细胞中ROS水平。
2.5p38MAPK、p-p38MAPK、C-myc、β-catenin、Cleaved Caspase-3水平检测结果 表5显示Si-NC细胞p-p38MAPK、C-myc、β-catenin、Cleaved Caspase-3蛋白水平与Con相比,差异无统计学意义(P>0.05)。PKM2 Si2细胞p-p38MAPK、Cleaved Caspase-3水平与Con相比明显升高,差异具有统计学意义(t1=12.975,t2=24.546,P<0.05)。 PKM2Si2细胞C-myc、β-catenin水平与Con相比明显降低,差异具有统计学意义(t1=12.329,t2=11.243,P<0.05)。下调PKM2表达可以提高鼻咽癌细胞中p-p38MAPK、Cleaved Caspase-3水平,降低细胞中C-myc、β-catenin水平,见图3。
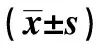
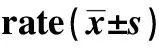

GroupsODCellcloneformationrate(%)Con086±0117548±825Si⁃NC089±0067395±893PKM2Si2052±0041)4615±3471)F2197115347P00020004
Note:Compared with Con,1)P<0.05.
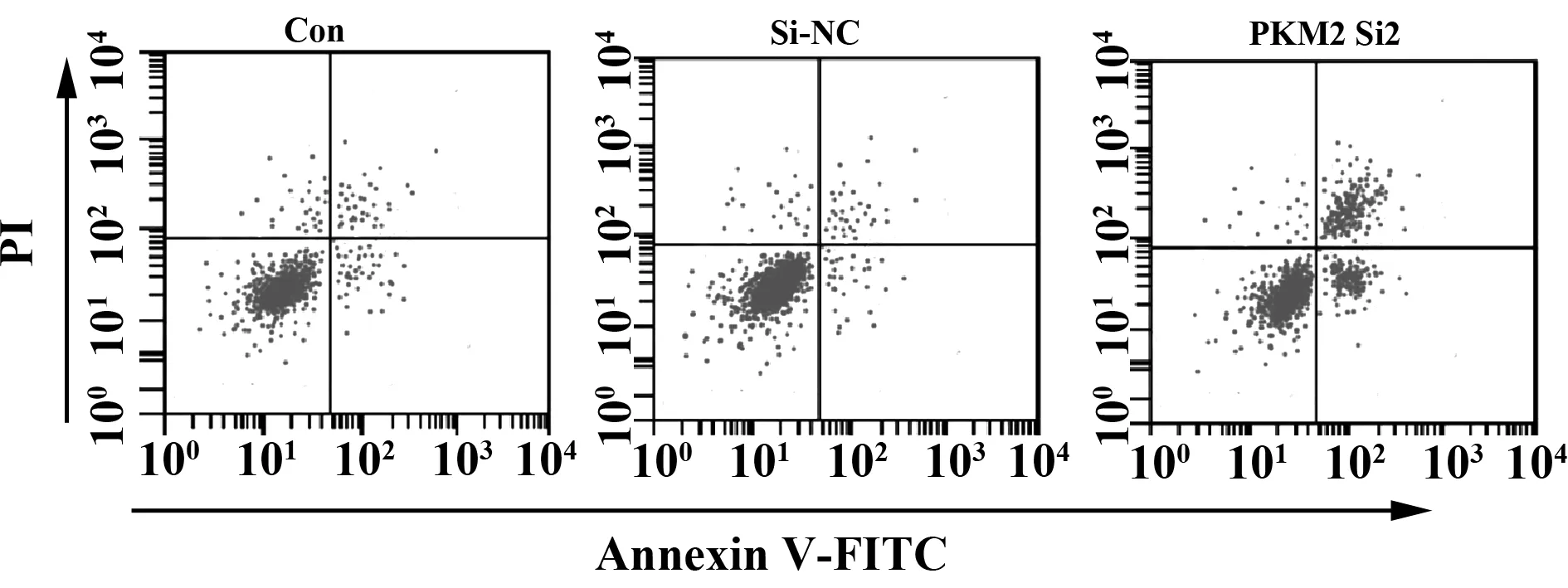
图2 流式细胞术检测细胞凋亡情况Fig.2 Flow cytometry to detect cell apoptosis
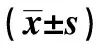
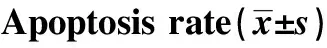

GroupsApoptosisrate(%)Con936±104Si⁃NC1005±093PKM2Si24842±5281)F150801P0000
Note:Compared with Con,1)P<0.05.
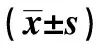


GroupsROSlevelCon100±008Si⁃NC098±007PKM2Si2182±0141)F66913P0000
Note:Compared with Con,1)P<0.05
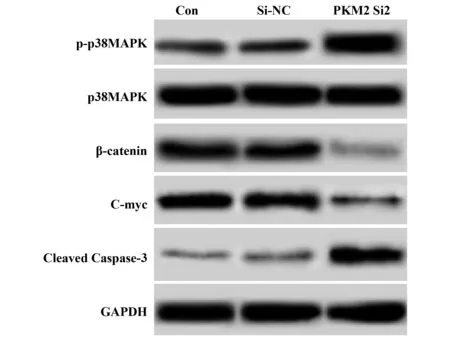
图3 Western blot检测p38MAPK、p-p38MAPK、C-myc、β-catenin、Cleaved Caspase-3蛋白水平Fig.3 p38MAPK,p-p38MAPK,C-myc,β-catenin,Cleav-ed Caspase-3 levels detected by Western blot
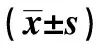
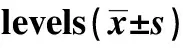
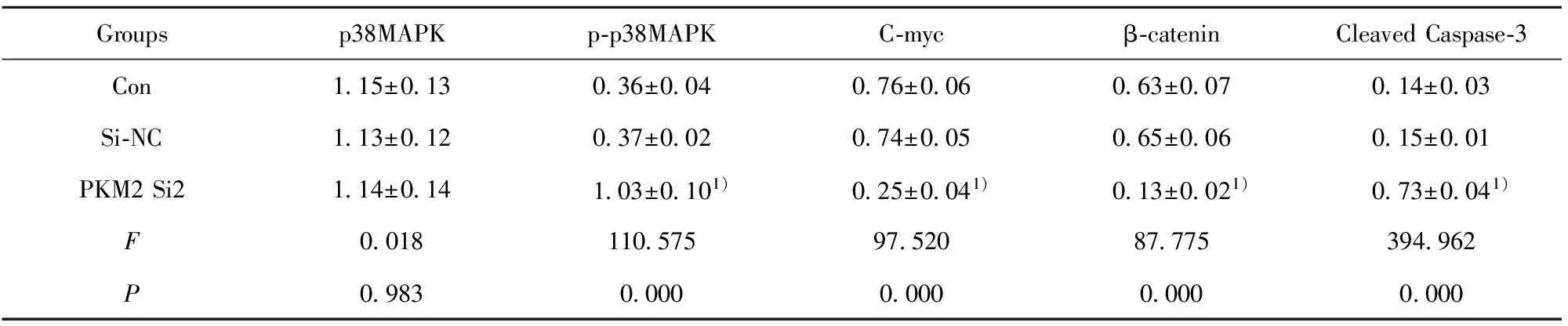
Groupsp38MAPKp⁃p38MAPKC⁃mycβ⁃cateninCleavedCaspase⁃3Con115±013036±004076±006063±007014±003Si⁃NC113±012037±002074±005065±006015±001PKM2Si2114±014103±0101)025±0041)013±0021)073±0041)F00181105759752087775394962P09830000000000000000
Note:Compared with Con,1)P<0.05.
3 讨论
肿瘤细胞以有氧糖酵解为主要供能方式,有氧糖酵解速率较快,能够在短时间内使肿瘤细胞获得大量的能量,为肿瘤的生长提供条件,而PKM2作为糖酵解中的关键酶参与肿瘤的发生和发展[6,7]。研究表明,PKM2除了能够促进肿瘤细胞糖酵解外,还可以通过调控细胞代谢过程中的产物和相关细胞因子影响肿瘤细胞的生长[8]。研究显示,PKM2在膀胱尿路上皮癌中表达上调,不仅可以影响膀胱癌细胞能量代谢途径,还能够影响癌细胞的生长[9]。本研究细胞转染了PKM2 siRNA,并通过PCR和Western blot筛选了干扰水平更为明显的PKM2 siRNA2继续研究,通过MTT和细胞克隆实验发现,下调PKM2表达后的鼻咽癌细胞增殖活性和克隆形成能力下降,说明PKM2下调可以抑制鼻咽癌细胞生长,这与之前的研究结果一致,均说明下调PKM2能够抑制癌细胞生长。
细胞凋亡与细胞内的多种基因调控有关,是细胞维持内环境稳定的一个重要方式,细胞凋亡的发生与细胞内多种因子的调控有关,目前对于细胞凋亡的具体作用机制尚不清楚[9,10]。Caspase级联反应可以促进细胞凋亡的发生,是目前研究较多与细胞凋亡有关的蛋白家族,其含有多个成员,根据其在细胞凋亡中的作用可以分为凋亡启动子、执行因子等,Caspase-3是凋亡执行因子,正常情况下以酶原的形式存在,当其活化后形成Cleaved Caspase-3后标志着细胞凋亡进入不可逆的阶段[11,12]。本研究结果显示,下调PKM2表达后的鼻咽癌细胞凋亡增加,细胞中Cleaved Caspase-3水平升高,说明PKM2下调能够促进鼻咽癌细胞凋亡。
细胞生物学特性的维持与细胞内复杂的信号转导通路和细胞氧化平衡状态有关,正常情况下,细胞内存在一定浓度的ROS,这些ROS不仅与细胞氧化平衡稳定有关,还参与细胞内正常的信号传导,细胞中ROS水平升高后导致细胞中氧化平衡状态被打破,引起氧化损伤,促进细胞凋亡发生[13-15]。p38MAPK、Wnt/β-catenin是广泛存在于细胞中的信号通路,与细胞的生长凋亡等有关,p38MAPK在肿瘤组织中磷酸化水平降低,而Wnt/β-catenin信号通路异常激活,C-myc、β-catenin是Wnt/β-catenin信号通路的关键组成部分[16,17]。研究表明,PKM2能够通过作用于肿瘤细胞糖酵解途径影响肿瘤细胞中氧化平衡状态,并且对于细胞内p38MAPK、Wnt/β-catenin信号通路也具有调控作用[18-21]。本研究结果显示,下调PKM2后的鼻咽癌细胞中ROS水平升高,细胞中p38MAPK磷酸化水平也升高,而细胞中C-myc、β-catenin水平降低,说明下调PKM2促进p38MAPK信号通路激活,抑制Wnt/β-catenin信号通路。
综上所述,下调PKM2抑制鼻咽癌细胞生长,促进鼻咽癌细胞凋亡,影响鼻咽癌细胞中ROS水平,其作用机制可能与p38MAPK信号通路激活和Wnt/β-catenin信号通路被抑制有关,而对于其具体的作用机制仍然需要在后续实验中通过p38MAPK或者Wnt/β-catenin信号通路进行验证。本研究为探讨鼻咽癌的发病机制奠定了基础,为靶向PKM2治疗鼻咽癌提供了理论基础,本研究没有在多种鼻咽癌细胞中进行验证,同时也没有在体内进行验证,在后续实验中会对上述部分进行深入探讨。
参考文献:
[1] Blanchard P,Lee A,Marguet S,etal.Chemotherapy and radiotherapy in nasopharyngeal carcinoma:an update of the MAC-NPC meta-analysis[J].Lancet Oncol,2015,16(6):645-655.
[2] Sun X,Su S,Chen C,etal.Long-term outcomes of intensity-modulated radiotherapy for 868 patients with nasopharyngeal carcinoma:an analysis of survival and treatment toxicities[J].Radiother Oncol,2014,110(3):398-403.
[3] Lohr JG,Stojanov P,Carter SL,etal.Widespread genetic heterogeneity in multiple myeloma:implications for targeted therapy[J].Cancer Cell,2014,25(1):91-101.
[4] Cortés-Cros M,Hemmerlin C,Ferretti S,etal.M2 isoform of pyruvate kinase is dispensable for tumor maintenance and growth[J].Proc Natl Acad Sci,2013,110(2):489-494.
[5] Israelsen WJ,Dayton TL,Davidson SM,etal.PKM2 isoform-specific deletion reveals a differential requirement for pyruvate kinase in tumor cells[J].Cell,2013,155(2):397-409.
[6] 王享利.缺氧对前列腺癌细胞糖酵解及迁移侵袭能力的影响[J].中国现代医学杂志,2016,26(23):32-36.
Wang XL.Hypoxia regulates glycolysis metastasis of prostate cancer cells in vitro[J].Chin J Mod Med,2016,26(23):32-36.
[7] Zha X,Hu Z,Ji S,etal.NFκB up-regulation of glucose transporter 3 is essential for hyperactive mammalian target of rapamycin-induced aerobic glycolysis and tumor growth[J].Cancer Lett,2015,359(1):97-106.
[8] 刘 睿,王晓楠,张 薇,等.PKM2 siRNA 对人甲状腺乳头状癌细胞生长和增殖的影响[J].现代肿瘤医学,2014,22(2):278-282.
Liu R,Wang XN,Zhang W,etal.Effect of PKM2 siRNA on growth and proliferation of papillary thyroid cancer cell[J].J Mod Oncol,2014,22(2):278-282.
[9] Riedl S,Leber R,Rinner B,etal.Human lactoferricin derived di-peptides deploying loop structures induce apoptosis specifically in cancer cells through targeting membranous phosphatidylserine[J].Biochimica et Biophysica Acta (BBA)-Biomembranes,2015,1848(11):2918-2931.
[10] 张芳芳,李 鑫,郭伟英.地喹氯铵对脑胶质瘤细胞凋亡的影响[J].中国老年学杂志,2017,37(4):822-824.
Zhang FF,Li X,Guo WY. Effect of Dequalinium chloride on apoptosis of glioma cells[J].Chin J Gerontol,2017,37(4):822-824.
[11] Cui R,Kim T,Fassan M,etal.MicroRNA-224 is implicated in lung cancer pathogenesis through targeting caspase-3 and caspase-7[J].Oncotarget,2015,6(26):21802.
[12] Zhu H,Li X,Song Y,etal.Long non-coding RNA ANRIL is up-regulated in bladder cancer and regulates bladder cancer cell proliferation and apoptosis through the intrinsic pathway[J].Biochem Biophys Res Commun,2015,467(2):223-228.
[13] Yi L,Zongyuan Y,Cheng G,etal.Quercetin enhances apoptotic effect of tumor necrosis factor-related apoptosis-inducing ligand (TRAIL) in ovarian cancer cells through reactive oxygen species (ROS) mediated CCAAT enhancer-binding protein homologous protein (CHOP)-death receptor 5 pathway[J].Cancer Sci,2014,105(5):520-527.
[14] Deorukhkar A,Ahuja N,Mercado AL,etal.Zerumbone increases oxidative stress in a thiol-dependent ROS-independent manner to increase DNA damage and sensitize colorectal cancer cells to radiation[J].Cancer Med,2015,4(2):278-292.
[15] Liang T,Zhang X,Xue W,etal.Curcumin induced human gastric cancer BGC-823 cells apoptosis by ROS-mediated ASK1-MKK4-JNK stress signaling pathway[J].Int J Mol Sci,2014,15(9):15754-15765.
[16] Gil-Araujo B,Toledo Lobo MV,Gutiérrez-Salmerón M,etal.Dual specificity phosphatase 1 expression inversely correlates with NF-κB activity and expression in prostate cancer and promotes apoptosis through a p38 MAPK dependent mechanism[J].Mol Oncol,2014,8(1):27-38.
[17] Liu J,Wu N,Ma LN,etal.p38 MAPK signaling mediates mitochondrial apoptosis in cancer cells induced by oleanolic acid[J].APJCP,2014,15(11):4519-4525.
[18] Sarkar S,Mandal C,Sangwan R,etal.Coupling G2/M arrest to the Wnt/β-catenin pathway restrains pancreatic adenocarcinoma[J].Endocrine-related Cancer,2014,21(1):113-125.
[19] Wang J,Chen H,Cao P,etal.Inflammatory cytokines induce caveolin-1/β-catenin signalling in rat nucleus pulposus cell apoptosis through the p38 MAPK pathway[J].Cell Prolifera,2016,49(3):362-372.
[20] Wu H,Li Z,Yang P,etal.PKM2 depletion induces the compensation of glutaminolysis through β-catenin/c-Myc pathway in tumor cells[J].Cell Signal,2014,26(11):2397-2405.
[21] Chen L,Tang Z,Wang X,etal.PKM2 aggravates palmitate-induced insulin resistance in HepG2 cells via STAT3 pathway[J].Biochem Biophys Res Commun,2017,492(1):109-115.