STIM1对乳腺癌细胞存活与增殖的影响及初步机制分析
2018-05-25邓程伟吴进盛何淑波
邓程伟 吴进盛 何淑波 罗 超
(儋州市人民医院肿瘤内科,儋州 571700)
乳腺癌是常见的女性恶性肿瘤之一,近些年的发病率呈上升趋势。乳腺癌的发生发展及转移是一个多基因、多阶段参与的复杂过程,已有大量研究表明抑癌基因失活、癌基因启动等参与了其发生发展及转移过程[1-3]。基质相互作用蛋白分子(Stromal interaction molecules1,STIM1)定位于11p15.5人染色体,是细胞内钙库Ca2+传感器,在内质网膜上主要以二聚体形式分布,可通过感受内质网膜中的Ca2+水平对肿瘤的增殖、迁移、侵袭等生命活动进行调节,从而影响多种肿瘤的发生发展,因此是一个致癌基因[4,5]。研究显示,STIM1在结直肠癌、前列腺癌、头颈鳞癌等多种肿瘤中呈现高表达,与肿瘤预后呈现负相关。通过小分子抑制剂或RNA干扰机制抑制其表达后可减缓肿瘤的生长[6-8]。在乳腺癌中的研究发现STIM1的高表达,其表达与患者腋窝淋巴结转移、肿瘤大小呈现正相关,ERα表达和预后呈负相关,可能是判断乳腺癌不良预后的一个指标,沉默乳腺癌细胞STIM1表达可降低癌细胞迁移[9,10]。但关于STIM1对乳腺癌生物学特性及机制研究尚未清楚。因此,本研究首先检测了不同乳腺癌细胞系表达,通过RNA干扰技术抑制STIM1表达,观察细胞增殖凋亡情况,并进一步研究相关的分子机制,为乳腺癌的临床防治及药物开发提供一定理论依据及新的靶标。
1 材料与方法
1.1材料 正常乳腺上皮细胞MCF-10A及乳腺癌 MCF7、HCC1569、MDA-MB-231、 BT549细胞均购自中科院上海细胞库;胎牛血清、RPMI1640培养基、胰蛋白酶均购自美国Gibco;LipofectamineTM2000购自美国Invitrogen公司;二喹啉甲酸(Bicinchoninic acid,BCA)试剂盒、膜联蛋白V-FITC(Annexin V-FITC)/碘化丙啶(PI)细胞凋亡试剂盒均购自碧云天生物技术研究所;细胞增殖核抗原(Proliferating cell nuclear antigen,PCNA)、含半胱氨酸的天冬氨酸蛋白水解酶3(Cysteinyl aspartate specific proteinase 3,Caspase3)、B细胞淋巴瘤/白血病-2(B cell lymphoma/lewkmia-2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)、STAT3和磷酸化的信号转导与转录因子3(Phosphorylated signal transducers and activators of transcription 3,p-STAT3)抗体均购自美国Cell signal公司;酶标仪、流式细胞仪均购自美国Bio-Rad公司。
1.2方法
1.2.1细胞及其培养 取出保存在液氮罐中的细胞,37℃解冻后将细胞置于37℃,体积分数为5% CO2,95%饱和湿度的培养箱中用RPMI1640培养液(含有10%胎牛血清)培养。
1.2.2乳腺癌细胞STIM1的表达检测 采用Western blot检测各乳腺癌细胞中STIM1的蛋白表达。简要步骤如下:提取MCF-10A、MCF7、HCC1569、MDA-MB-231、BT549 5种细胞中的总蛋白,BCA测定蛋白浓度,取等量50 μg蛋白样品行SDS-PAGE电泳(分离胶及浓缩胶的浓度分别为10%和5%,电压为110 V,电泳1.5 h),电泳分离后转硝酸纤维素膜(NC膜),明胶室温封闭1 h,4℃水平摇床孵育均按照1∶1 000 稀释的STIM1和内参GAPDH抗体过夜,次日TBST洗涤细胞(5 min×3次),加入1∶10 000稀释的HRP标记的羊抗兔IgG,洗膜,化学发光法在紫外凝胶成像仪上进行拍照分析。
1.2.3细胞转染 以5×105密度将生长至对数期的MDA-MB-231细胞接种于6孔板,细胞生长达70%~80%培养板底面时,按照脂质体Lipofecta-mineTM2000转染说明将阴性对照组(NC组,转染无义的siRNA序列)和STIM1-siRNA组(转染STIM1的靶向siRNA序列)转染细胞,并设置仅加入脂质体的为空白对照组(Blank组),收集转染48 h的细胞,参照1.2.2方法检测各组细胞中STIM1的蛋白表达。
1.2.4MTT法检测细胞增殖 以每孔5 000个细胞密度将3组细胞接种于96孔板,每组设置6个复孔,并设置空白对照孔,只加入培养液,分别在转染后的24、48和72 h,每孔细胞加入10 μl配置好的MTT溶液,置于培养箱内4 h,弃掉上清液,加入150 μl 的DMSO,置于水平摇床中摇15 min,利用空白对照孔调零,酶标仪于490 nm波长测定光密度值(OD),以此反映细胞活力,间接反映出细胞的增殖情况。实验重复3次。
1.2.5流式细胞术检测细胞凋亡 取转染48 h的细胞,制备成单细胞悬液,预冷的磷酸盐缓冲液洗涤细胞,离心,弃掉上清,冷却的结合缓冲液将细胞浓度调整为5×105个/ml,避光冰上加入5 μl的Annexin V-FITC和5 μl的PI稀释液,继续避光条件培养10 min,加入冷却的400 μl结合缓冲液,30 min内上流式细胞仪检测细胞凋亡情况。实验重复3次。
1.2.6免疫因子检测 参照总RNA提取试剂盒及反转录试剂盒说明提取转染48 h的细胞中RNA及反转录RNA为cDNA。所有引物序列如下:IL-6 F:5′-AGTTGTGCAATGGCAATTCTG-3′,R:5′-AGGAC-TCTGGCTTTGTCTTTC-3′;TNF-α F:5′-ACTGGCGTGTTCATCCGTTCT-3′,R:5′-CGCAATCCAGGCCAC-TACTTC-3′;内参GAPDH 的引物为F:5′-GTCACCAGGGCTGCTTTTAACTC-3′,R:5′-CAGCATCGCCCCACTTGATTTTG-3′。所有引物由上海生工合成。以cDNA为模板,按照试剂盒说明进行扩增,目的基因的相对表达量采用2-ΔΔCt法进行统计。实验重复3次。
1.2.7增殖凋亡相关蛋白及STAT3信号蛋白表达检测 参照1.2.2方法检测增殖相关蛋白PCNA、凋亡蛋白Bcl-2、Bax、Caspase3及STAT3和磷酸化的STAT3的蛋白表达。
2 结果
2.1STIM1基因在乳腺癌细胞表达 STIM1基因在正常乳腺上皮细胞MCF-10A及乳腺癌BT549、HCC1569、MDA-MB-231、MCF7细胞的蛋白表达分别为(0.062±0.008)、(0.537±0.048)、(0.395±0.036)、(0.747±0.063)、(0.512±0.052),5组的蛋白表达比较差异有统计学意义(F=91.851,P=0.000),乳腺癌中STIM1的蛋白表达显著高于在正常乳腺上皮细胞MCF-10A表达(t1=12.795,P1=0.000;t2=8.970,P2=0.000;t3=18.451,P3=0.000;t4=12.121,P4=0.000)。见图1。
2.2STIM1的siRNA转染MDA-MB-231细胞效果 空白对照组、阴性对照组和STIM1-siRNA组STIM1的蛋白表达分别为(0.557±0.054)、(0.524±0.046)、(0.155±0.013),STIM1的蛋白在3组中表达比较有统计学意义(F=86.191,P=0.000),STIM1-siRNA组STIM1的蛋白表达显著低于空白对照组(t=11.825,P=0.000),在阴性对照组表达与空白对照组差异无统计学意义(t=0.971,P=0.369)。见图2。
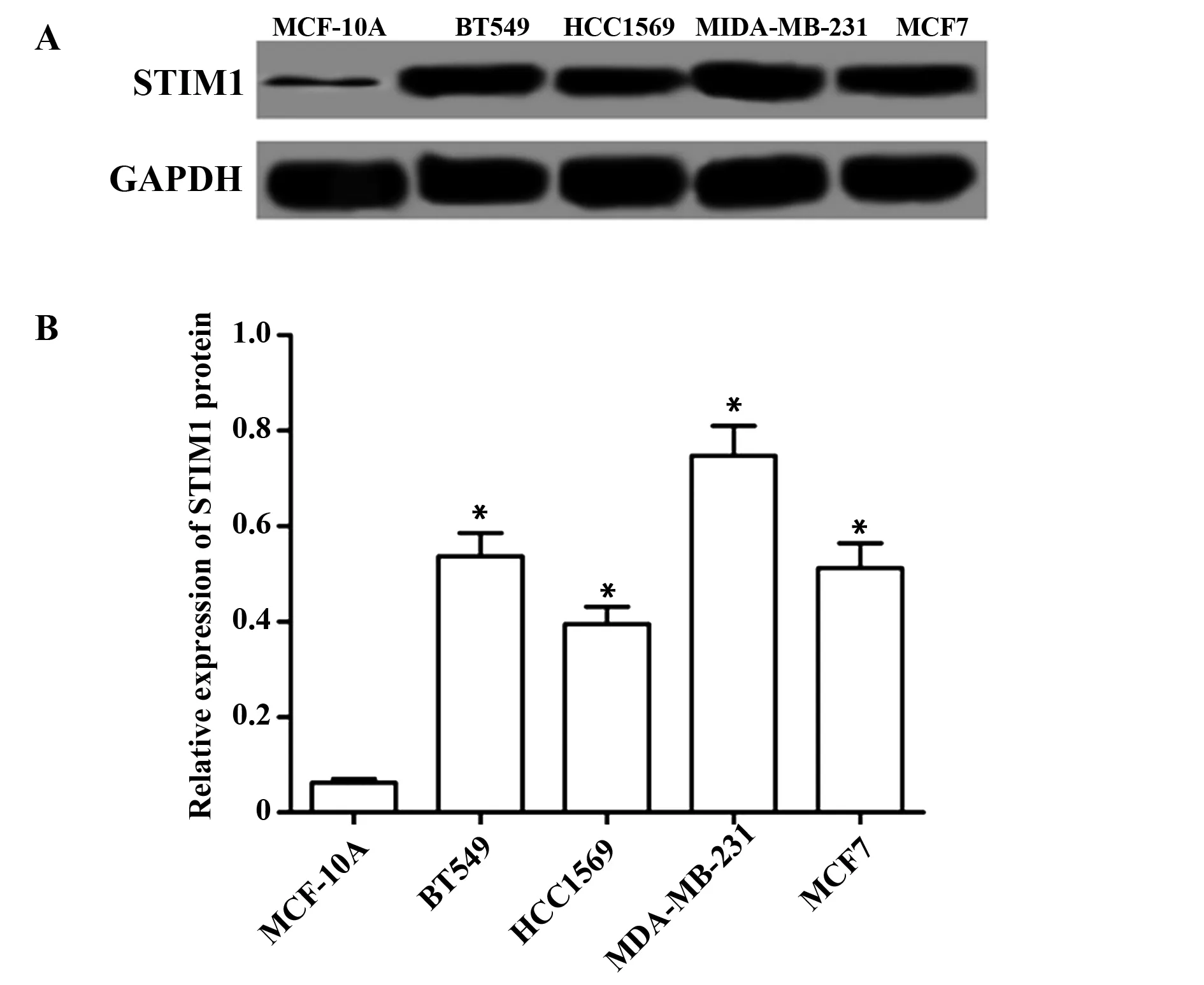
图1 STIM1基因在乳腺癌细胞表达Fig.1 Expression of STIM1 gene in breast cancer cellsNote:A.The expression of STIM1 protein in breast cancer cells was detected by Western blot;B.The relative expression of STIM1 protein.Compared with MCF-10A cells,*.P<0.05.
2.3STIM1的siRNA转染降低MDA-MB-231细胞增殖 各组细胞增殖检测结果如表1所示,3组细胞在24 h的细胞活力差异无统计学意义,在48 h和72 h时STIM1-siRNA 细胞活力显著低于空白对照组(t48 h=3.116,P48 h=0.021;t72 h=4.042,P72 h=0.007)。
2.4STIM1的siRNA转染诱导MDA-MB-231细胞凋亡 空白对照组、阴性对照组和STIM1-siRNA组细胞凋亡率分别为(2.10±0.65)%、(2.77±0.78)%、(18.15±1.68)%,3组细胞凋亡率比较差异有统计学意义(F=192.535,P=0.000),与空白对照组比较,STIM1-siRNA组细胞凋亡率显著升高(t=17.345,P=0.000)。见图3。

图2 STIM1-siRNA转染MDA-MB-231细胞效果Fig.2 Effect of STIM1-siRNA transfection on MDA-MB-231 cellsNote:A.The protein expression of STIM1 in each group;B.The relative expression of STIM1 protein.Compared with blank group,*.P<0.05.
表1STIM1-siRNA转染对MDA-MB-231细胞活力的影响
Tab.1EffectofSTIM1-siRNAtransfectiononviabilityofMDA-MB-231cells

GroupsOD49024h48h72hBlankgroup0320±00610718±00840957±0156NCgroup0326±00480696±00950912±0131STIM1⁃siRNAgroup0311±00650510±00631)0522±01031)F005058619884P095200390013
Note:Compared with blank group,1)P<0.05.
2.5STIM1的siRNA转染对MDA-MB-231细胞增殖凋亡蛋白表达的影响 Western blot检测各组细胞中增殖相关蛋白PCNA、凋亡蛋白Bcl-2、Bax、Caspase3的蛋白表达,结果如图4和表2所示,与空白对照组比较,STIM1-siRNA组PCNA和Bcl-2的蛋白表达均显著低于空白对照组(tPCNA=7.251,PPCNA=0.000;tBcl-2=7.462,PBcl-2=0.000),Bax和Caspase3蛋白表达均显著高于空白对照组(tBax=7.393,PBax=0.000;tCaspase3=10.971,PCaspase3=0.000)。
2.6STIM1的siRNA转染对MDA-MB-231细胞IL-6、TNF-α表达的影响 通过RT-PCR检测3组细胞IL-6、TNF-α表达,结果如表3所示,与空白对照组比较,STIM1-siRNA 组IL-6、TNF-α表达均显著降低(tIL-6=13.680,PIL-6=0.000;tTNF-α=10.304,PTNF-α=0.000)。

图3 STIM1-siRNA转染对MDA-MB-231细胞凋亡的影响Fig.3 Effect of STIM1-siRNA transfection on apoptosis of MDA-MB-231 cellsNote:A.Flow cytometry results;B.Apoptosis rate of each group.Compared with Blank group,*.P<0.05.
2.7STIM1的siRNA转染对MDA-MB-231细胞STAT3信号的影响 Western blot检测STAT3及磷酸化的STAT3的蛋白表达,结果如图5和表4所示,与空白对照组比较,p-STAT3的蛋白表达显著降低(t=7.221,P=0.000),3组间STAT3蛋白表达的差异无统计学意义。
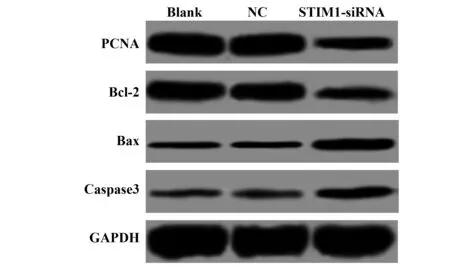
图4 STIM1-siRNA转染对MDA-MB-231细胞增殖凋亡蛋白表达的影响Fig.4 Effect of STIM1-siRNA transfection on proliferation and apoptosis proteins in MDA-MB-231 cells
表3STIM1-siRNA转染对MDA-MB-231细胞IL-6、TNF-α表达的影响
Tab.3EffectofSTIM1-siRNAtransfectiononexpressionofIL-6andTNF-αinMDA-MB-231cells
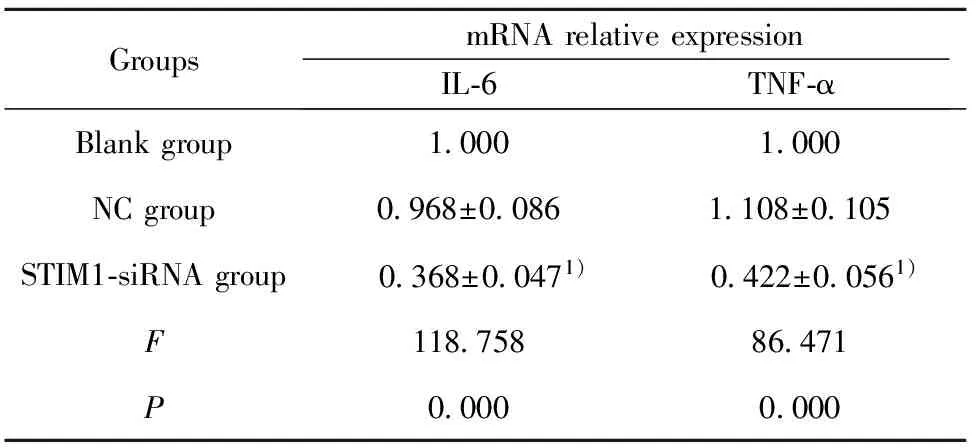
GroupsmRNArelativeexpressionIL⁃6TNF⁃αBlankgroup10001000NCgroup0968±00861108±0105STIM1⁃siRNAgroup 0368±00471) 0422±00561)F11875886471P00000000
Note:Compared with blank group,1)P<0.05.
表2各组细胞PCNA、Bcl-2、Bax、Caspase3的蛋白相对表达量
Tab.2RelativeexpressionlevelsofPCNA,Bcl-2,BaxandCaspase3ineachgroupofcells
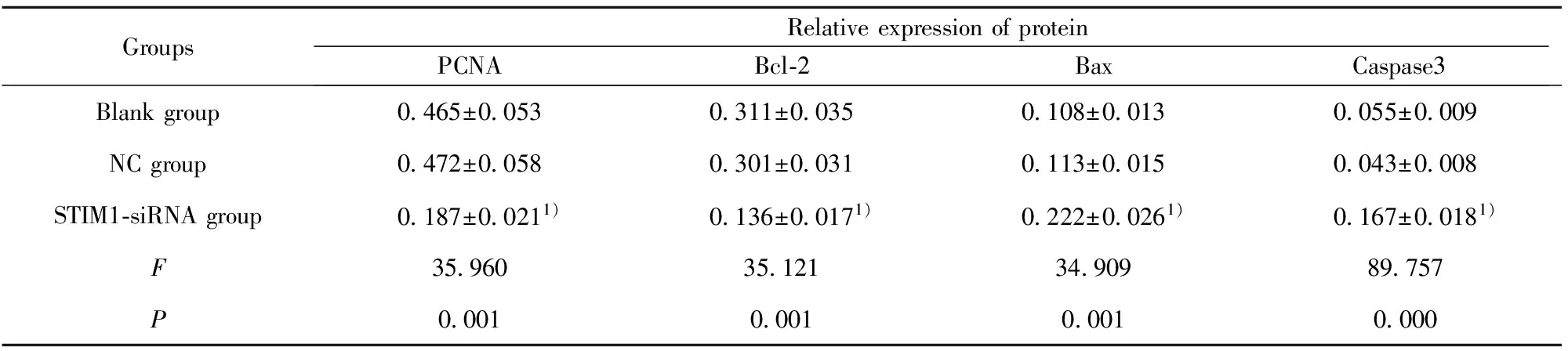
GroupsRelativeexpressionofproteinPCNABcl⁃2BaxCaspase3Blankgroup0465±00530311±00350108±00130055±0009NCgroup0472±00580301±00310113±00150043±0008STIM1⁃siRNAgroup0187±00211)0136±00171)0222±00261)0167±00181)F35960351213490989757P0001000100010000
Note:Compared with blank group,1)P<0.05.
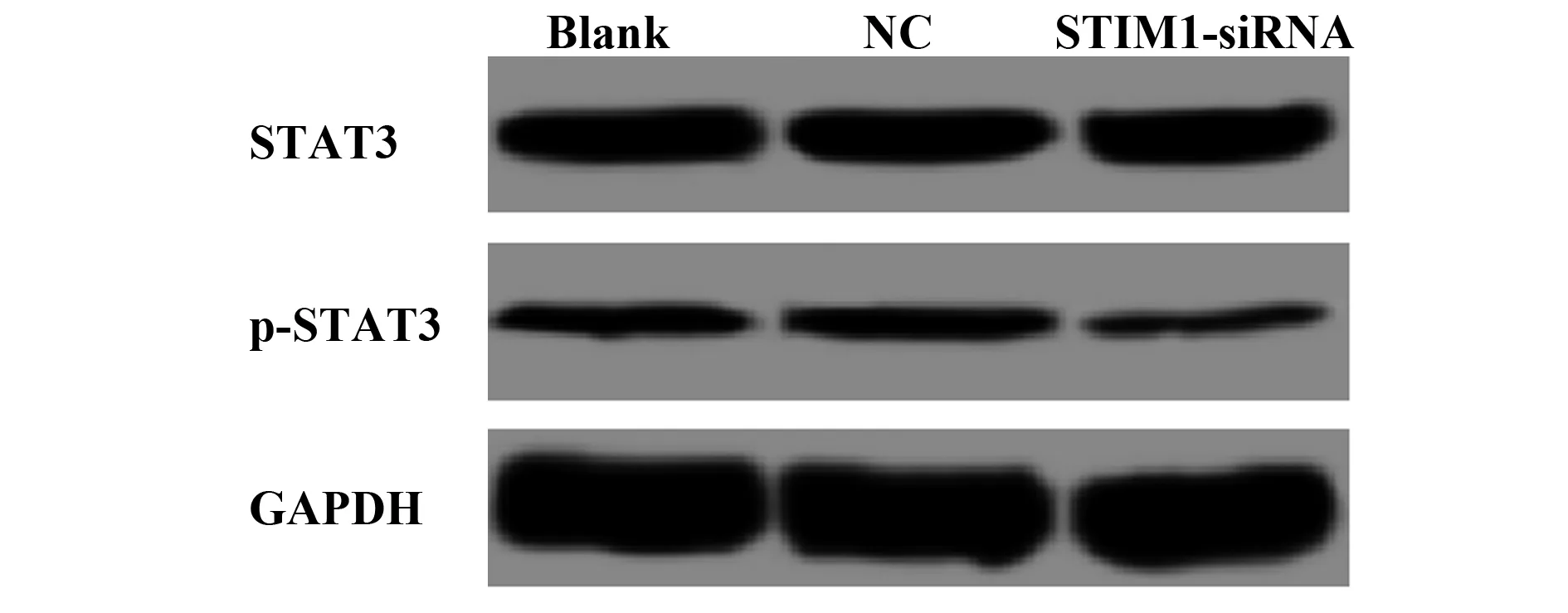
图5 STIM1-siRNA转染对MDA-MB-231细胞STAT3信号的影响Fig.5 Effect of STIM1-siRNA transfection on STAT3 signaling in MDA-MB-231 cells
表4STIM1-siRNA转染对MDA-MB-231细胞STAT3信号的影响
Tab.4EffectofSTIM1-siRNAtransfectiononSTAT3signalinginMDA-MB-231cells

GroupsRelativeexpressionofproteinSTAT3P⁃STAT3Blankgroup0392±00440122±0013NCgroup0399±00460139±0016STIM1⁃siRNAgroup0416±00510044±00101)F020643994P08190000
Note:Compared with blank group,1)P<0.05
3 讨论
肿瘤发生发展是一个多阶段、多因素控制的错综复杂过程,细胞内信号转导通路的紊乱和异常对于其发生发展发挥重要作用。随着对乳腺癌研究的深入,乳腺癌与钙信号通路间的关系受到广泛关注。有研究显示,乳腺癌细胞中Ca2+代谢出现失调,与肿瘤增殖、转移、预后等相关[11]。作为第二信使,细胞内Ca2+对于细胞生长、迁移、分裂及基因转录等生物学功能均具有调控作用[12,13]。STIM1定位于内质网,是细胞内Ca2+浓度变化的感受器,可将胞内Ca2+浓度降低信号传递至胞膜的钙池操纵钙离子通道(Store-operated calcium channel,SOCC),启动的SOCC形成钙释放启动钙通道,最终引起细胞内Ca2+浓度升高[14,15]。有研究发现,STIM1与多种肿瘤的发生发展密切相关[16-18]。对乳腺癌的研究发现STIM1可影响癌细胞的增殖、转移、上皮间质转化等过程,过表达STIM1可增加乳腺癌细胞的迁移及侵袭能力[19,20]。本研究旨在STIM1对乳腺癌增殖凋亡及机制的研究。
通过Western blot检测不同乳腺癌细胞系中STIM1的表达,发现其表达均高于在正常乳腺上皮细胞表达,此结果与前人的研究一致,这提示STIM1在乳腺癌发生发展中的重要作用。RNA干扰(RNA interference,RNAi)技术是近些年来研究基因功能的一种有效手段,能特异、高效地抑制目的基因表达,在生物学领域已得到广泛应用[21,22]。有研究发现,通过RNA干扰技术沉默STIM1的表达可降低胃癌、喉癌等肿瘤细胞的增殖、侵袭、迁移能力,并诱导癌细胞的凋亡[23,24]。本研究结果显示,STIM1表达的抑制可降低乳腺癌细胞增殖,诱导细胞凋亡。细胞的增殖及凋亡处于动态平衡,平衡打破将导致肿瘤的发生。PCNA是一个分子量为36 kD的非组蛋白,是合成DNA不可缺少的因子,在细胞增殖过程中起重要作用[25,26]。诱导肿瘤细胞凋亡是肿瘤治疗的一个方法,凋亡过程受到Caspase、Bcl-2、细胞色素C、Survivin等多种癌基因和抑癌基因的调节,其中Caspase和Bcl-2家族在细胞凋亡中发挥关键作用[27,28]。Bcl-2家族包括抑凋亡基因和促凋亡基因,Bcl-2为抑凋亡基因,Bax为促凋亡基因,细胞凋亡受到两者比率的影响,Bcl-2/Bax比率降低促进凋亡,升高抑制凋亡[29-31]。Caspase家族是细胞凋亡过程中起到关键作用的一类半胱氨酸蛋白酶,Caspase3是该家族级联反应下游的关键酶,在细胞凋亡中发挥关键作用,因此也被称为死亡蛋白酶,生理条件下Caspase3在哺乳动物组织及细胞中以无活性的酶原形成存在,当有凋亡刺激时被启动,从而使细胞走向凋亡[32-34]。目前乳腺癌中常用Caspase3活性检测是否发生凋亡。本研究结果显示,STIM1表达的抑制可降低PCNA和Bcl-2表达,上调Bax和Caspase3表达。这提示抑制STIM1表达可通过下调PCNA表达降低乳腺癌细胞增殖,下调Bcl-2、上调Bax和Caspase3表达诱导细胞凋亡。
抑制STIM1表达后通过RT-PCR检测炎症免疫因子IL-6、TNF-α表达,发现其表达均显著降低,这提示STIM1可通过免疫调节对乳腺癌起保护作用。STAT3属于转录因子STATs家族中的一员,是多种致癌信号的汇集点,在多种实体肿瘤中出现异常启动,持续启动的STAT3可促进肿瘤的形成和发展,目前是恶性肿瘤信号通路研究中的热点[35-38]。研究发现,STAT3的活化水平与乳腺癌患者预后直接相关,磷酸化的STAT3水平越高,患者预后越差[39];乳腺癌细胞中抑制STAT3信号通路表达可降低其发生发展过程[40]。本研究结果显示,抑制STIM1表达可降低磷酸化的STAT3的表达。
综上所述,STIM1基因在乳腺癌细胞高表达,通过RNA干扰抑制其表达可降低癌细胞活力,诱导细胞凋亡、提高免疫及下调STAT3信号。其中对细胞增殖的影响是通过下调PCNA表达,对凋亡的影响是下调Bcl-2、上调Bax和Caspase3表达。本研究可能为乳腺癌的分子诊断及靶向性治疗提供了一定的理论依据。但本研究仅仅在细胞水平检测了细胞的增殖凋亡情况,其他多种生物学特性及机制还未明确,体内实验如何也未可知。这些也将是后续实验研究的重点。
参考文献:
[1] Pickard MR,Williams GT.Regulation of apoptosis by long non-coding RNA GAS5 in breast cancer cells:implications for chemotherapy[J].Breast Cancer Res Treatment,2014,145(2):359-370.
[2] Tuo YL,Li XM,Luo J.Long noncoding RNA UCA1 modulates breast cancer cell growth and apoptosis through decreasing tumor suppressive miR-143[J].Eur Rev Med Pharmacol Sci,2015,19(18):3403-3411.
[3] Queiroz EAIF,Puukila S,Eichler R,etal.Metformin induces apoptosis and cell cycle arrest mediated by oxidative stress,AMPK and FOXO3a in MCF-7 breast cancer cells[J].PLoS One,2014,9(5):e98207.
[4] Liu B,Yu HH,Ye HL,etal.Effects of stromal interacting molecule 1 gene silencing by short hairpin RNA on the biological behavior of human gastric cancer cells[J].Mol Med Rep,2015,12(2):3047-3054.
[5] Shalygin A,Skopin A,Kalinina V,etal.STIM1 and STIM2 proteins differently regulate endogenous store-operated channels in HEK293 cells[J].J Biolog Chem,2015,290(8):4717-4727.
[6] Wang JY,Sun J,Huang MY,etal.STIM1 overexpression promotes colorectal cancer progression,cell motility and COX-2 expression[J].Oncogene,2015,34(33):4358-4367.
[7] Selvaraj S,Sun Y,Sukumaran P,etal.Resveratrol activates autophagic cell death in prostate cancer cells via downregulation of STIM1 and the mTOR pathway[J].Mole Carcinogenesis,2016,55(5):818-831.
[8] Li P,Bian X,Chen Q,etal.Blocking of stromal interaction molecule 1 expression influence cell proliferation and promote cell apoptosis in vitro and inhibit tumor growth in vivo in head and neck squamous cell carcinoma[J].PLoS One,2017,12(5):e0177484.
[9] Yang Y,Jiang Z,Wang B,etal.Expression of STIM1 is associated with tumor aggressiveness and poor prognosis in breast cancer[J].Pathol Res Pract,2017,213(9):1043-1047.
[10] Kondratska K,Kondratskyi A,Yassine M,etal.Orai1 and STIM1 mediate SOCE and contribute to apoptotic resistance of pancreatic adenocarcinoma[J].Biochimica et Biophysica Acta (BBA)-Mol Cell Res,2014,1843(10):2263-2269.
[11] Azimi I,Beilby H,Davis FM,etal.Altered purinergic receptor-Ca2+signaling associated with hypoxia-induced epithelial-mesenchymal transition in breast cancer cells[J].Mol Oncol,2016,10(1):166-178.
[12] Huang Y,Li X,Wang Y,etal.Endoplasmic reticulum stress-induced hepatic stellate cell apoptosis through calcium-mediated JNK/P38 MAPK and Calpain/Caspase-12 pathways[J].Mol Cell Biochem,2014,394(1-2):1-12.
[13] Li L,Tan H,Gu Z,etal.Heat stress induces apoptosis through a Ca2+-mediated mitochondrial apoptotic pathway in human umbilical vein endothelial cells[J].PLoS One,2014,9(12):e111083.
[14] 徐金眉,周 艳,李小安,等.STIM1 在肿瘤中的研究进展[J].成都医学院学报,2014,9(6):742-746.
Xu JM,Zhou Y,Li XA,etal.Research progress of STIM1 in tumor[J]. J Chengdu Med Coll,2014,9(6):742-746.
[15] Zhang H,Sun AY,Kim JJ,etal.STIM1-Ca2+signaling modulates automaticity of the mouse sinoatrial node[J].Proc Nat Acad Sci,2015,112(41):E5618-E5627.
[16] Jardin I,Rosado JA.STIM and calcium channel complexes in cancer[J].Biochim et Biophysica Acta (BBA)-Mol Cell Res,2016,1863(6):1418-1426.
[17] 乔令艳,刘 爽.STIM1 对甲状腺癌细胞 SW579 的影响及其分子机制[J].滨州医学院学报,2015,38(4):241-242.
Qiao LY,Liu S.The influence and molecular mechanism of STIM1 on SW579 thyroid cancer cells[J].J Binzhou Med Univ,2015,38(4):241-242.
[18] Li W,Zhang M,Xu L,etal.The apoptosis of non-small cell lung cancer induced by cisplatin through modulation of STIM1[J].Exp Toxicol Pathol,2013,65(7):1073-1081.
[19] Cheng H,Wang S,Feng R.STIM1 plays an important role in TGF-β-induced suppression of breast cancer cell proliferation[J].Oncotarget,2016,7(13):16866-16878.
[20] Zhang S,Miao Y,Zheng X,etal.STIM1 and STIM2 differently regulate endogenous Ca2+entry and promote TGF-β-induced EMT in breast cancer cells[J].Biochem Biophys Res Commun,2017,488(1):74-80.
[21] 李培栋,王新军,单 峤,等.RNA 干扰 Fascin1 表达抑制胶质瘤细胞 U87MG 的侵袭,转移能力[J].中国免疫学杂志,2015,31(6):764-768.
Li PD,Wang XJ,Shan Q,etal.Reversal effect of RNA interference targeting Fascin1 on migration and invasion of glioma cell line U87 MGs[J]. Chin J Immunol,2015,31(6):764-768.
[22] Li-Byarlay H,Li Y,Stroud H,etal.RNA interference knockdown of DNA methyl-transferase 3 affects gene alternative splicing in the honey bee[J].Proc Natl Acad Sci,2013,110(31):12750-12755.
[23] Xia J,Wang H,Huang H,etal.Elevated Orai1 and STIM1 expressions upregulate MACC1 expression to promote tumor cell proliferation,metabolism,migration,and invasion in human gastric cancer[J].Cancer Lett,2016,381(1):31-40.
[24] 冶 娟,解 静.STIM1 RNA 干扰对人喉癌细胞增殖和凋亡的影响[J].临床耳鼻咽喉头颈外科杂志,2017,31(11):844-848.
Ye J,Xie J.Effect of STIM1 by RNA interference on proliferation and apoptosis of human laryngeal carcinoma cells[J].J Clin Otolaryngol Head Neck Surg,2017,31(11):844-848.
[25] Zhao H,Chen MS,Lo YH,etal.The Ron receptor tyrosine kinase activates c-Abl to promote cell proliferation through tyrosine phosphorylation of PCNA in breast cancer[J].Oncogene,2014,33(11):1429-1437.
[26] Yang M,Zhai X,Xia B,etal.Long noncoding RNA CCHE1 promotes cervical cancer cell proliferation via upregulating PCNA[J].Tumor Biol,2015,36(10):7615-7622.
[27] Cheng CH,Cheng YP,Chang IL,etal.Dodecyl gallate induces apoptosis by upregulating the caspase-dependent apoptotic pathway and inhibiting the expression of anti-apoptotic Bcl-2 family proteins in human osteosarcoma cells[J].Mol Med Rep,2016,13(2):1495-1500.
[28] 李红梅,邢 云,唐翔诩,等.小檗碱抑制脓毒症诱导的肠上皮细胞凋亡[J].中国病理生理杂志,2016,32(9):1660-1665.
Li HM,Xing Y,Tang XX,etal.Berberine inhibits enterocyte apoptosis in septic mice[J].Chin J Pathophysiol,2016,32(9):1660-1665.
[29] Al-Fatlawi AA,Al-Fatlawi AA,Irshad M,etal.Rice bran phytic acid induced apoptosis through regulation of Bcl-2/Bax and p53 genes in HepG2 human hepatocellular carcinoma cells[J].Asian Pac J Cancer Prev,2014,15(8):3731-3736.
[30] 刘 芳,赵世敏,张 威,等.沙棘多糖对急性肝损伤小鼠氧化应激的抑制作用及其对 BCL-2/Bax 和 PPAR-γ 的调控[J].中国免疫学杂志,2016,32(3):358-361.
Liu F,Zhao SM,Zhang W,etal.Inhibitory effects of seabuckthorn polysaccharide on oxidative stress in mice with actue liver injury and modulatory effect on BCL-2/Bax and PPAR-γ expression[J].Chin J Immunol,2016,32(3):358-361.
[31] Sharifi S,Barar J,Hejazi MS,etal.Roles of the Bcl-2/Bax ratio,caspase-8 and 9 in resistance of breast cancer cells to paclitaxel[J].Asian Pac J Cancer Prev,2014,15(20):8617-8622.
[32] 任吉祥,刘 爽,孙 洋,等.新型肿瘤抑素对 C6 神经胶质瘤细胞抑制作用的影响[J].中国老年学杂志,2016,36(19):4705-4706.
Ren JX,Liu S,Sun Y,etal.The effect of new tumor statin on the inhibition of C6 glioma cells[J].Chin J Gerontol,2016,36(19):4705-4706.
[33] Cheng Q,Cao X,Yuan F,etal.Knockdown of WWP1 inhibits growth and induces apoptosis in hepatoma carcinoma cells through the activation of caspase3 and p53[J].Biochem Biophys Res Commun,2014,448(3):248-254.
[34] Sukohar A,Muhartono M.Comparative effects of chlorogenic acid and doxorubic in against expression of caspase3 in cell lines Hep-G2[J].J Chem Pharmaceuti Res,2015,7(1):187-192.
[35] Yu H,Lee H,Herrmann A,etal.Revisiting STAT3 signalling in cancer:new and unexpected biological functions[J].Nat Rev Cancer,2014,14(11):736-746.
[36] 朱鹏冲,孙志钢,肖 伟,等.非小细胞肺癌组织 STAT3 信号与靶基因 VEGF 及 VEGF-C 关系的研究[J].中华肿瘤防治杂志,2016,23(12):780-785.
Zhu PC,Sun ZZ,Xiao W,etal.Relationship between STAT3 signaling pathway and its target gene VEGF,VEGF-C in patients with non-small cell lung cancer[J].Chin J Cancer Prevent Treatment,2016,23(12):780-785.
[37] 任春霞,马锦琪,吕祝武,等.IL-6 通过活化 STAT3/Notch 信号促进癌相关成纤维细胞衰老及宫颈癌上皮细胞侵袭与放疗抵抗的机理研究[J].中国癌症杂志,2016,26(12):961-967.
Ren CX,Ma JQ,Lü ZW,etal.Mechanistic study of cancer-associated fibroblast senescence and cervical cancer cell invasiveness and radio-resistance conferred by IL-6 through activation of STAT3 and Notch signaling[J].China Oncol,2016,26(12):961-967.
[38] Sanchez-Lopez E,Flashner-Abramson E,Shalapour S,etal.Targeting colorectal cancer via its microenvironment by inhibiting IGF-1 receptor-insulin receptor substrate and STAT3 signaling[J].Oncogene,2016,35(20):2634-2644.
[39] Lapeire L,Hendrix A,Lambein K,etal.Cancer-associated adipose tissue promotes breast cancer progression by paracrine oncostatin M and Jak/STAT3 signaling[J].Cancer Res,2014,74(23):6806-6819.
[40] Maycotte P,Gearheart CM,Barnard R,etal.STAT3-mediated autophagy dependence identifies subtypes of breast cancer where autophagy inhibition can be efficacious[J].Cancer Res,2014,74(9):2579-2590.