盐度对副溶血性弧菌生物特性的影响
2018-05-24沈津宇
◎ 沈津宇,倪 莹,高 璐
(扬州大学食品科学与工程学院,江苏 扬州 225127)
副溶血性弧菌(Vibrio parahaemolyticus,简称V.p),是海洋生物中常见的病原菌,也是引起人类肠道疾病的一种食源性致病菌,革兰氏阴性、嗜盐、无芽孢、无荚膜、有极生鞭毛、运动活泼,菌体呈弧状、杆状或丝状等,最适培养基含盐量为2%~4%,低于0.5%或高于10%的盐度环境下难以生长[1-3]。
食品的储运加工过程中,多种处理方法可能会使食源性致病菌处于不利生存环境。研究表明,大多数细菌能对这种不利生存环境作出应激响应,使其保持一定的代谢活性和致病能力并维持生存。当环境条件适合其生长,细菌将迅速修复并繁殖,因此对食品的安全造成了极大的隐患[4-5]。
本文分析了耐低盐和耐高盐副溶血性弧菌分离株在含0.6%、3%、8%NaCl的APW中生物被膜生成力、溶血素活力、产胞外蛋白酶的能力,旨在探究不同菌株在应对环境中盐度变化时的响应能力,为副溶血性弧菌应对不利条件胁迫响应机制的研究提供基础。
1 材料与方法
1.1 菌株与试剂
本研究所用副溶血性弧菌菌株YZHY003、YZHY005、YZHY019、YZHY020、YZHY027、YZHY028和YZHY033均分离自水产品,由扬州大学食品微生物实验室分离并保藏。
硫代硫酸盐柠檬酸盐胆盐蔗糖(TCBS)琼脂培养基、氯化钠碱性蛋白胨水(APW)培养基,均购自杭州微生物试剂有限公司。
1.2 仪器与设备
T-6紫外分光光度计(菲勒仪器有限公司),TG16A型台式离心机(湖南赛特湘仪离心机仪器有限公司),SX-500型高压蒸汽灭菌锅(日本TOMMY公司),YRH-800F生化培养箱(上海姚氏仪器设备厂),Heraguard™ ECO超净工作台(Thermo Fisher公司),M200多功能酶标仪(瑞士Tecan公司)。
1.3 方法
1.3.1 菌株准备
实验室保存的副溶血性弧菌分离株经3% APW(pH7.5)中,37 ℃、120 r/min摇床培养过夜;划线于TCBS平板,挑取绿色、光滑的典型菌落,接种于APW中,37 ℃、120 r/min摇床过夜培养;吸取菌液于1.5 mL灭菌离心管中,8 000 r/min离心5 min,弃上清,用灭菌生理盐水重悬,调整菌液OD600至0.6,制得菌悬液备用。
1.3.2 耐高盐、低盐菌株的筛选
分别配制0.5%、0.6%、0.7%、0.8%、0.9%和1.0%NaCl的APW作为低盐度筛选条件,5%、6%、7%、8%、9%和10% NaCl的APW作为高盐度筛选条件,用柠檬酸调整APW的pH至7.0。
吸取100 μL各分离株菌体悬液,分别接种于10 mL各盐度APW中,每个条件设置3个平行样,37 ℃、120 r/min摇床培养24 h;选取在最低NaCl浓度和最高NaCl浓度中能生长(OD600>0.3)的菌株作为后续研究用菌株。
1.3.3 生物被膜生成情况测定[6]
选取菌株分别接种于0.6%、3%和8% NaCl的APW上,37℃、120 r/min摇床培养24 h后,调整菌液OD600至0.8左右,以200 μL/孔加入96孔板,每组9个平行,无菌APW作空白对照;25 ℃静置培养3 d,隔天换液;吸出菌液,灭菌生理盐水清洗2次;以200 μL/孔加入0.1%结晶紫染色,静置5 min后吸出液体,灭菌生理盐水清洗3次后于60 ℃恒温干燥10 min;以200 μL/孔加入33%冰醋酸,静置10 min后用酶标仪测OD630。各菌株OD630减去阴性对照OD630,定义增加0.001为一个活力单位(U)。
1.3.4 溶血素活力测定[6]
采集新鲜鸡血制备10%红细胞悬液,以100 μL/孔加入96孔板备用;各盐度菌液离心取上清100 μL加入96孔板,每组9个平行,新鲜APW培养液作为阴性对照,于37 ℃恒温放置1 h后测OD540。各菌株OD540减去阴性对照OD540,定义减小0.001为一个活力单位(U)。
1.3.5 产胞外蛋白酶能力测定[6]
将酪蛋白1.0 g、酵母浸出粉0.2 g、NaCl 3.5 g溶解于100 mL蒸馏水,调节pH至8.5,制成A液;将3 g琼脂溶解于50 mL蒸馏水,制成B液;A液、B液灭菌后立即混合,摇匀后,倾注平板,制成酪蛋白平板;各菌株经0.6%、3%和8% NaCl APW培养后的菌液点种于酪蛋白平板上,37 ℃过夜培养后,用卢戈氏碘液对培养基进行染色,测定透明水解圈直径/菌落直径(D/d)。
2 结果与分析
2.1 盐度对副溶血性弧菌生长的影响
副溶血性弧菌分离株在不同盐度APW中的生长情况如图1所示,随着盐度的增加(>6% NaCl)或降低(<1.0% NaCl),弧菌菌株的生长能力逐渐降低(OD600下降),但不同菌株的差异明显:有些菌株(如YZHY27)在低盐度(0.5% NaCl)和较高盐度(8%NaCl)范围内的APW中均能生长(OD600>0.3);有些菌株(如YZHY05、YZHY20)在较低盐度(0.5%NaCl)和较高盐度(8% NaCl)范围内的APW中均不能较好生长(OD600<0.3);有些菌株(如YZHY28)在较低盐度(0.6% NaCl)的APW中几乎不生长(OD600<0.3),而在较高盐度(8% NaCl)的APW中生长较其他菌株好(OD600>0.3)。不同耐盐菌株YZHY27、YZHY05进行后续菌株生物学特性研究。
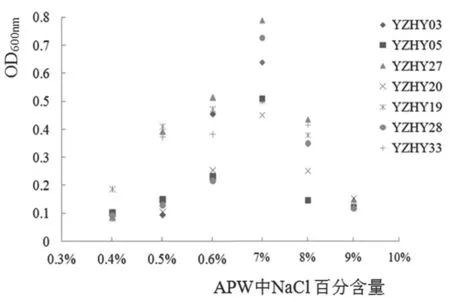
图1 副溶血性弧菌菌株在各盐度APW中生长情况图
2.2 生物被膜生成能力
在不同盐度培养条件下,副溶血性弧菌菌株生物被膜生成能力如图2所示,耐盐能力不同的两株分离株的生物被膜生成能力有所差异,但差异不明显。两菌株在含3% NaCl的最适盐度APW中生物被膜生成能力最强,而在低盐度(0.6% NaCl)和较高盐度(8% NaCl)条件下成膜能力明显降低,与3% NaCl条件相比差异显著,说明盐度对副溶血性弧菌的生物被膜生成能力有明显影响,这与渠宏雁等[7]的研究结果基本一致。
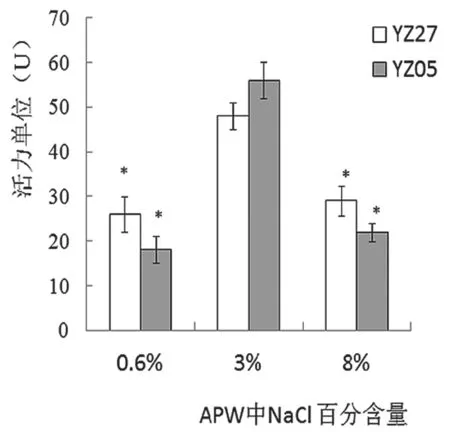
图2 生物被膜生成能力图
2.3 溶血素活力
副溶血性弧菌的溶血素与其致病力有关[8],菌株在不同盐度培养基中溶血素活力如图3所示。耐盐能力不同的两株分离株的溶血素活力也不同,但差异不明显。两菌株在含3% NaCl的最适盐度APW中溶血素活力最强,而在低盐度(0.6% NaCl)和较高盐度(8% NaCl)条件下活力明显降低,与3% NaCl条件相比差异显著,说明盐度对副溶血性弧菌的溶血素活力有明显影响。

图3 溶血素活性测定结果图
2.4 产胞外蛋白酶能力
在不同盐度培养基中,副溶血性弧菌菌株产胞外蛋白酶能力如图4所示。耐盐能力不同的两株分离株在低盐度(0.6% NaCl)、高盐度(8% NaCl)和最适盐度(3% NaCl)的APW中产胞外蛋白酶能力有所差异但差异不显著。说明盐度对副溶血性弧菌的产胞外蛋白酶能力没有明显影响。

图4 产胞外蛋白酶能力图
3 结论
不同副溶血性弧菌分离株对盐的耐受能力有着明显的差异,有些菌株能在较低和(或)较高盐度条件下生长,有些则不能。所选的两菌株的生物被膜生成能力和溶血素活力均表现为在最适盐度下能力最强,在低盐或高盐条件下能力明显减弱,而其产胞外蛋白酶能力没有明显影响。
参考文献:
[1]Holt JG, Krieg NR, Sneath PH, et al. Bergey’s manual of determinative bacteriology[M].Philadelphia:Williams &Wilkins,1994:190-194.
[2]Balows A,Hausler WJ,Herrmann KL,et al.Manual of clinical microbiol[M].Washington DC:American Society for Microbiology,1991:384-389.
[3]杨 娟,杨海玉,周 静.泰州市淡产品中副溶血性弧菌污染状况调查[J].现代预防医学,2009,36(4):639-640.
[4]YANG Z Q,JIAO X A,ZHOU X H, et al.Isolation and molecular characterization of Vibrio parahaemolyticus from fresh, lowtemperature preserved, dried, and salted seafood products in two coastal areas of eastern China[J]. International Journal of Food Microbiology,2008,125:279-285.
[5]ZHANG XY,HAN XX,CHEN XL,et al. Diversity of cultivable protease-producing bacteria in sediments of Jiaozhou Bay,China[J]. rontiers in Microbiology,2015,6:1021.
[6]刘代新,宁喜斌,张继伦.响应面分析法优化副溶血性弧菌生长条件[J].微生物学通报,2008,35(2):306-310.
[7]Høiby N. A short history of microbial biofilms and biofilm infections [J]. APMIS,2017,125(4):272-275.
[8]王淑娴.海洋弧菌中五类溶血素基因分布及其生物学活性研究[M].青岛:中国海洋大学,2007.
