来源于H5N1患者的VH1-2编码广谱抗体的筛选与功能研究
2018-05-24孙颖白天李梓阮菲儿陈玲玲鲁健刘丽琦王大燕舒跃龙秦堃
孙颖 白天 李梓 阮菲儿 陈玲玲 鲁健 刘丽琦 王大燕 舒跃龙 秦堃
周剑芳
100052 北京,中国疾病预防控制中心病毒病预防控制所 中国国家流感中心
流感是由流感病毒引起的急性呼吸道传染病,除了引发季节性流感的H1N1、H3N2和B型流感病毒之外,一些新型禽流感病毒(包括H5N1、H5N6、H6N2、H9N2、H7N9和H10N8等)可由禽感染人类,对人类健康造成了巨大威胁[1-3],因此,寻找有效的流感治疗措施十分重要。
血凝素(Hemagglutinin,HA)是流感病毒表面重要的糖蛋白,近年来,研究者发现大量可以对不同的流感病毒产生交叉保护作用的抗HA广谱中和抗体[4-12]可有效应对由HA抗原的高度变异所导致的免疫逃逸,对流感的防治具有重大意义。本研究通过对H5N1患者外周血中循环的B细胞进行体外培养及筛选获得可表达流感抗体的B细胞,对其抗体基因库进行扩增筛选,得到了由VH1-2编码的抗HA广谱反应性抗体基因序列,并对其编码抗体的功能进行了初步研究。
1 材料与方法
1.1材料293T细胞及MDCK细胞为本实验室保存。饲养细胞为表面表达人CD40 L的3T3细胞,经Co60照射,液氮保存。实验所用毒株A/Shanghai/1/2009(2009pdmH1N1, SH-H1N1), RG A/Hubei/1/2011(H5N1, HB-H5N1), RG A/Guangdong/1/2014(H5N6, GD-H5N6), A/waste water/Guangxi/2/2010(H6N2, GX-H6N2), A/HongKong/2009(H9N2,HK-H9N2), A/environment/Jiangxiboyanglake/1102/2014(H12N5, JX-H12N5), A/Hong Kong/01/1968(H3N2, HK-H3N2), RG A/Anhui/1/2016(H7N9, AH-H7N9) 和RG A/Jiangxi/346/2013(H10N8, JX-H10N8)。质粒pVRC-GX/H5N1-HA、pVRC-GX/H5N1-NA、pVRC-GD003/H7N9-HA、 pVRC-AH/H7N9-NA的基因分别来源于A/Guangxi/1/2008(H5N1)、A/Anhui/1/2016(H7N9)、A/Guangdong/17SF003/2016(H7N9),质粒pNL4-3.luc为本室保存。重组HA蛋白HB-H5(A/Hubei/1/2011)和ZJ-H7(A/Zhejiang/1/2013),由本室使用昆虫杆状病毒系统表达纯化。
1.2间接ELISA实验以HB-H5或ZJ-H7蛋白1 μg/ml,50 μl/孔包被96孔酶标板,4 ℃过夜;1%BSA封闭1 h后使用PBST洗涤;待检抗体从80 μg/ml开始做二倍稀释,50 μl稀释后的抗体或培养上清原液加入洗涤后的酶标板中,37 ℃孵育1 h;充分洗涤之后加入1∶10000稀释的HRP标记山羊抗人IgG(中杉金桥),37 ℃孵育1 h;充分洗涤,使用100 μl TMB显色,50 μl 2 mmol/L H2SO4终止后读取450 nm/630 nm处光吸收值。取空白对照10倍以上为阳性。
1.3假病毒(pps)制备及假病毒中和试验(ppsNT) 将对应的HA、NA表达质粒与pNL4-3.luc共转染293T细胞,制备GX-H5N1和GD003-H7N9假病毒。转染后48 h收集转染上清,1 350×g离心10 min去除沉淀,用0.22 μm针头滤器(Millipore)抽滤后保存于4 ℃备用。将MDCK细胞按3×104个/100 μl接种96孔板,37 ℃,5% CO2培养过夜。待检抗体从80 μg/ml开始做二倍稀释,50 μl稀释后的抗体或培养上清原液与50 μl假病毒混合,37 ℃相互作用1 h。使用PBS洗板1次,将抗体和假病毒混合液感染MDCK细胞,37 ℃,12 h后换含2% FBS MEM培养基,继续培养24 h,用报告基因检测试剂盒(PerkinElmer)检测相对荧光单位(RLU)。平行设置假病毒对照和细胞对照。中和百分率(%)=(假病毒对照RLU-检测血清RLU)/(假病毒对照RLU-细胞对照RLU)×100%。取中和百分率>80%为阳性。
1.4B细胞培养、筛选及基因库构建、筛选本实验所使用外周血单个核细胞(PBMC)标本于2009年分离自一位H5N1患者感染后20 d的外周血,冻存于液氮中。利用人记忆性B细胞分选试剂盒(STEMCELL)从复苏的PBMC中分离出CD19+ B细胞,将大约20个B细胞与2×104个饲养细胞共培养在96孔板中,加入20 ng/ml hIL-2,1 μg/ml CpG2006和10 ng/ml hIL-21。培养10 d后筛选培养上清对HB-H5和ZJ-H7的结合。HB-H5结合阳性孔进一步用GX-H5N1假病毒检测。然后构建抗体轻链和重链基因库,方法参照Tiller等研究者[13],每孔对10个以上重链或轻链克隆进行测序,通过IMGT网站比对。将同孔的轻链、重链质粒组合,转染293T细胞;培养48 h后,测定上清对HB-H5和ZJ-H7的结合活性,及GX-H5N1假病毒中和活性。
1.5抗体体外表达及纯化将6×106个293T细胞接种于T75中,37 ℃,5% CO2条件下培养过夜;取轻、重链质粒各10 μg共转染293T细胞,培养5 d,期间补加含 10% 低IgG FBS的DMEM培养基;收集转染后的培养上清,865×g离心10 min,用0.45 μm滤器过滤;利用蠕动泵,滤液以1.5 ml/min的速度流过蛋白G纯化柱,捕获IgG;利用AKTA仪器,用pH为2.7的甘氨酸-盐酸洗脱液洗脱,收集纯化的抗体。抗体经浓缩,缓冲液置换,分装保存于-80 ℃备用。
1.6抗体功能测定首先测定抗体的结合活性,假病毒中和活性。然后通过流式荧光细胞分选技术(FACS)检测广谱结合活性: 即用多种亚型流感病毒分别感染MDCK细胞,感染后12~14 h收集细胞;取106个感染细胞与终浓度为5 μg/ml的抗体混合,37 ℃孵育1 h;PBS清洗后加入1∶250稀释的FITC标记山羊抗人IgG,37 ℃孵育1 h;PBS清洗后上机检测,使用BD Diva软件分析。病毒感染用细胞内NP蛋白染色确认。
2 结果
2.1H5N1患者外周血B细胞筛选结果分选到5.8×104个B细胞,分2928孔进行培养。用HB-H5 对培养10 d的上清筛选,筛选到38孔(1.3%)H5阳性克隆。进一步筛选后有7孔H5/H7双阳性细胞,约占0.24%,表明此H5N1感染患者外周血中已存在少量交叉反应性B细胞。
2.2筛选获得由VH1-2基因编码的中和抗体综合各个孔上清筛选结果,共挑选14孔B细胞进行抗体基因文库的构建。初筛结果显示3-32G7克隆孔为H5/H7双阳性,该孔扩增获得一种重链,两种轻链。其基因信息如表1所示。初筛结果发现,VH1-2重链与这两种轻链组合表达的抗体具有相似的抗原识别谱和对H5N1 pps的中和功能(表2)。
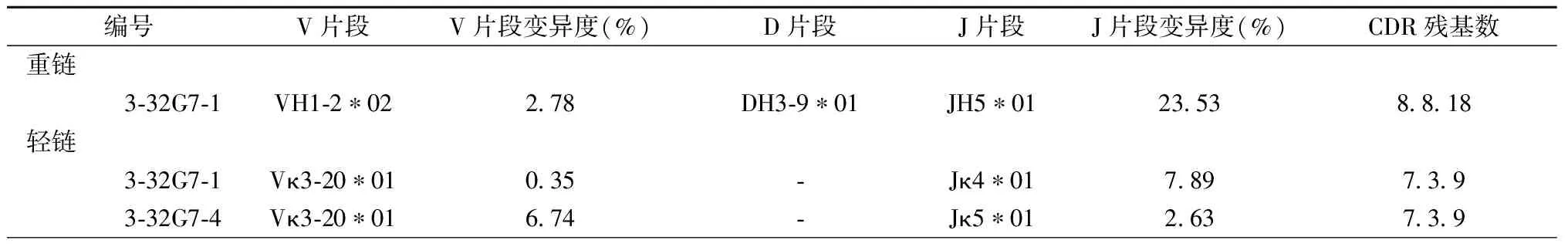
表1 3-32G7克隆孔抗体基因信息
注:“-”表示没有此片段
Note: “-” indicates without this segment
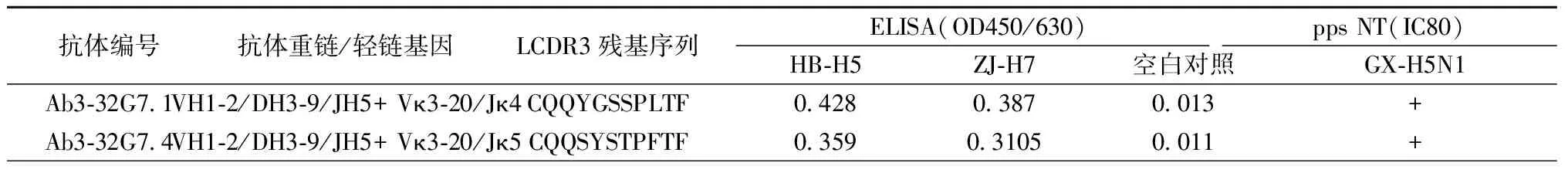
表2 VH1-2编码抗体功能
注:“+”表示抗体具有中和能力
Note: “+” indicates the Abs with neutralizing activity
2.3体外实验证明VH1-2编码抗体可中和H5N1假病毒以轻链3-32G7-1与重链组合进行体外大量表达并纯化获得单抗Ab3-32G7.1。Ab3-32G7.1对HB-H5和ZJ-H7的最低检测浓度为1.87 μg/ml和6.20 μg/ml(图1,以空白对照的10倍为最低检测线)。相较于阴性对照Ab2-11E5(来源于本课题),Ab3-32G7.1可有效地阻断GX-H5N1假病毒对MDCK的感染,最低有效浓度为2.20 μg/ml,但对GD003-H7N9假病毒无中和作用(图2)。
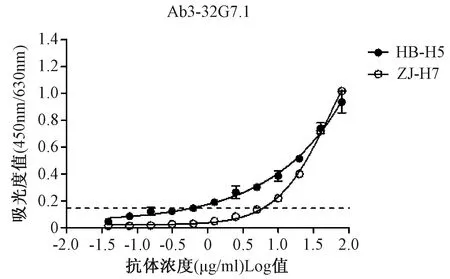
图1 抗体Ab3-32G7.1对HB-H5和ZJ-H7的结合能力Fig.1 Binding capacity of Ab3-32G7.1 to HB-H5 and ZJ-H7

图2 Ab3-32G7.1对GX-H5N1和GD003-H7N9假病毒的中和试验Fig.2 Neutralization test of Ab3-32G7.1 against GX-H5N1 and GD003-H7N9 PPS
2.4Ab3-32G7.1具有一定的广谱结合活性我们使用流式细胞术测定Ab3-32G7.1对自然表达在被感染细胞表面的不同亚型HA的结合能力,发现其可以广谱结合来自于Group1的H1,H5,H6以及H9亚型毒株的HA,但无法结合Group2的HA(图3)。

图3 Ab3-32G7.1对不同亚型HA的结合Fig.3 Binding of Ab3-32G7.1 to group 1HAS
3 讨论
体液免疫在抵抗病毒性感染疾病中起到重要作用。研究发现抗流感的广谱中和抗体常由机体记忆性B细胞或浆母细胞产生,且由某些特定的基因编码,以VH1-69和VH3-30最为常见,如CR6261,F10,CR9114,27F3,FI6等等[5-9,11]。但同时,也存在由出现频率较低的VH基因所编码的高质量抗体,如由VH6-1编码的MEDI8852[10],这帮助我们更全面的认识抗流感病毒免疫的遗传学基础。本研究中,我们筛选到由低频率基因VH1-2所编码的交叉反应性抗体,该抗体可有效结合多种亚型流感病毒的HA,并具有H5N1中和活性。
由VH1-2编码的抗体在HIV-1病毒和流感病毒感染中均有报道[12,14]。Whittle, J. R.等研究人员从疫苗接种者体内筛选到由VH1-2编码的广谱中和抗体:CH65[12]。该抗体靶向HA头部,可以广谱结合H1亚型的不同毒株,其重链基因由VH1-2/DH1-1/JH6组成。相较而言,本研究发现的Ab3-32G7.1由不同的重排方式发育而来,可结合H1,H5,H6,H9及H7亚型。在3-32G7这一克隆孔中,同时存在两种不同的轻链,均可与VH1-2编码的这一重链组合产生功能相似的抗体。因此H5N1病毒感染可快速诱导体内交叉反应性B细胞循环到外周血,从而发挥效应。
流式结果表明,Ab3-32G7.1可广谱结合多种亚型HA,包括H1,H5,H6和H9。然而,ELISA结果显示该抗体也可以结合H7亚型。考虑两种实验结果的差异,我们推断可能因为其识别HA的表位不同。在本研究中,流式分析所用的HA构象处于HA0状态,而ELISA实验所使用HA固定于酶标板底部,由于其结合板底的方位不同可能呈现出不同的表位。这就有可能造成检测结果的差异。本课题后续研究将探索Ab3-32G7.1所靶向的HA表位,及其在不同亚型毒株之间识别构象的差别。Ab3-32G7.1仅对H5亚型病毒具有中和能力可能同其体突变程度相关,具体机制待研究。
本研究从H5N1感染患者发病20 d的外周血中分离到交叉反应性抗体基因并对其功能进行了初步测定。这有助于我们更加深入的了解流感病毒自然感染状态下抗体应答的遗传学特征,以及抗HA广谱抗体的特性,为有效防治流感提供理论基础。
利益冲突:无
参考文献
[1] Bui CM, Chughtai AA, Adam DC, et al. An overview of the epidemiology and emergence of influenza A infection in humans over time[J]. Arch Public Health, 2017, 75: 15. DOI: 10.1186/s13690-017-0182-z.
[2] 郭元吉. 高致病性禽流感研究进展[J]. 中华实验和临床病毒学杂志, 2006, 20(2): 90-93. DOI: 10.3760/cma.j.issn.1003-9279.2006.02.030.
[3] 张烨, 舒跃龙. 2004-2012年我国禽流感流行情况[J]. 中华实验和临床病毒学杂志, 2013, 27(3): 239-240. DOI: 10.3760/cma.j.issn.1003-9279.2013.03.027.
[4] Skehel JJ, Wiley DC. Receptor binding and membrane fusion in virus entry: the influenza hemagglutinin[J]. Annu Rev Biochem, 2000, 69: 531-569. DOI: 10.1146/annurev.biochem.69.1.531.
[5] Throsby M, van den Brink E, Jongeneelen M, et al. Heterosubtypic neutralizing monoclonal antibodies cross-protective against H5N1 and H1N1 recovered from human IgM+ memory B cells[J]. PLoS One, 2008, 3(12): e3942. DOI: 10.1371/journal.pone.0003942.
[6] Sui J, Hwang WC, Perez S, et al. Structural and functional bases for broad-spectrum neutralization of avian and human influenza A viruses[J]. Nat Struct Mol Biol, 2009, 16(3): 265-273.DOI: 10.1038/nsmb.1566.
[7] Corti D, Voss J, Gamblin SJ, et al. A neutralizing antibody selected from plasma cells that binds to group 1 and group 2 influenza A hemagglutinins[J]. Science, 2011, 333(6044): 850-856.DOI: 10.1126/science.1205669.
[8] Dreyfus C, Laursen NS, Kwaks T, et al. Highly conserved protective epitopes on influenza B viruses[J]. Science, 2012, 337(6100): 1343-1348. DOI: 10.1126/science.1222908.
[9] Fu Y, Zhang Z, Sheehan J, et al. A broadly neutralizing anti-influenza antibody reveals ongoing capacity of haemagglutinin-specific memory B cells to evolve[J]. Nat Commun, 2016, 7: 12780. DOI: 10.1038/ncomms12780.
[10] Kallewaard NL, Corti D, Collins PJ, et al. Structure and Function Analysis of an Antibody Recognizing All Influenza A Subtypes[J]. Cell, 2016, 166(3): 596-608.DOI: 10.1016/j.cell.2016.05.073.
[11] Lang S, Xie J, Zhu X, et al. Antibody 27F3 Broadly Targets Influenza A Group 1 and 2 Hemagglutinins through a Further Variation in VH1-69 Antibody Orientation on the HA Stem[J]. Cell Rep, 2017, 20(12): 2935-2943. DOI: 10.1016/j.celrep.2017.08.084.
[12] Whittle JR, Zhang R, Khurana S, et al. Broadly neutralizing human antibody that recognizes the receptor-binding pocket of influenza virus hemagglutinin[J]. Proc Natl Acad Sci USA, 2011, 108(34): 14216-14221. DOI: 10.1073/pnas.1111497108.
[13] Tiller T. Single B cell antibody technologies[J]. N Biotechnol, 2011, 28(5): 453-457.DOI: 10.1016/j.nbt.2011.03.014.
[14] Navis M, Tran K, Bale S, et al. HIV-1 receptor binding site-directed antibodies using a VH1-2 gene segment orthologue are activated by Env trimer immunization[J]. PLoS Pathog, 2014, 10(8): e1004337. DOI: 10.1371/journal.ppat.1004337.
