轮状病毒P[6]基因型毒株LL4260株的VP8*核心区蛋白的表达和纯化
2018-05-23王璐瑶李丹地孙晓曼章青王宏庞立丽胡继宏段招军
王璐瑶 李丹地 孙晓曼 章青 王宏 庞立丽 胡继宏 段招军
730000 兰州,甘肃中医药大学公共卫生学院(王璐瑶、胡继宏); 102206 北京,中国疾病预防控制中心病毒病预防控制所(李丹地、孙晓曼、章青、王宏、庞立丽、段招军)
轮状病毒(Rotaviruses,RVs)是引起5岁以下儿童重症腹泻的主要原因,世界范围内因RV腹泻每年约13 000万婴幼儿到医院就诊,200万例住院,约50万婴幼儿死亡[1]。RV感染严重威胁着人类健康并造成了巨大影响,给公共卫生带来了很大的威胁[2]。
轮状病毒属于呼肠孤病毒科轮状病毒属,其基因组由11个双链RNA节段组成,分别编码6种结构蛋白(VP1~VP4,VP6,VP7)和6种非结构蛋白(NSP1~NSP6)。在病毒侵入细胞过程中,VP4经胰蛋白酶切割后裂解为VP5*和VP8*[3-4],VP5*主要促进病毒进入细胞质。而VP8*是VP4的远端,参与病毒与受体彼此作用,介导病毒作用宿主细胞,因此,VP8*蛋白在病毒感染中具有重要的生物学和免疫学功能[5-6]。而病毒主要依赖于宿主细胞表面的特异性受体的识别来进行感染,因此受体是病毒感染宿主细胞的重要因素[7]。目前发现,仅少数动物RV是唾液酸(sialic acid,SA)敏感型毒株,可以识别细胞表面的唾液酸受体而吸附到宿主细胞上;而许多人类RV的重组VP8*蛋白可以识别人血型组织抗原(histo-blood group antigens,HBGAs)感染宿主[8],HBGAs是一类复合糖,广泛存在于呼吸道、生殖器和消化道的黏膜上皮细胞表面,也以游离低聚糖的形式存在于体液如唾液、肠内容物、乳汁和血液中,可作为某些病原微生物的糖类受体被识别,与一些感染性疾病的易感性有关[9-10]。HBGAs作为RV结合受体的发现是轮状病毒研究领域的重大突破,通过RV 与HBGAs相互作用的研究将有助于了解RV的宿主适应性及病毒进化和流行的规律。虽然已有研究显示通过寡糖和唾液结合实验,部分P[4]、P[6]、P[8]型RV的VP8*可与HBGAs结合,且不同P基因型的RV识别的HBGAs抗原也不尽相同[11],因此,这表明HBGAs-RV之间的结合模式以及各基因型结合的特异性还有待于进一步的研究。为研究其受体结合特性,本研究通过P[6]基因型轮状病毒株LL4260毒株VP8*蛋白在大肠埃希菌系统中的表达,为进一步研究受体结合共性以及结构特点提供基础。
1 材料与方法
1.1实验材料卡那霉素购自美国Sigma公司;限制性内切酶Xho I和Nde I、cutsmart、DNA marker、T4连接酶购买于TaKaRa公司;克隆载体pET30α为本实验保存;感受态细胞购置于自天根生物公司;LL4260毒株VP8*全长基因质粒为本实验室保存;HistrapH和superdex20010/300GL纯化柱购自GE Heahhcare公司。
1.2实验方法
1.2.1 引物合成:LL4260全长基因用核心区引物NdeI(5′-GGAATTCCATATGGTGTTGGATGGACC-3′)和XhoI(5′-CCGCTCGAGTAATCCATTATTTACGTATTC-3′)扩增LL4260 VP8*核心区片段。
1.2.2 克隆构建:将PCR扩增的核心区片段用限制性内切酶NdeI、XhoI进行双酶切后与用同样酶双酶切的pET30a载体16 ℃连接过夜,而后转入DH5α感受态细胞,37 ℃过夜,挑单克隆摇菌后进行质粒提取,质粒送天一辉远公司测序,序列正确的质粒保留备用。
1.2.3 蛋白表达和纯化:阳性质粒转化BL21感受态中,过夜(37 ℃),挑取单克隆到含有卡那霉素的LB瓶中过夜震荡,取15 ml转接到1.5 L 的含卡那霉素的LB培养基中以温度37 ℃、离心力180 g中培养约3.5 h,使OD600到达0.637,将温度调整到22 ℃,加IPTG(使得终浓度达0.4 mmol/L),以22 ℃,150 g诱导培养过夜。第2天收菌,1xPBS重悬,冰浴用80%功率超声,再将超声后的破碎液用高速离心机(13 000×g,4 ℃)离心60 min,得到的上清即为可溶性表达的VP8蛋白。收集上清用滤膜过滤后过HistrapHP柱,用滤膜过滤过的H2O、PBS、20 mmol/L咪唑、50 mmol/L咪唑、300 mmol/L咪唑缓冲液各冲洗30 ml。用各浓度的洗脱液进行聚丙烯酰氨凝胶(SDS—PAGE)电泳,经过考马斯亮蓝染色与水煮脱色。可以检测出所需要的蛋白的目的条带。
1.2.4 分子筛层析:将鉴定好的目的蛋白用超速离心管按照3000×g离心浓缩到1.0 ml左右,吸出备用;先用已过滤好的水平衡superdex 200 s柱子,再用20/50(20 mmol/L Tris和50 mmol/L NaCl,pH=8.0)的缓冲液均衡一个柱体积。将浓缩的样品用上样环上样后进行分子筛层析,根据UV280 nm的吸收值收集样品,根据所得的峰值以及收集得到样品的SDS-PAGE电泳结果来分析蛋白。
2 结果
2.1基因扩增和克隆构建利用核心区引物PCR扩增得到LL4260 VP8*core基因片段500 bp)。通过酶切连接,构建得到pET30 a-LL4260VP8*core克隆,挑取单克隆提取质粒送测序,测序正确后保留备用。
2.2蛋白表达重组质粒pET30 a-LL4260VP8*core转化BL21感受态细胞。经IPTG诱导表达蛋白。通过HistrapHP柱进行亲和层析,并用不同浓度的咪唑洗脱液洗蛋白。结果表明通过50和300 mmol/L咪唑均可洗脱得到目的蛋白,但是300 mmol/L洗脱的纯度较高,而50 mmol/L的量较大。如图1所示。
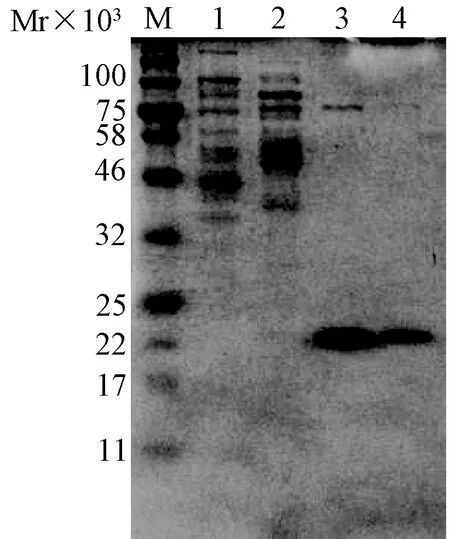
图1 LL4260 VP8*核心区蛋白纯化1、2、3和4分别是PBS、20 mmol/L、50 mmol/L、300 mmol/L咪唑洗脱的样品Fig.1 The purification of LL4260 VP8*core proteins.1,2,3 and 4 refer to the elution of PBS,20 mmol/L,50 mmol/L and 300 mmol/L imidazole buffer
2.3蛋白纯化蛋白在超滤管浓缩后,通过superdex20010/300GL柱进行分子筛,从而进一步进行蛋白纯化,结果显示蛋白在大约18 ml左右开始出峰,而SDS-PAGE显示蛋白相对分子质量为22×103左右,纯度可达到85%以上,如图2所示。
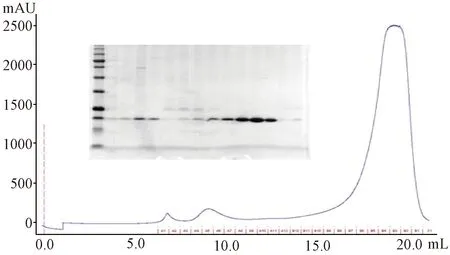
图2 LL4260 VP8*核心区蛋白分子筛层析结果:图中横轴代表样品出峰的位置(单位为ml),纵轴代表样品在280 nm处的UV吸收值Fig.2 The gel filtration results of pET30 a-LL4260VP8*core proteins. The horizontal axis refers to the position of the protein peak (the unit is milliliter). The vertical axis refers to the absorbance at UV 280 nm
3 讨论
轮状病毒引起的急性肠胃炎是儿童腹泻中高致病率的重要病因,目前缺乏有效的治疗措施,疫苗是控制轮状病毒感染的唯一有效措施。VP8*蛋白是病毒吸附进入宿主细胞的功能性蛋白,在病毒与宿主细胞互相作用中起重要作用。感染人的最常见VP4*基因型为P[4]、P[6]、P[8],3个主要P基因型占所有轮状病毒的99%[12]。感染猪的最常见VP4*基因型为P[6]、P[7][13]。P[6]基因型轮状病毒毒株首次在美国患腹泻乳猪的肠内容物中被发现,随后发现P[6]基因型逐渐成为猪轮状病毒的最主要流行株[14]。而P[6]基因型人轮状病毒最初发现于无症状感染的新生儿[15],随后很快成为人类轮状病毒感染的一个主要流行基因型[16]。目前研究发现大量人猪重配或重组毒株与P[6]基因型轮状病毒相关。
HBGAs是通过糖基转移酶识别其前体糖链并渐渐添加单糖而合成的糖复合物[17]。不同血型的个体可以感染不同P型RV,人类HBGAs的遗传多样性及RV基因型的多样性可能导致RV易感性的差异。而RV流行的最主要基因型P[4]、P[6]和P[8]与HBGAs结合的结构和功能基础还不清楚[11]。本研究选取的是人P[6]基因型轮状病毒LL4260毒株,通过对其VP8*基因克隆和蛋白表达得到VP8*核心区的蛋白。
本研究选择载体pET30a,仅在下游引物中加入终止密码子和6个组氨酸(his标签),利用his标签进行蛋白纯化,所表达纯化的蛋白仅在C端多了6个组氨酸,避免因氨基酸引入干扰蛋白功能和结晶。可溶于上清的表达蛋白通过与纯化柱结合,先用低浓度的咪唑溶液去除杂蛋白,再用高浓度的咪唑洗脱液洗下目的蛋白。本研究选择P[6]基因型轮状病毒LL4260毒株VP8*核心区进行pET30 a-LL4260VP8*core蛋白的表达,利用分子筛层析进行蛋白纯化,SDS-PAGE电泳显示目的蛋白纯度较好,相对分子质量为22×103。可直接用于受体结合等功能研究及蛋白结晶结构研究。
综上,本研究构建了P[6]基因型轮状病毒LL4260毒株VP8*核心区的pET30 a-LL4260VP8*core重组质粒,表达纯化得到相应核心区目的蛋白,为进一步的功能学研究和晶体结构学研究打下基础,也将为RV新型疫苗和药物研制及预防控制手段和策略的实施提供参考。
利益冲突:无
参考文献
[1] Tate JE, Burton AH, Boschi-Pinto C, et al. 2008 estimate of worldwide rotavirus-associated mortality in children younger than 5 years before the introduction of universal rotavirus vaccination programmes: a systematic review and meta-analysis[J]. Lancet Infect Dis, 2012,12(2):136-141. DOI: 10.1016/S1473-3099(11)70253-5.
[2] Clarke M, Marshall H. Rotavirus vaccination for prevention of serious acute gastroenteritis and the importance of postlicensure safety monitoring[J]. J Infect Dis, 2012,206(1):3-5. DOI: 10.1093/infdis/jis318.
[3] Settembre EC, Chen JZ, Dormitzer PR, et al. Atomic model of an infectious rotavirus particle[J]. EMBO J, 2011,30(2):408-416. DOI: 10.1038/emboj.2010.322.
[4] Padilla-Noriega L, Dunn SJ, López S, et al. Identification of two independent neutralization domains on the VP4 trypsin cleavage products VP5*and VP8*of human rotavirus ST3[J]. Virology, 1995,206(1):148-154.
[5] Fiore L, Greenberg HB, Mackow ER. The VP8 fragment of VP4 is the rhesus rotavirus hemagglutinin[J]. Virology, 1991,181(2):553-563.
[6] 李丹地,孙晓曼,段招军. 轮状病毒与人类组织血型抗原相关性的研究进展[J]. 病毒学报,2015,31(4):463-467.
[7] Isa P, Arias CF, López S. Role of sialic acids in rotavirus infection[J]. Glycoconj J, 2006,23(1-2):27-37. DOI: 10.1007/s10719-006-5435-y.
[8] Huang P, Xia M, Tan M, et al. Spike protein VP8*of human rotavirus recognizes histo-blood group antigens in a type-specific manner[J]. J Virol, 2012,86(9):4833-4843. DOI: 10.1128/JVI.05507-11.
[9] Ravn V, Dabelsteen E. Tissue distribution of histo-blood group antigens[J]. APMIS, 2000,108(1):1-28.
[10] Marionneau S, Cailleau-Thomas A, Rocher J, et al. ABH and Lewis histo-blood group antigens, a model for the meaning of oligosaccharide diversity in the face of a changing world[J]. Biochimie, 2001, 83(7):565-573.
[11] 郭妮君, 孙晓曼, 曹友德,等. 组织血型抗原:轮状病毒可能的潜在受体[J]. 中国科学:生命科学, 2015, 45(5):419-424.
[12] Komoto S, Wandera AE, Shah M, et al. Whole genomic analysis of human G12P[6] and G12P[8] rotavirus strains that have emerged in Kenya: identification of porcine-like NSP4 genes[J]. Infect Genet Evol, 2014,27:277-293. DOI: 10.1016/j.meegid.2014.08.002.
[13] Matthijnssens J, Ciarlet M, Heiman E, et al. Full genome-based classification of rotaviruses reveals a common origin between human Wa-Like and porcine rotavirus strains and human DS-1-like and bovine rotavirus strains[J]. J Virol, 2008,82(7):3204-3219. DOI: 10.1128/JVI.02257-07.
[14] Lorenzetti E, da SMTN, Alfieri AF, et al. Genetic heterogeneity of wild-type G4P[6] porcine rotavirus strains detected in a diarrhea outbreak in a regularly vaccinated pig herd[J]. Vet Microbiol, 2011,154(1-2):191-196. DOI: 10.1016/j.vetmic.2011.06.026.
[15] Gorziglia M, Green K, Nishikawa K, et al. Sequence of the fourth gene of human rotaviruses recovered from asymptomatic or symptomatic infections[J]. J Virol, 1988,62(8):2978-2984.
[16] Matthijnssens J, Heylen E, Zeller M, et al. Phylodynamic analyses of rotavirus genotypes G9 and G12 underscore their potential for swift global spread[J]. Mol Biol Evol, 2010,27(10):2431-2436. DOI: 10.1093/molbev/msq137.
[17] Liu Y, Huang P, Tan M, et al. Rotavirus VP8*: phylogeny, host range, and interaction with histo-blood group antigens[J]. J Virol, 2012,86(18):9899-9910. DOI: 10.1128/JVI.00979-12.
