提取技术对粗毛纤孔菌三萜类化合物制备及体外降血脂作用的影响
2018-05-23李德海杜令娟顾嘉林王占斌
李德海,杜令娟,康 宁,顾嘉林,王占斌*
(东北林业大学林学院,黑龙江 哈尔滨 150040)
据统计,高血脂症导致冠心病、动脉粥样硬化等心脑血管疾病患者的死亡率大幅度升高[1]。目前临床上治疗高血脂症主要以辛伐他汀为主,但长期服用会有损害肝肾等副作用[2]。因此,开发有效调节血脂的天然功能性成分成为关注热点。研究表明三萜类化合物有较好的降血脂作用,是一类重要的天然产物化学成分,符合多种天然产物的特点,具有广泛的开发和应用前景[3]。
粗毛纤孔菌(Inonotus hispidus)又名粗毛黄褐孔菌,属于绣革孔菌科,纤毛孔菌属,主要分布于辽宁、吉林、黑龙江、内蒙古、北京、山东、宁夏和新疆等北温带地区[4]。粗毛纤孔菌作为药用真菌,在民间主要用于治疗消化不良引起的胃病、高血压、高血脂、各种癌症、糖尿病、便秘、痛风和关节炎等疾病[5]。三萜类化合物是粗毛纤孔菌中一类重要的活性物质,具有抗病毒、抗炎、抗菌、抗癌、溶血、降低血糖血脂等多种生物学作用[6],因此开发粗毛纤孔菌功能性成分尤其是三萜类化合物尤为重要。目前,关于粗毛纤孔菌三萜类化合物(triterpenoids from Inonotus hispidus,IHT)的提取技术主要以溶剂回流法为主,此提取方法的耗时长、效率低,超声波、高剪切、半仿生和双水相萃取是近年来备受关注的提取技术,不仅在一定程度上提高了IHT提取效率,还具有高效节能等优点[7]。现如今,对于不同提取技术与三萜类化合物提取及功能性之间关系研究还鲜有报道。本实验以粗毛纤孔菌菌丝体为原料,体外模拟生物体内环境,研究不同提取技术对IHT提取效果和降血脂活性的影响,以探寻最大程度保留IHT降血脂活性的处理手段,为选择IHT高效提取技术及开发新型降血脂药物提供理论依据。
1 材料与方法
1.1 材料与试剂
粗毛纤孔菌由东北林业大学林学院森林保护实验室提供。
牛磺胆酸钠、甘氨胆酸钠、胆酸钠 上海金穗生物科技有限公司;胰蛋白酶、胃蛋白酶 美国Biotopped公司;盐酸、硫酸、无水乙醇等试剂均为国产分析纯。
1.2 仪器与设备
TGL-16G台式离心机 上海安亭科学仪器厂;722s紫外分光光度计 上海第三分析仪器厂;JA2003分析天平 上海良平仪器仪表有限公司;DK-8D电热恒温水槽 上海森信实验仪器有限责任公司;RE-52旋转蒸发器 上海亚荣生化仪器公司;KQ-500DE型数控超声波清洗器 昆山市超声仪器有限公司;FLUKO高剪切乳化机 上海弗鲁克流体机械制造有限公司;Nicolet 6700傅里叶变换红外光谱仪 美国Thermo Fisher Scientific公司;JSM-7500F扫描电镜 日本电子株式会社。
1.3 方法
1.3.1 原料的预处理
根据徐云红等[8]的方法,将活化后的菌丝块接种到液体培养基中发酵培养,发酵条件为3 块菌丝块,pH值为6,装液量为100 mL/250 mL三角瓶,转速为100 r/min,25 ℃条件下培养7 d,过滤培养液,菌丝体烘干,粉碎,过筛,得粗毛纤孔菌菌丝体粉末,低温保藏备用。
1.3.2 IHT的制备
准确称取粗毛纤孔菌菌丝体干粉,分别通过用95%乙醇溶液提取的溶剂回流技术[9]、超声波辅助技术[10]、双水相萃取技术[11]、半仿生技术[12]、高剪切辅助技术[13],制备粗毛纤孔菌提取物,即为IHT粗提液,抽滤,减压浓缩,50 ℃烘干,得IHT干粉,低温保藏备用。
1.3.3 IHT提取率的测定
1.3.3.1 香草醛-冰乙酸法标准曲线的绘制
根据参考文献[14],略作修改。分别取100 μg/mL标准溶液0.10、0.20、0.40、0.60、0.80、1.00 mL,置于5 mL容量瓶中,100 ℃水浴蒸干,加入0.20 mL新制的5%香草醛-冰乙酸溶液和0.80 mL高氯酸,摇匀,70 ℃水浴反应15 min,常温放置3 min,乙酸乙酯定容,551 nm波长处比色测定,绘制标准曲线,得回归方程为Y=0.012 58X+0.010 36(R2=0.999 2)。
1.3.3.2 提取率的测定
分别称取1.3.2节中不同提取技术IHT干粉各50 mg,以体积分数95%乙醇溶液复溶于100 mL的容量瓶内,按标准曲线的制备方法测定吸光度,并以如下公式计算IHT的提取率:
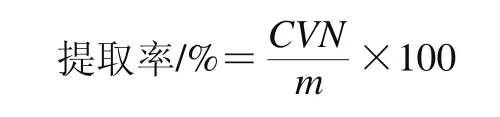
式中:C为提取液中IHT质量浓度/(mg/mL);V为提取液定容体积/mL;N为提取液的稀释倍数;m为粗毛纤孔菌菌丝体质量/mg。
1.3.4 粗毛纤孔菌提取物中活性成分含量的测定
1.3.4.1 IHT含量的测定
参照1.3.3节方法测定。
1.3.4.2 多糖含量的测定
参照Dubois等[15]的苯酚-硫酸法,配制质量浓度为0.1 mg/mL的多糖溶液,60 ℃溶解待用。溶液中加入5%苯酚溶液后旋涡振荡,加入浓硫酸溶液,充分旋涡振荡,室温反应20 min后在490 nm波长处测定吸光度。选择葡萄糖为标准品,将样品吸光度带入标准曲线计算出样品中多糖含量。
1.3.4.3 多酚含量的测定
参照董彩文等[16]福林-酚法,吸取1 mL样液于10 mL容量瓶中,分别加入福林-酚试剂5 mL,充分振荡后静置4 min,加入75%碳酸钠溶液4 mL,蒸馏水定容,摇匀,室温避光放置1 h,测定765 nm处的吸光度,以没食子酸为标准品对照,测定粗毛纤孔菌提取物中多酚成分的含量。
1.3.4.4 黄酮含量的测定
参照王宇等[17]硝酸铝法,吸取0.5 mL样液,加入2 mL离心管中,加5%亚硝酸钠溶液0.1 mL,摇匀放置5 min,再加10%硝酸铝溶液0.1 mL,摇匀放置6 min,加4%氢氧化钠溶液1 mL,摇匀放置5 min,60%乙醇溶液定容,510 nm波长处比色测定。以芦丁为标准品对照,测定粗毛纤孔菌提取物中黄酮成分的含量。
1.3.4.5 蛋白质含量的测定
参照Lowry法(福林-酚法)[18],使用蛋白质定量试剂盒,样液配制成质量浓度为0.1 mg/mL溶液,60 ℃溶解待用。溶液加入试剂A,充分旋涡振荡,室温反应10 min。加入试剂B,充分旋涡振荡,室温反应15 min后在750 nm波长处测定吸光度。选择牛血清白蛋白为标准品,将样品吸光度带入标准曲线计算出样品中蛋白质含量。
1.3.5 IHT体外降血脂作用的测定
降血脂药物的降血脂原理之一是能够与胆酸盐和胆固醇结合,从而阻止胆酸或胆固醇被肠道吸收影响其肝肠循环,使胆酸盐排出体外,促使肝脏中胆固醇不断转化为胆酸盐,从而降低体内胆固醇含量,起到降血脂作用。因此体外降血脂作用原理是通过体外模拟人体内肠道环境,待测药物与胆酸盐相结合产生沉淀,根据结合量的多少初步衡量待测药物的降血脂能力。
1.3.5.1 胆酸盐标准曲线的绘制
参照文献[19]方法测定,略作修改。分别取不同质量浓度标准样液2 mL于具塞试管中,加入6 mL质量分数60%的硫酸溶液,70 ℃水浴20 min,冰浴5 min,在波长387 nm处测定吸光度,绘制标准曲线。
1.3.5.2 胆酸盐结合能力的测定
参照文献[20],略作修改。分别移取1 mL不同提取技术IHT提取液于100 mL具塞三角瓶中,加入1 mL 10 mg/mL胃蛋白酶(以pH 6.3的0.1 mol/L磷酸缓冲液配制)、3 mL 0.01 mol/L的HCl溶液,模拟胃环境,在37 ℃恒温振荡消化1 h;以0.1 mol/L的氢氧化钠溶液调节pH值至6.3,随后加入4 mL 10 mg/mL胰蛋白酶(以pH 6.3的0.1 mol/L磷酸缓冲液配制),在37 ℃恒温振荡消化1 h,模拟肠道环境进行消化。每个样品分别加入4 mL 1 mmol/L甘氨胆酸钠、牛磺胆酸钠和胆酸钠(以pH 6.3的0.1 mol/L磷酸缓冲液配制),在37 ℃恒温振荡1 h后混合物移至离心管中,4 000 r/min离心20 min,对上清液中的胆酸盐进行分析。
1.3.6 不同提取技术IHT的红外光谱分析
采用KBr压片法。取100 mg干燥KBr粉末研细,加入三萜样品混合研细,压成透明薄片。Vector22型红外光谱仪在4 000~400 cm-1波数范围内进行测定。红外光谱仪测定参数:分辨率4.0 cm-1;背景扫描次数32 次;检测器为氖化硫三肽。
1.4 数据分析
实验中的数据均平行测定3 次,以 ±s表示。数据均用Excel 2010、Origin 8.0和SPSS 17.0等软件处理完成。
2 结果与分析
2.1 粗毛纤孔菌提取物中活性成分分析
为明确粗毛纤孔菌提取物中活性成分种类和含量的差异,本实验测定不同提取技术粗毛纤孔菌提取物中活性成分含量,结果见表1。

表1 不同提取技术粗毛纤孔菌提取物中活性成分含量分析Table 1 Effect of different extraction techniques on the contents of bioactive compounds from I. hispidus%
由表1可知,不同提取技术得到粗毛纤孔菌提取物中各活性成分含量存在显著性差异(P<0.05),5种提取技术粗毛纤孔菌提取物中IHT含量均最高,其次是多糖、蛋白质含量,而黄酮和多酚含量较低。其中高剪切技术IHT质量分数高达(37.78±0.57)%,溶剂回流提取IHT含量最低,质量分数为(24.42±0.34)%。高剪切技术由于转子和定子之间的高速运转,形成强烈的高剪切力使粗毛纤孔菌菌丝体组织细胞发生裂解,加速细胞内IHT等活性成分的溶出[21]。由此可以看出,5种提取技术粗毛纤孔菌提取物中三萜、多糖及蛋白质是主要的活性成分,为后续活性成分的降血脂作用的相关性分析提供依据。
2.2 不同提取技术IHT红外光谱分析
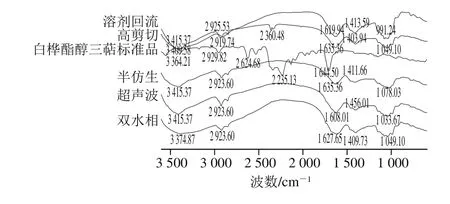
图1 不同提取技术下IHT红外光谱分析Fig. 1 Infrared spectroscopic analysis of triterpenoids from I. hispidus obtained by different extraction techniques
对比白桦酯醇三萜标准品分析高剪切、双水相、超声波、半仿生、溶剂回流5 种方法提取IHT红外图谱,如图1所示,不同技术提取的IHT在化学结构上存在一定差异,对比三萜标准品红外图谱进行对比分析,5 种不同方法提取的IHT在3 500~3 300 cm-1之间有较宽的吸收峰(3 374.87、3 415.37、3 415.37、3 409.58、3 415.37 cm-1),说明5种IHT有O—H键伸缩振动且可能是分子内缔合,其中以双水相提取的IHT峰形最宽,缔合程度最强;在1 655~1 590 cm-1之间(1627.65、1 635.36、1 635.36、1 619.94、1 608.01 cm-1)存在吸收峰,且双水相提取的IHT的吸收峰最强,这是由于发生N-H变形振动相当于CH2的剪式振动,说明双水相提取的IHT含有更多的N-H基团;在1 465~1 340 cm-1之间(1 409.73、1 403.94、1 411.66、1 413.59、1 456.01 cm-1)吸收峰较密集,为C-H基团的弯曲振动;5种IHT在1 300~1 000 cm-1之间(1 049.10、991.24、1 078.03、1 033.67、1 049.10 cm-1),也出现特征吸收峰,为C—O的伸缩振动,其中高剪切的吸收峰最强;在3 000~2 800 cm-1之间存在C—H伸缩振动,且以高剪切IHT的吸收峰最强,以上C—O、C—H、O—H及N—H基团与三萜标准品所含官能团相一致。说明5种提取技术提取的IHT初步符合三萜类物质的结构特征。
2.3 活性成分对胆酸盐降血脂作用的相关性分析
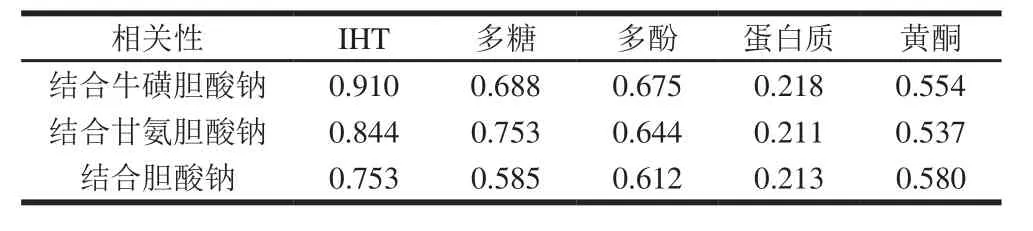
表2 不同活性成分降血脂作用的相关系数Table 2 Correlation analysis between IHT as well as other bioactive compounds and cholate binding capacity
采用统计学手段,对不同活性成分的降血脂效果进行相关性分析。由表2可知,粗毛纤孔菌提取物中不同活性成分与降血脂作用相关性各不相同,不存在显著性差异(P>0.05)。IHT与降血脂作用之间的相关性相对较好(r=0.910,P=0.254),其次是多酚、黄酮及多糖,而蛋白质相关性较差(r=0.218,P=0.426)。此统计学结果进一步证明三萜类化合物、多酚、黄酮及多糖都对胆酸盐有结合能力,具有降血脂效果,而蛋白质的降血脂效果不明显,粗毛纤孔菌提取物中IHT起主要降血脂效果。Yuan等[22]研究表明三萜类物质与降血脂作用具有相关性,因此本研究选用IHT为研究对象,讨论不同提取技术的制备及对其降血脂作用的影响。
2.4 不同提取技术对IHT提取率的影响
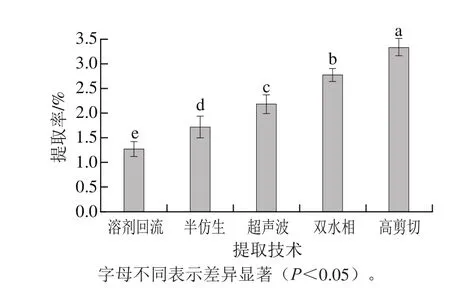
图2 不同提取技术对IHT提取率的影响Fig. 2 Effect of different extraction techniques on the extraction efficiency of triterpenoids
由图2可见,5 种提取技术对IHT化合物提取率影响显著(P<0.05),其中高剪切提取技术提取率最大,其值为(3.33±0.02)%,其次是双水相技术、超声波技术和半仿生技术,而溶剂回流技术提取率最低,其值仅为(1.26±0.05)%。可以看出不同提取技术对IHT的提取因原理不同效果存在显著性差异(P<0.05),高剪切技术由于转子高速旋转产生强烈的剪切力和离心挤压力等机械作用,使粗毛纤孔菌菌丝体组织细胞发生变形,细胞壁破裂,加速细胞内IHT溶出,显著提高了提取效果[23]。而双水相萃取技术也因菌丝体受分子间氢键、电荷相互作用、界面性质等多种作用的影响下,使IHT能快速从浓度差异较大的两相间分离出来,实现增大提取率的目的[24]。
2.5 提取技术对IHT与苷氨胆酸钠结合能力的影响
人体肝脏会合成胆酸类物质,若其在肠道内被其他成分相结合,会加快胆固醇转化胆酸,降低体内胆固醇含量,在体外通过模拟人体胃肠环境进行胆酸结合实验可以初步分析有效成分的降血脂效果。由图3可见,5 种技术提取的IHT结合苷氨胆酸钠的能力呈质量浓度依赖性且具有显著差异性(P<0.05),在质量浓度低于40 mg/mL时,其结合苷氨胆酸钠的能力随着质量浓度的增加而不断增强,在质量浓度为40 mg/mL时,其对甘氨胆酸钠的结合量均达到最高值,后期结合能力变化不显著。当质量浓度为40 mg/mL时,高剪切技术提取的IHT结合苷氨胆酸钠的能力最强(结合量为(0.668±0.03)μmol/100 mg),降血脂功能最显著,其次分别为双水相、超声波、半仿生、溶剂回流技术。说明高剪切技术能促进IHT的溶出,增强在肠道内与苷氨胆酸钠结合效率,促进苷氨胆酸钠在肠肝中的循环,使肝脏中胆固醇快速转化为苷氨胆酸钠,降低体内胆固醇含量,降血脂效果快速显著[25]。

图3 不同提取技术IHT与苷氨胆酸钠结合能力分析Fig. 3 Sodium glycocholate binding ability of triterpenoids obtained by different extraction techniques
2.6 提取技术对IHT与牛磺胆酸钠结合能力的影响
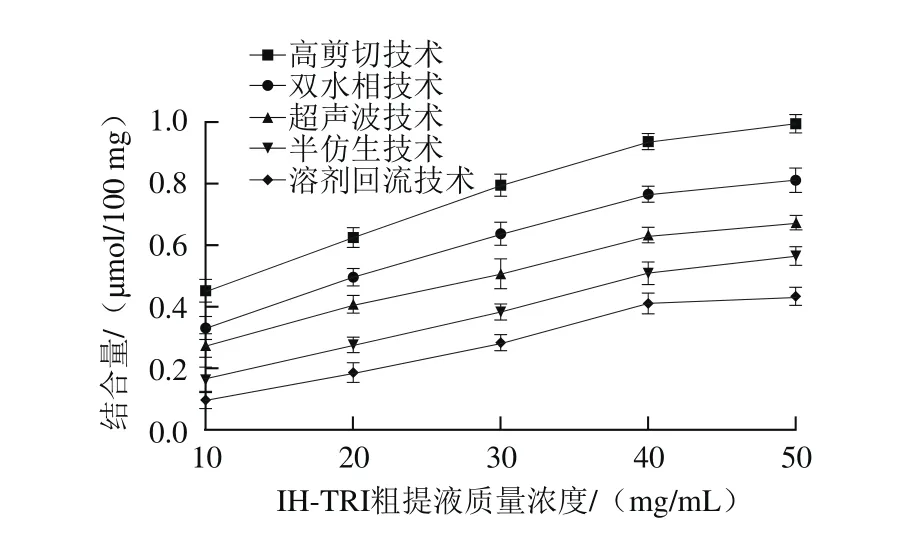
图4 不同提取技术IHT结合牛磺胆酸钠能力分析Fig. 4 Sodium taurocholate binding ability of triterpenoids obtained by different extraction techniques
牛磺胆酸钠是肝内胆固醇衍生而来的物质,其生物合成在保持胆固醇体内平衡的过程中起着重要的作用,同时可在盲肠末端被重吸收从而进入肠肝循环,导致肝脏大量降解胆固醇,起到降血脂作用。由图4可见,5 种技术提取的IHT对牛磺胆酸钠具有一定的结合能力,其结合量和质量浓度之间呈明显的剂量效应关系,随着质量浓度的增加其结合量逐渐上升。不同提取技术IHT对牛磺胆酸钠结合量的影响具有显著性差异(P<0.05),高剪切技术明显优于其他几种提取技术,其对牛磺胆酸钠的结合量在IHT粗提液质量浓度为50 mg/mL时达到最高,为(0.994±0.02)μmol/100 mg,主要是因为牛磺胆酸钠中磺酸基的酸性比胆酸钠和甘氨胆酸钠的羧基更强,在高浓度下更容易离子化,且由于高剪切技术使细胞被迅速破碎,大大减小了有效成分的扩散阻力,IHT被快速释放,结合量明显增强,降血脂效果明显[26]。而溶剂回流技术是利用有机溶剂通过加热回流使菌丝体中的IHT被释放,提取时间越长,IHT含量损失越大,大大降低提取效率,与牛磺胆酸钠的结合量明显降低,降血脂功能明显低于其他几种技术[27]。
2.7 提取技术对IHT与胆酸钠结合能力的影响
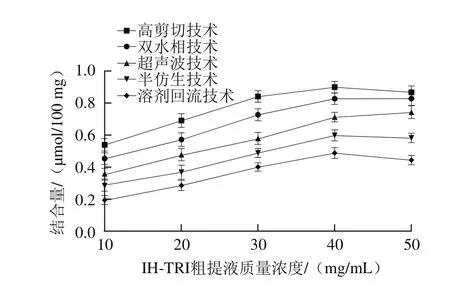
图5 不同提取技术IHT结合胆酸钠能力分析Fig. 5 Sodium cholate binding ability of triterpenoids obtained by different extraction techniques
胆酸钠具有较强的界面活性,能降低油水两相间的表面张力,促进脂类乳化,同时扩大脂肪和脂肪酶的接触面,加速脂类的消化,起到降血脂作用。由图5可见,随着IHT粗提液质量浓度的不同其对胆酸钠的结合能力亦不同,结合量随着IHT粗提液质量浓度增加先增加后下降。5 种技术提取的IHT在质量浓度为40 mg/mL时,均达到最大结合量,当IHT粗提液质量浓度继续升高至50 mg/mL时,结合量呈下降趋势,说明虽然提取方法原理各不相同,但当IHT粗提液质量浓度过高时,都会抑制自身降血脂活性[28]。由图5还可以看出,不同提取技术下提取IHT对胆酸钠结合量的影响具有显著性差异(P<0.05)。其中高剪切技术提取的IHT对胆酸钠的结合量最大,达(0.899±0.02)μmol/100 mg。可能是由于高剪切作用促进了IHT内部结构侧链的断裂和官能团的释放,增大结合效果,有利于胆酸钠结合,降血脂效果明显[29]。而超声波技术由于强烈震动和粉碎作用增强了细胞膜的通透性,使菌丝体中的IHT更易释放到溶剂中,增大与胆酸钠的结合量,降血脂作用有一定的提升效果[30]。
2.8 不同提取技术IHT对降血脂作用的影响
以辛伐他汀片为阳性对照,调整经过树脂初步纯化的IHT质量浓度均为40 mg/mL时,对不同提取技术IHT的降血脂活性进行评价,结果见表3。
从表3可以看出,在相同干物质含量的基础上,作为一种降血脂药物的主要成分,辛伐他汀结合牛磺胆酸钠、胆酸钠、甘氨胆酸钠的能力显著高于其他5 种技术提取的IHT(P<0.05)。
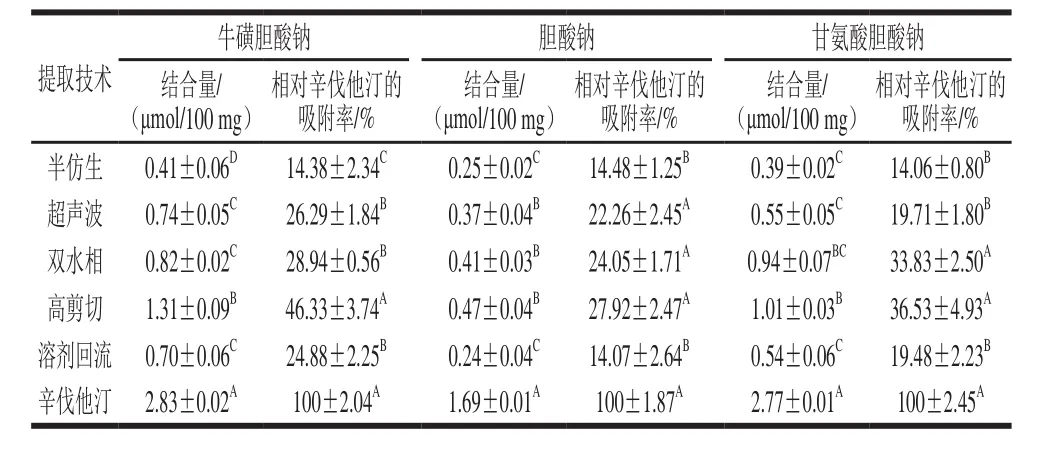
表3 不同提取技术IHT降血脂作用Table 3 Effects of different extraction techniques on the hypolipidemic activity of triterpenoids
高剪切、双水相、超声波技术提取的IHT对胆酸钠结合能力无显著性差异(P>0.05),但是显著高于半仿生和溶剂回流法(P<0.05),其中高剪切提取的IHT结合胆酸钠能力相对辛伐他汀的吸附率为(27.92±2.47)%。但与其他两种胆酸盐的结合量相比,此法结合量仅为(0.47±0.04)μmol/100 mg。Kim等[31]认为这是由于在羟基含量相同时,胆酸钠比其他两种钠盐疏水性要弱,从而不能更好地通过疏水作用力吸附于其他羟基中,导致5 种提取技术IHT降血脂作用均不明显。
半仿生、溶剂回流、超声波技术提取的IHT对苷氨胆酸钠的结合能力无显著性差异(P>0.05),但是显著低于高剪切、双水相技术提取的IHT对苷氨胆酸钠的结合能力(P<0.05),其中高剪切提取的IHT结合苷氨胆酸钠能力相对辛伐他汀的吸附率为(36.53±4.93)%。结合量越高,说明其降胆固醇效果越好,降血脂活性越强,因为结合胆酸盐结合能力越强,胆固醇在肝脏中转化胆汁酸越快,从而达到降低胆固醇、降脂的目的[32]。 这也证明了高剪切提取技术提取的IHT可以通过结合苷氨胆酸钠达到降血脂的作用。
超声波、双水相、溶剂回流技术提取的IH-TR结合牛磺胆酸钠的能力无显著性差异(P>0.05)。高剪切提取的IHT结合牛磺胆酸钠的能力又显著的高于其他提取技术(P<0.05),其相对辛伐他汀的吸附率为(46.33±3.74)%。这可能是由于高剪切力的作用导致IHT结合牛磺胆酸钠的官能团充分暴露出来,增大与牛磺胆酸钠结合机会,从而使结合速度加快,结合能力增强[33],降血脂作用明显。这也初步明了高剪切提取技术提取的IHT结合牛磺胆酸钠能力最强,降血脂的作用最好。
3 结 论
本研究结果表明IHT提取及降血脂效果与不同提取技术有关。5 种技术提取IHT均具有体外降血脂作用,但存在显著性差异,这与IHT含量和结构有关。高剪切技术提取的IHT体外降血脂效果最好,其次是双水相、超声波、溶剂回流、半仿生技术。其中高剪切技术IHT提取率最高,为(3.33±0.02)%;粗毛纤孔菌提取物中IHT质量分数最高,为(37.78±0.57)%。当IHT质量浓度为40 mg/mL时,与牛磺胆酸钠的结合量最高,为(1.31±0.09)μmol/100 mg。高剪切技术提取的IHT特征吸收峰最强,使IHT对降血脂活性相关性高,降血脂效果好。可见高剪切技术可以用于IHT的制备及天然新型降血药物的开发。但关于不同提取技术对三萜类化合物结构的影响而导致其体外降血脂效果不同的具体机制还需要进一步研究。
参考文献:
[1]LIN J, YANG R, TARR P T, et al. Hyperlipidemic effects of dietary saturated fats mediated through PGC-1β coactivation of SREBP[J].Cell, 2005, 120(2): 261-273. DOI:10.1016/j.cell.2004.11.043.
[2]ZHAO L Y, HUANG W, YUAN Q X, et al. Hypolipidaemic effects and mechanisms of the main component of Opuntia dillenii Haw.polysaccharides in high-fat emulsion-induced hyperlipidaemic rats[J]. Food Chemistry, 2012, 134(2): 964-971. DOI:10.1016/j.foodchem.2012.03.001.
[3]潘晴, 孙京海, 马鲁豫. 女贞子中三萜类化合物的提取纯化工艺研究进展[J]. 辽宁中医杂志, 2015(9): 1806-1807. DOI:10.13192/j.issn.1000-1719.2015.09.082.
[4]CUI B K, DAI Y C, YANG H. Notes on the medicinal fungus of Inonotus hispidus[J]. Edible Fungi of China, 2009, 28(4): 6-7.
[5]ZAN L F, QIN J C, ZHANG Y M, et al. CheminformAbstract:antioxidant hispidin derivatives from medicinal mushroom Inonotus hispidus[J]. Cheminform, 2011, 42(48): 770-772. DOI:10.1002/chin.201148207.
[6]BEDNARCZYKCWYNAR B, ZAPRUTKO L. Recent advances in synthesis and biological activity of triterpenic acylated oximes[J].Phytochemistry Reviews, 2015, 14(2): 203-231. DOI:10.1007/s11101-014-9353-5.
[7]徐红云, 王占斌. 响应面优化粗毛纤孔菌三萜提取工艺的研究[J]. 食品工业科技, 2013, 34(23): 228-232. DOI:10.13386/j.issn1002-0306.2013.23.031.
[8]徐红云, 王占斌. 粗毛纤孔菌产三萜液体发酵条件优化[J].食品工业科技, 2012, 33(24): 206-209. DOI:10.13386/j.issn1002-0306.2013.23.031.
[9]程伟, 帕提古丽, 马合木提. 天山花楸不同部位萜类化合物提取工艺研究[J]. 食品科学, 2011, 32(6): 29-31.
[10]王占一, 郑丹丹, 王京龙, 等. 响应面试验优化超声波辅助提取石榴皮中三萜类化合物工艺及动力学分析[J]. 食品科学, 2015, 36(22):11-17. DOI:10.7506/spkx1002-6630-201522003.
[11]赵艳霞, 刘峰, 魏娟娟, 等. 双水相超声法提取桦褐孔菌三萜[J]. 菌物学报, 2014, 33(1): 129-137. DOI:10.13346/j.mycosystema.120250.
[12]赖红芳, 邓秋芬. 半仿生法提取鸡骨草中总三萜酸的工艺优选[J].中国实验方剂学杂志, 2013, 19(24): 46-48. DOI:10.11653/syfj2013240046.
[13]赵玉红, 林洋, 张立钢, 等. 黑木耳多糖高剪切分散乳化法与酶法提取的比较研究[J]. 食品与机械, 2016(4): 181-186. DOI:10.13652/j.issn.1003-5788.2016.04.042.
[14]LI Z, YANG Y, HUANG X, et al. Lotus leaf total triterpenoid extraction technology research and content determination[J].Guangdong Chemical Industry, 2016, 43(9): 110-111.
[15]DUBOIS M, GILLES K A, HAMILTON J K, et al. Colorimetric method for determination of sugars and related substances[J].Analytical Chemistry, 1956, 28(3): 350-356. DOI:10.1021/ac60111a017.
[16]董彩文, 段蒙蒙, 李帅红, 等. 福林-酚比色法测定黄秋葵汁中的总多酚[J]. 食品科技, 2015, 40(4): 352-355. DOI:10.13684/j.cnki.spkj.2015.04.069.
[17]王宇, 王遂. 分光光度法测定落叶松中的总黄酮含量[J]. 食品科学,2009, 30(22): 314-317.
[18]LOWRY O H, ROSEBROUGH N J, FARR A L, et al. Protein measurement with the Folin-phenol reagents[J]. Journal of Biological Chemistry, 1951, 193: 265-275.
[19]刘荣, 王蕾, 栾淑莹, 等. 水溶性黑木耳多糖体外结合胆酸盐能力的分析[J]. 食品工业科技, 2015, 36(17): 358-361. DOI:10.13386/j.issn1002-0306.2015.17.065.
[20]KAHLON T S, SMITH G E. In vitro binding of bile acids by blueberries (Vaccinium spp.), plums (Prunus spp.), prunes (Prunus,spp.), strawberries (Fragaria × ananassa), cherries (Malpighia punicifolia), cranberries (Vaccinium macrocarpon) and apples(Malus sylvestris)[J]. Food Chemistry, 2007, 100(3): 1182-1187.DOI:10.4236/fns.2012.37126.
[21]付元真, 王新新, 王晓, 等. 高速剪切提取金银花11 种活性成分及其抗氧化活性[J]. 食品与发酵工业, 2016, 42(5): 239-245.DOI:10.13995/j.cnki.11-1802/ts.201605042.
[22]YUAN H, GONG Z, MENG S, et al. Hypoglycemic and hypolipidemic effects of a triterpenoid-rich extract from Euryale shell on streptozotocin-induced diabetic mice[J]. Pharmazie, 2013, 68(3):227-231.
[23]刘俊梅, 王丹, 王玉华, 等. 高剪切分散乳化技术SPI溶解特性的影响机制初探[J]. 食品科技, 2014, 39(1): 55-58. DOI:10.13684/j.cnki.spkj.2014.01.011.
[24]ZHEN Y U, CHEN J, ZHOU X L, et al. Advance research in the applications of aqueous two-phase extraction technology[J]. Academic Periodical of Farm Products Processing, 2014, 16(9): 7288-7301.
[25]周小理, 黄琳, 周一鸣. 苦荞水溶性蛋白体外吸附胆酸盐能力的研究[J]. 食品科学, 2011, 32(23): 77-81.
[26]DANUTA G, JOZEF K. Sorption of bile acids and cholesterol by dietary fiber of carrots, cabbage and apples[J]. Food Science and Technology, 2002, 5(2): 148-150. DOI:10.1.1.459.4.177.
[27]逄显娟, 李杰, 段冷昕, 等. 陈皮中橙皮苷的溶剂热法提取工艺及检测方法的研究[J]. 食品工业科技, 2016, 37(18): 267-270.DOI:10.13386/j.issn1002-0306.2016.18.042.
[28]钱俊青, 戴承恩, 李尚谦, 等. 竹叶黄酮降血脂活性研究[J]. 浙江工业大学学报, 2014, 42(5): 496-498.
[29]邓志汇, 黄惠华. 茶鲜叶和茶花水提液对胆酸盐的结合及其降血脂机理的研究[J]. 食品科学, 2011, 32(19): 96-99.
[30]王飞飞, 余芳, 辛志宏, 等. 富硒绿茶功能成分的超声波提取技术及其抗氧化活性研究[J]. 食品科学, 2007, 28(1): 142-147.
[31]KIM C H, HEUNG J C. A synthesis of O-diethylaminoethyl chitosan and its binding ability of cholate and deoxycholate anion in vitro[J].Polymer Bulletin, 1999, 42(1): 25-32. DOI:10.1007/s002890050430.
[32]JIAO R, ZHANG Z S, YU H J, et al. Hypocholesterolemic activity of grape seed proanthocyanidin is mediated by enhancement of bile acid excretion and up-regulation of CYP7A1[J]. Journal of Nutritional Biochemistry, 2010, 21(11): 1134-1139. DOI:10.1016/j.jnutbio.2009.10.07.
[33]胡凯, 黄惠华. 不同茶叶对胆酸盐的结合及其降血脂机理的研究[J].食品与发酵工业, 2010, 36(9): 42-45. DOI:10.13995/j.cnki.11-1802/ts.2010.09.041.
