产酯香功能菌对酱香型酒醅的影响
2018-05-23陈梦圆刘学彬蔡雪梅罗爱民
陈梦圆,刘学彬,汪 平,陈 剑,蔡雪梅,罗爱民,*
(1.四川大学轻纺与食品学院,四川 成都 610064;2.四川茂华食品有限公司,四川 眉山 620038)
酱香型白酒的主要生产工艺是“四高两长”,其中高温堆积和高温发酵是十分重要的过程[1-3]。酒醅在堆积和窖池发酵后产生的香气成分是白酒风味物质的来源[4],对酱香型白酒的品质有重要的影响[5]。
高温堆积时,不仅可以使大曲中的微生物区系在高温环境中向嗜热类群转化并扩大繁衍,同时还能富集环境中的微生物,起到二次制曲的作用[6]。经过高温堆积后,酒醅中微生物的种类有明显的增加,且有各种酶及酒香味前提物质生成,为酒的酱香风味奠定基础[7-8]。但是堆积过程常常受到外部因素如温度、湿度、季节等影响,导致堆积后酒醅的性质表现出不稳定性。在堆积过程中,酒醅中功能微生物具有某些比较突出的功能,能够一定程度上提高酒醅堆积的质量,因此筛选堆积酒醅中有益微生物对高温堆积有十分重要的意义。
高温发酵是酒醅进入窖内密闭发酵,在发酵过程中窖内物质与能量的持续转化使窖内温度逐渐升高,最终形成了一个相对高温的环境,复杂的微生物区系在这样的条件下使各种物质形态也不断地转换,最终形成了酱香型白酒独特的风味[9-10]。
将功能菌株制作成麸曲的形式添加到酒醅中,有利于将功能菌株添加到酒醅中,改变酒醅的微生物结构[11],从而改善酒醅的品质[12]。因此研究酱香型白酒堆积酒醅中功能菌种,在生产过程中对酒醅的影响对改善酱香型白酒的品质有重要意义。
高通量测序技术是研究微生物多样性比较常见的一种方法,具有通量高、速度快、准确度高的特点[13]。在浓香型白酒窖泥、酒醅以及大曲中的微生物群落结构研究应用广泛[14-15],但是目前利用高通量测序技术对酱香型白酒酒醅微生物研究的报道较少。
本研究选用从酱香型白酒堆积酒醅中筛选出的1 株产酯香功能细菌,经鉴定该菌为枯草芽孢杆菌[16]。用麸曲培养该菌,添加到某酱香白酒第5轮次的酒醅中进行高温堆积和窖池发酵,与未添加功能细菌的空白酒醅进行对比,利用高通量测序技术和气相色谱法测定该细菌在实际生产中对酒醅堆积和窖池发酵过程中理化性质、细菌群落结构和香气成分的影响,从而研究该产酯香功能细菌是否能够在实际生产中提高酒醅的产酯能力,改善酒醅的品质,为进一步研究产酯香突出的细菌对酱香型白酒品质的影响提供理论支持。
1 材料与方法
1.1 材料与试剂
高温大曲由某酱香型酒厂提供。
0.1、0.05 mol/L的氢氧化钠溶液、20%氢氧化钠溶液、斐林试剂、0.1%葡萄糖溶液、中性甲醛溶液、80%盐酸溶液、氯化钙、碘液、乙酸正戊酯、2-乙基丁酸、叔戊醇均为国产分析纯;DNA提取试剂盒 成都福际生物技术有限公司。
1.2 仪器与设备
78HW-1型恒温磁力搅拌器 金坛市金怡仪器厂;MJ-250型恒温培养箱 上海一恒科学仪器有限公司;PHS-3C型酸度计 杭州奥力龙仪器有限公司;WH-2型微型旋涡混合仪 上海沪西分析仪器厂有限公司;TW-200W型可控温电炉 成都川西行工贸有限公司;7890A自动进样气相色谱仪 美国安捷伦科技有限公司;5810R台式冷冻离心机 德国Eppendorf公司;2720 thermal cycler聚合酶链式反应(polymerase chain reaction,PCR)仪 上海赛默生物科技有限公司;DYCP-31 DNA电泳槽、DYY-5稳压电泳仪 北京六一仪器厂;FR980凝胶成像仪 上海复日科技仪器有限公司。
1.3 方法
1.3.1 实验处理
按照文献[17]的方法制作产酯香功能细菌麸曲,培养条件为:接种量2%,37 ℃培养72 h,测出其酯化力为33.6 U。第5轮次操作工艺流程如下:

将产酯香功能细菌麸曲按千分之一的比例,添加到某酱香型白酒生产车间的第5轮次酒醅中进行堆积和窖池发酵,堆积时间为78 h,发酵时间为35 d。空白组不添加细菌麸曲,加菌组和空白组都按照相同的酿酒工艺操作。
取样:酒醅堆积结束后,移堆破位混匀,发酵结束后整体出窖混匀,然后分别在不同方位取样,混匀后取3 份平行分析。
1.3.2 产酯功能细菌对酒醅理化性质的影响
按照文献[18]的方法,分别测定堆积和发酵后酒醅中的水分、酸度、残糖、氨基态氮、淀粉含量及蛋白酶活力。
每50 g样品在35 ℃经过7 d催化己酸和乙醇合成己酸乙酯的毫克数为一个单位的酯化力(U)。测定方法[18]:称取25 g绝干样品,加入1.5 mL己酸、25 mL无水乙醇、75 mL蒸馏水置于35 ℃恒温酯化7 d,然后用50 mL乙醇洗涤样品,蒸馏洗涤液和试样溶液,收集50 mL馏出液。在馏出液中加2 滴酚酞,用氢氧化钠标准溶液中和,记录消耗的体积。再加入25 mL氢氧化钠标准溶液,沸水浴回流0.5 h,用硫酸标准溶液进行反滴定,微红色刚好消失为其终点,记录消耗硫酸标准溶液的体积。
1.3.3 产酯功能细菌对酒醅细菌群落结构的影响
酒醅总DNA的提取与测序:采用福际土壤基因组DNA提取试剂盒,提取酒醅中微生物的总DNA,置于-20 ℃备用。PCR扩增以338F(5’-ACTCCTACGGGAGGCAGCA-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)为引物[19]。20 μL反应体系:模板0.5 μL;10×buffer 2.54 μL;2.5 mmol/L的dNTP 1 μL;2×Taq DNA聚合酶0.2 μL;10 μmol/L的前引物27F 0.5 μL;10 μmol/L的后引物1492R 0.5 μL;ddH2O补至25 μL。反应参数: 95 ℃ 3 min;95 ℃ 30 s,50 ℃ 30 s,72 ℃ 40 s,25 个循环;72 ℃ 7 min;10 ℃保存。每个样取4 μL用1%琼脂糖凝胶电泳检测PCR产物,使用SanPrep柱式胶回收试剂盒切胶回收PCR产物,Tris HCl洗脱。然后委托百迈克生物科技有限公司Illumina Miseq测序平台进行基因组检测和测序。
1.3.4 产酯功能细菌对酒醅香气成分的影响
样品的预处理:取25 g 3 份平行样品放入三角瓶中,分别加入1%无水氯化钙和50 mL 57%乙醇溶液,浸泡摇匀,在25 ℃条件下经超声波浸提后1 h后,10 000 r/min离心10 min提取上清液,用0.22 μm滤膜进行真空抽滤,将3 份平行滤液综合混匀,得到待测样品。
香气成分测定:处理后的滤液用气相色谱分析法,采用内标法定量分析。
内标液:17.54 mg/100 mL的乙酸正戊酯、18.15 mg/100 mL的2-乙基丁酸和15.8 mg/100 mL的叔戊醇。
色谱条件:色谱柱,ZB-Waxplux毛细柱(60 m×0.25 mm,0.25 μm);升温程序:40 ℃保持1 min,以4 ℃/min升至150 ℃,保持10 min,再以10 ℃/min升至210 ℃,保持18 min,最后以20 ℃/min升至230 ℃,保持5 min;载气(N2)流速1 mL/min,分流比20∶1。
1.4 数据分析
采用SPSS 19.0对酒醅理化检测的数据进行方差分析,对酒醅香气成分进行聚类分析以及对酒醅中的细菌群落与香气成分之间进行相关性分析;采用SIMCA-P 11.5对酒醅香气成分进行主成分分析。
2 结果与分析
2.1 产酯功能细菌对酒醅理化性质的影响
酒醅在堆积和窖池发酵过程中,由于原料、微生物和酶系之间的相互作用,会发生各种物理化学反应[20],导致酒醅的理化性质发生变化,从而影响酒醅的质量[21]。添加了产酯香功能细菌的酒醅,由于引入了较多的功能细菌,改变了酒醅中微生物的群落结构,酒醅的理化性质也会随之改变,从而对酒的质量产生影响[20]。

表1 酒醅的理化性质Table 1 Physicochemical properties of fermented grains
表1结果显示,在堆积后的酒醅中,添加了产酯香细菌的酒醅和空白酒醅中的酸度及水分、残糖、淀粉含量之间的改变量较小,但氨基态氮、蛋白酶活力和酯化力加菌组明显比空白高,其中加菌组和空白组酒醅的酯化力分别为8.810、2.560 U。在窖池发酵后酒醅中,加菌组酒醅和空白组酒醅中的酸度及水分、淀粉含量之间的改变量较小,但氨基态氮、残糖含量、蛋白酶活力和酯化力明显比空白高,其中加菌组和空白组酒醅的酯化力分别为18.750、7.150 U。分析可知,产酯香功能细菌在堆积和窖池发酵过程中都能影响酒醅的理化性质,明显提高了酒醅的蛋白酶活力和酯化力。这可能是因为产酯香细菌的加入,改变了酒醅中细菌群落的结构,从而导致酒醅理化性质的变化。
2.2 产酯功能细菌对酒醅细菌群落结构的影响

图1 群落结构组分图Fig. 1 Bacterial community structure and composition
将加菌组堆积后酒醅、空白组堆积后酒醅、加菌组发酵后酒醅、空白组发酵后酒醅4 个样品分别编号为1、2、3、4(下同)。如图1所示,4个酒醅样品中共检测出16 个细菌属,其中1号样品检测到15 个,2号样品14 个,3号样品检测到10 个,4号样品检测到9 个。其中1号样品中占优势的菌群有Bacillus(芽孢杆菌属,66.06%),Kroppenstedtia(克罗彭斯特菌属,8.85%);2号样品中占优势的菌群有Bacillus(59.36%),Kroppenstedtia(16.59%);3号和4号样品中占优势的菌群是Lactobacillus(乳杆菌属),分别占97.76%、97.27%。在堆积后的酒醅中,1号中细菌属种类明显比2号多,在发酵后的酒醅中,3号和4号之间差异较小。
在堆积过程中,添加产酯香细菌后能够使酒醅中的Bacillus明显增加,提高酒醅中属水平上细菌的种类,改变酒醅中细菌群落结构,从而引起酒醅理化性质和香气成分的变化。在窖池发酵后,加菌组和空白组在细菌属水平上种类和含量差异不大,且都是Lactobacillus占绝大部分。这可能是因为窖池发酵是一个密闭的过程,经过长时间的发酵后,氧气几乎被消耗完,许多需氧细菌由于缺氧而死亡,只有厌氧性的少数细菌如乳杆菌属等可以存活,郭坤亮[22]也证明酒醅在发酵过程中细菌数呈下降趋势。分析表明该细菌主要在堆积过程中影响酒醅中的细菌群落结构,从而影响酒醅的质量。
2.3 产酯香功能细菌对酒醅香气成分的影响
用57%的乙醇溶液萃取不同的酒醅样品平行样3 份,离心过滤,综合混匀3 份平行滤液,得到待测样品,并进行气相色谱法的定性和定量分析,香气成分种类和含量见表2。

表2 不同酒醅香气成分及其质量浓度Table 2 Aroma composition of fermented grains mg/100 mL
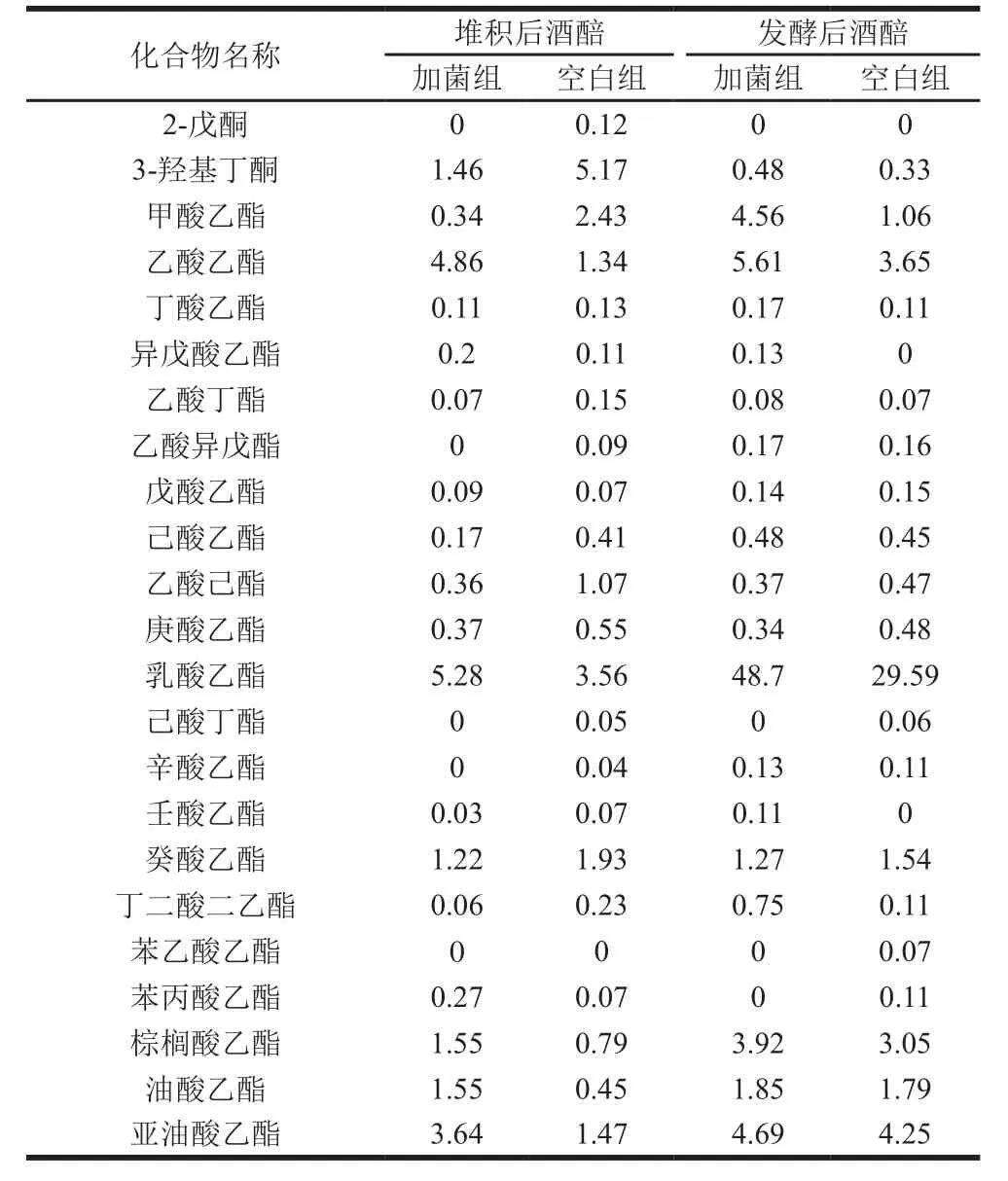
续表2

图2 不同酒醅香气成分的含量Fig. 2 Contents of aroma components in fermented grains after stacking and fermentation
酒醅中挥发性的香气成分通过蒸馏进入到酒中,是酒香味的直接来源,其香气的丰富程度对酒的品质有重要的影响[23]。从酒醅中共检测出64 种香气成分,包括醇类(19 种)、酸类(14 种)、酮类(3 种)、醛类(7 种)、酯类(21 种)。由表2可知,在堆积和窖池发酵期间,添加有功能细菌的酒醅和空白酒醅之间各种香气成分在含量和种类之间明显不同,表明该功能菌改变了酒醅中的香气成分。将表2中的香气成分进行归类比较,能更直观地分析出功能细菌对酒醅香气成分的影响,结果见图2。
2.3.1 产酯香功能细菌对醇类的影响
酒中的醇类物质是发酵过程中微生物对酒醅中糖和氨基酸等成分代谢产生的,有呈香和增加酒甜感的作用,也是形成酯类及香味物质的前体[24]。由表2和图2可知,在堆积后的酒醅中,加菌组酒醅中主要醇类正丙醇、正戊醇、2,3-丁二醇、1,2-丙二醇、1,3-丙二醇比空白低,且醇类质量浓度在加菌组和空白组酒醅中分别为57.84、111.19 mg/100 mL。在窖池发酵后的酒醅中,加菌组酒醅中甲醇、正丙醇、活性戊醇、多元醇的含量明显比空白组高,而且醇类质量浓度在加菌组和空白组酒醅中分别为117.61、92.06 mg/100 mL。
酒醅堆积时是微生物富集的过程[25],添加有产酯香细菌的酒醅,由于细菌群落结构的改变(图1),可能使酒醅中的细菌更多地利用醇类物质生成酯类及其他香味物质,从而导致在堆积过程中强化组中醇类含量比空白组低。在窖池发酵过程中,由于堆积后加菌组和空白组酒醅之间存在差异,再加上发酵过程中由于氧气不足,大部分需氧细菌死亡,从而导致发酵后强化组中醇类含量比空白高,但其具体的影响机制有待后续研究。
2.3.2 产酯香功能细菌对酸类的影响
酸类化合物是伴随着酒精发酵产生的,是酯类的前提物质[26]。由表2可知,酒醅中含量较多的酸是乙酸、丙酸、油酸和亚油酸。由图2可知,在堆积后的酒醅中,加菌组和空白组中酸类质量浓度分别为39.29、73.33 mg/100 mL。在窖池发酵后的酒醅中,加菌组酒醅中主要的酸类乙酸、异戊酸、癸酸、油酸、亚油酸明显比空白高,且加菌组和空白组中酸类质量浓度分别为123.86、102.99 mg/100 mL。这与上述醇类的结果保持一致,表明添加了产酯香细菌在堆积中使酒醅的酸类含量减少,在发酵过程中提高酒醅的酸类含量。
2.3.3 产酯香功能细菌对醛、酮类的影响
酒醅中醛、酮类主要来自于醇类的转化,醇的氧化和脱氢反应均可产生相应的醛和酮[27]。醛、酮的含量虽然很低,但对酒的品质影响很大[28]。由表2可知,酒醅中含量较多的醛、酮类是乙醛、乙缩醛、3-羟基丁酮。由图2可知,在堆积后的酒醅中,加菌组酒醅中的醛、酮类质量浓度比空白组少,分别为6.93、14.97 mg/100 mL。但在窖池发酵后的酒醅中,加菌组酒醅中主要的醛、酮含量比空白组大,而且加菌组酒醅和空白中醛、酮类质量浓度分别为9.28、4.91 mg/100 mL。在堆积后加菌组中比空白组低,而在窖池发酵后加菌组比空白组高,这与上述醇类的结果保持一致。表明产酯香细菌在发酵过程中可以增加酒醅中醛、酮类的含量。
2.3.4 产酯香功能细菌对酯类的影响
酯类是由酸、醇类在微生物和酶的作用下产生或由微生物直接产生的,是白酒中种类和含量最多的挥发性物质[29],也是白酒香味成分中的主体成分和呈香成分[30]。由表2可知,酒醅中含量较多的酯类是乙酸乙酯、乳酸乙酯、癸酸乙酯、棕榈酸乙酯、油酸乙酯、亚油酸乙酯。在堆积后和窖池发酵后的酒醅中,加菌组酒醅中主要的酯类含量明显比空白组高,且由图2可知,酯类质量浓度在堆积和发酵后分别比空白组多5.16、26.19 mg/100 mL。
在堆积过程中,产酯香细菌引入了较多枯草芽孢杆菌,改变了酒醅中细菌群落结构(图1),提高了酒醅中酯类的含量,同时也为后续的发酵过程做准备。在窖池发酵过程中,加菌组酒醅由于前期堆积后空白组之间存在差异,在窖池发酵过程中产生更多酸类、醇类以及醛、酮类,提高酒醅中酯类含量。
2.4 系统聚类分析
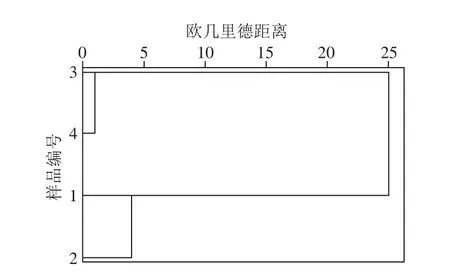
图3 不同酒醅系统聚类分析图Fig. 3 Dendrogram obtained from cluster analysis of aroma components of different samples of fermented grains
为了更系统地分析产酯香功能细菌对酒醅香气成分的影响,将上述64 种香气成分的含量作为变量,使用SPSS 19.0进行系统聚类分析。计算其欧几里德距离,如图3所示,当欧几里德距离小于5时,1、2、3号和4号样本各自归为一类,表明堆积和窖池发酵过程中,该细菌对酒醅的香气成分影响很大。
2.5 主成分分析
为进一步分析不同酒醅之间香气成分的差异,利用SIMCA-P 11.5软件对64 种香气成分的含量进行主成分分析,香气成分变量按表2中次序依次编号1~64。主成分1的方差贡献率为45.64%,主成分2的方差贡献率为34.75%,二者累计方差贡献率已经达到80.39%,基本上能反映样品的香气成分信息,因此选取前2 个主成分进行分析。
由图4a可知,1、2、3、4号根据香气成分的得分明显分为4 个区域,表明1、2号和3、4号在主成分上能分开,香气成分之间存在明显差异。由图4b可知,异丁醇(4)、仲戊醇(5)、庚醇(12)、正己醇(11)、糠醛(40)与主成分2高度正相关,正辛醇(14)、乙酸乙酯(45)、苯丙酸乙酯(61)、油酸乙酯(63)与主成分2高度负相关。乳酸乙酯(54)、 辛酸乙酯(56)、乙酸(20)、棕榈酸乙酯(62)、甲醇(1)与主成分1高度正相关,异戊醇(8)、β-苯乙醇(19)、丙酸(21)、乙缩醛(37)、壬酸(29)与主成分1高度负相关。因子的载荷系数反映了酒醅中各挥发性香气成分对各主成分的影响,相关系数越大,说明主成分对该变量的代表性就越强。
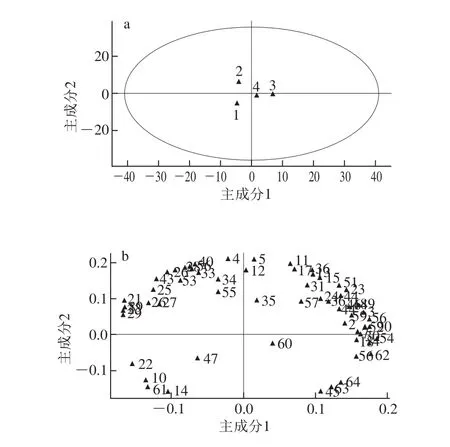
图4 香气成分主成分分析的得分散点图(a)和因子载荷图(b)Fig. 4 Scatter score (a) and corresponding loadings plots (b) from PCA of volatile aroma compounds
2.6 细菌群落结构与香气成分的关系
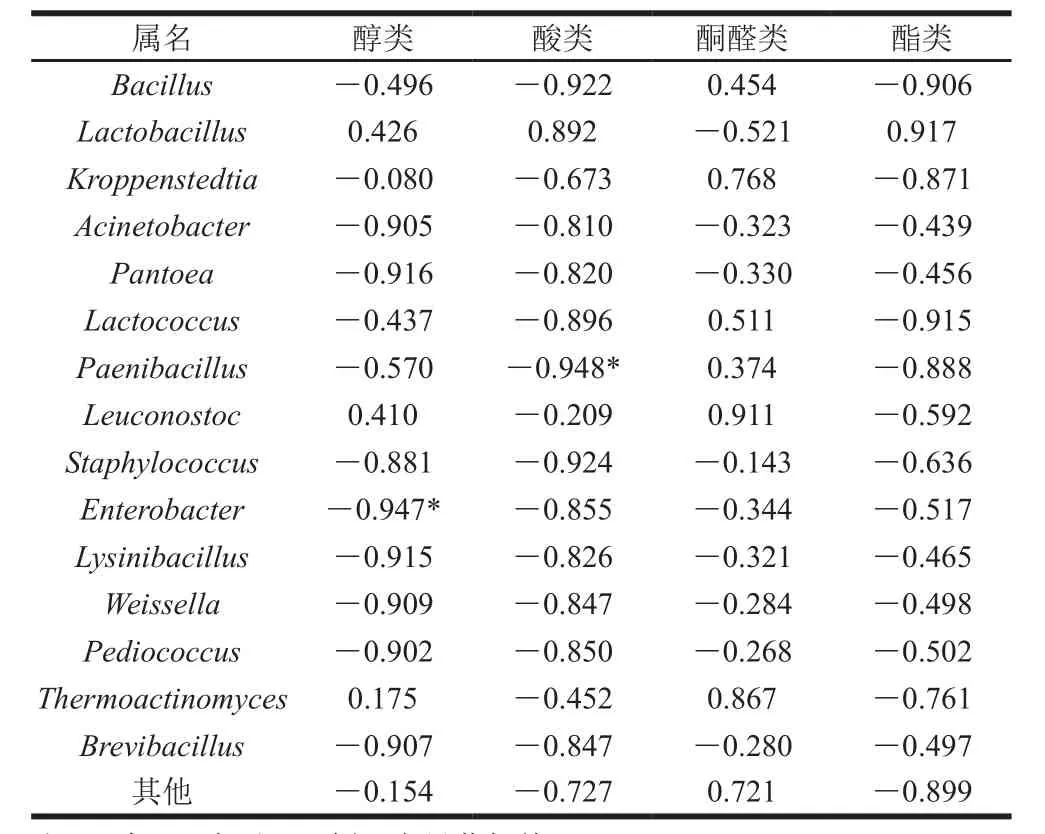
表3 酒醅细菌群落结构与香气成分的相关性分析Table 3 Correlation analysis between bacterial community structure and volatile aroma compounds
由表3可知,相关性分析表明,在0.05水平上,Paenibacillus(类芽孢杆菌属)与酸类呈显著负相关;Enterobacter(肠杆菌属)与醇类呈显著负相关;结果表明,对香气成分影响较为显著的细菌属有Paenibacillus和Enterobacter,其余细菌属与香气成分之间没有显著相关性。
3 结 论
通过对加菌组和空白组酒醅的理化性质对比,结果表明,该产酯香功能细菌在堆积和窖池发酵过程中能够提高酒醅中淀粉的利用率、蛋白酶活力和氨基态氮含量,从而提高酒醅的酯化力,改善酒醅的性质。
对加菌组和空白组酒醅中的细菌在属水平上进行群落结构分析,结果表明产酯香功能细菌对酒醅的影响主要体现在堆积过程中,能增加酒醅中Bacillus的含量,增加了酒醅中细菌的丰富度,改变细菌群落结构。
不同酒醅中的香气成分定性和定量分析表明,加菌组与空白组酒醅在香气成分上存在明显差异。加菌组酒醅在堆积过程中醇类、酸类、酮醛类物质含量减少,酯类物质含量增加;在发酵过程中醇类、酸类、酮醛类和酯类物质含量增加。糟醅中香气成分主要受Paenibacillus和Enterobacter的影响,虽然堆积酒醅中Bacillus的相对丰度最大,但其与香气成分的相关性并不显著。
本实验研究了产酯香功能细菌对酱香型第5轮次酒醅堆积和窖池发酵的影响,结果表明该功能细菌对酒醅在产酯方面的品质有明显的改善作用,但其中更具体的影响机制有待后续研究。
参考文献:
[1]WU Z Y, LEI X J, ZHU D W, et al. Investigating the variation of volatile compound composition in Maotai-flavoured liquor during its multiple fermentation steps using statistical methods[J]. Food Technology and Biotechnology, 2016, 54(2): 243-249. DOI:10.17113/ftb.54.02.16.4582.
[2]ZHU S K, LU X, JI K H, et al. Characterization of flavor compounds in Chinese liquor Moutai by comprehensive two-dimensional gas chromatography/time-of-flight mass spectrometry[J]. Analytica Chimica Acta, 2007, 597(2): 340-348. DOI:10.1016/j.aca.2007.07.007.
[3]WANG L, WANG Y Y, WANG D Q, et al. Dynamic changes in the bacterial community in Moutai liquor fermentation process characterized by deep sequencing[J]. Journal of the Institute of Brewing, 2015, 121: 603-608. DOI:10.1002/jib.259.
[4]DING X F, WU C D, HUANG J, et al. Changes in volatile compounds of Chinese Luzhou-flavor liquor during the fermentation and distillation process[J]. Journal of Food Science, 2015, 80(11): 2373-2381. DOI:10.1111/1750-3841.13072.
[5]WU Q, XU Y, CHEN L. Diversity of yeast species during fermentative process contributing to Chinese Maotai-flavour liquor making[J].Letters in Applied Microbiology, 2012, 55(4): 301-307. DOI:10.1111/j.1472-765X.2012.03294.x.
[6]李长江, 张洪远, 沈才洪, 等. 武陵酱香型白酒工艺创新: 酱香糟醅堆积“二次制曲”的工艺研究(第三报)[J]. 酿酒科技, 2010(4): 52-55.DOI:10.13746/j.njkj.2010.04.019.
[7]戴奕杰, 田志强, 黄家岭, 等. 酱香型白酒生物化学及微生物学研究进展[J]. 酿酒科技, 2016(3): 100-105. DOI:10.13746/j.njkj.2015397.
[8]杨漫江. 堆积发酵对酱香型白酒风味物质形成的影响[J]. 酿酒科技,2011(7): 72-73. DOI:10.13746/j.njkj.2011.07.035.
[9]ZHANG R, WU Q, XU Y. Aroma characteristics of Moutaiflavour liquor produced with Bacillus licheniformis by solid-state fermentation[J]. Letters in Applied Microbiology, 2013, 57: 11-18.DOI:10.1111/lam.12087.
[10]曾德勇. 酱香型白酒生产中功能微生物的优化组合及其应用研究[D].贵阳: 贵州大学, 2016: 3-5.
[11]马荣山, 于影. 麸曲酱香型白酒的酿制研究[J]. 中国酿造, 2010,29(1): 138-140. DOI:10.3969/j.issn.0254-5071.2010.01.049.
[12]吴群, 陈笔, 李勇, 等. 芝麻香型白酒酿造功能霉菌及其与酵母的相互作用[J]. 酿酒科技, 2015(1): 7-11. DOI:10.13746/j.njkj.20145122.
[13]雷振河. 采用高通量测序技术分析清香型白酒酿造微生物[J].食品与发酵工业, 2015, 41(9): 60-64. DOI:10.13995/j.cnki.11-1802/ts.201509032.
[14]于春涛, 刘超, 陈瑞玲, 等. 浓香型白酒窖泥变质前后真菌群落差异分析[J]. 酿酒科技, 2016(10): 40-45. DOI:10.13746/j.njkj.2016159.
[15]陈玲, 袁玉菊, 曾丽云, 等. 16S rDNA克隆文库法与高通量测序法在浓香型大曲微生物群落结构分析中的对比研究[J]. 酿酒科技,2015(12): 33-36. DOI:10.13746/j.njkj.2015145.
[16]陈剑, 蒋英丽, 程伟, 等. 酱香型白酒酒糟中耐酸产酯香细菌的筛选[J].酿酒科技, 2016(2): 61-64. DOI:10.13746/j.njkj.2015413.
[17]程伟, 卓毓崇, 杨柳, 等. 不同工艺对麸曲中酸性蛋白酶活性的影响[J].酿酒科技, 2016(12): 40-42. DOI:10.13746/j.njkj.2016349.
[18]熊正河, 赵建华, 陈林. 酿酒大曲通用分析方法: QB/T 4257—2011[S].北京: 中国轻工业出版社, 2011: 2-8.
[19]WANG P, WU Q, JIANG X J, et al. Bacillus licheniformis affects the microbial community and metabolic profile in the spontaneous fermentation of Daqu starter for Chinese liquor making[J].International Journal of Food Microbiology, 2017, 250(5): 59-67.DOI:10.1016/j.ijfoodmicro.2017.03.010.
[20]SUN W N, XIAO H Z, PENG Q, et al. Analysis of bacterial diversity of Chinese Luzhou-flavor liquor brewed in different seasons by Illumina Miseq sequencing[J]. Annals of Microbiology, 2016, 66:1293-1301. DOI:10.1007/s13213-016-1223-5.
[21]马群, 张时云, 刘杰. 酒醅理化指标与酒质及出酒率关系的比较分析[J]. 酿酒科技, 2012(11): 65-68. DOI:10.13746/j.njkj.2012.11.049.
[22]郭坤亮. 茅台酒酿造微生物的生物多样性成因及研究价值的探讨[J]. 酿酒, 2002, 29(2): 36-38. DOI:10.3969/j.issn.1002-8110.2002.02.016.
[23]XU M L, YU Y, RAMASWAMY H S, et al. Characterization of Chinese liquor aroma components during aging process and liquor age discrimination using gas chromatography combined with multivariable statistics[J]. Scientific Reports, 2017, 7: 39671. DOI:10.1038/srep39671.
[24]付勋, 刘兴平, 敖宗华, 等. 浓香型白酒典型酒醅及其发酵影响因素研究进展[J]. 北京工商大学学报, 2011, 29(6): 54-57. DOI:10.3969/j.issn.1671-1513.2011.06.014.
[25]崔涛. 浅谈白酒中的高级醇[J]. 酿酒科技, 1994(6): 28-29.DOI:10.13746/j.njkj.1994.06.009.
[26]冯雨. 酱香型白酒的堆积发酵[J]. 酿酒科技, 2013(2): 80-81.DOI:10.13746/j.njkj.2013.02.035.
[27]谢方安. 谈白酒香气成分和作用[J]. 酿酒, 2006, 33(5): 52-55.DOI:10.3969/j.issn.1002-8110.2006.05.022.
[28]尚柯, 韩兴林, 潘学森, 等. 酱香型白酒高温堆积过程相关理化参数变化情况的初步分析[J]. 酿酒科技, 2015(10): 1-4. DOI:10.13746/j.njkj.2015293.
[29]胡名志. 增加醇醛检测指标完善白酒标准[J]. 酿酒科技, 2010(10):58-60. DOI :10.13746/j.njkj.2010.10.013.
[30]张鹏, 张亮臣, 孙振宇, 等. 浓香型大曲白酒蒸馏过程中四大酯馏出特性的分析[J]. 食品工程, 2013(3): 30-32. DOI:10.3969/j.issn.1673-6044.2013.03.011.
