蓝靛果酒发酵工艺优化及发酵过程对花色苷的影响
2018-05-23包怡红
梁 敏,包怡红*
(东北林业大学林学院,黑龙江 哈尔滨 150040)
蓝靛果,又名羊奶子、黑瞎子果、山茄子果等,为忍冬科忍冬属的多年生落叶小灌木,是蓝靛果忍冬的变种,其品种较多,原产于俄罗斯东北部、中国、日本和加拿大[1]。在我国,蓝靛果忍冬抗晚霜能力强,属于耐寒植物,主要分布在东北、华北和西北的一些地区,特别在我国东北的大小兴安岭和长白山地区[2-3]。蓝靛果是一种椭圆形的蓝黑色小浆果,营养丰富,除含有多种维生素、有机酸、矿物元素外,还含有多种活性成分,特别是花色苷含量丰富。研究表明蓝靛果花色苷具有抗氧化[4]、抗炎[1]、抗肿瘤[5]、降低胆固醇[6]、抑菌[7]等功效。由于蓝靛果口味酸涩,不适合鲜食,多用以制作各种产品,如果醋、果酒、果酱等。但是研究发现花色苷性质不稳定,在产品加工过程中易受某些理化因素影响而发生降解或转化,如光照、温度、pH值、糖及其降解产物等[8],因此,研究加工过程对花色苷含量及组成的影响具有很大的意义。
果酒是以新鲜水果为原料,经过破碎、发酵或者浸泡等工艺而制成的含有一定酒精度数的营养保健型酒[9-10]。一般来说,根据酿造方法和成品特点的不同,将果酒分为4 大类,即发酵酒、蒸馏酒、配制酒和气泡酒[11]。杜恣闲等[11]的研究表明,发酵酿造的果酒不仅保留了原果的主要维生素、大部分的氨基酸和矿物元素,还产生了有利于人体生长发育所需的各种醇类物质和微生物次级代谢产物。目前,已经报道了各种果酒的工艺研究,如蓝莓果酒、树莓果酒、桑葚果酒、蓝靛果酒等。但是,关于发酵对果酒花色苷含量及组成的变化的研究还鲜有报道。本实验以蓝靛果为原料,研究了发酵菌株、糖种类、接种量、起始pH值、发酵温度对蓝靛果酒理化性质及花色苷含量的影响,采用正交试验对发酵工艺进行优化,并利用高效液相色谱-串联质谱研究发酵前后花色苷组成及各组成所占比例的变化。
1 材料与方法
1.1 材料与试剂
蓝靛果由黑河林业局提供;果胶酶(活力≥1 000 U/mg)上海源叶生物科技有限公司。
甲酸、甲醇(均为色谱纯) 天津市福晨化学试剂厂;KCl、乙酸钠、酒石酸钾钠等均为国产分析纯。
1.2 仪器与设备
1290-6430高效液相色谱-串联谱联用仪 美国Agilent公司;PHS-3E雷磁pH计 上海仪电科学仪器股份有限公司;721可见光分光光度计 上海佑科仪器仪表有限公司;H/T20MM台式高速离心机 湖南赫西仪器装备有限公司;DH6000A电热恒温培养箱 天津市泰斯特仪器有限公司。
1.3 方法
1.3.1 蓝靛果酒酿造工艺
蓝靛果→清洗→与水1∶1打浆→酶解→调整成分→添加偏重亚硫酸钠,室温放置6~8 h→接种→发酵→二次加糖→发酵→倒灌过滤→后发酵→陈酿→调配→澄清→灌装杀菌→成品
1.3.2 酶解工艺
向蓝靛果浆中添加0.075%的果胶酶,在45 ℃酶解160 min,95 ℃灭酶5 min。
1.3.3 酵母的活化
将酵母与5%的糖水按质量比1∶10混合[12-13],于40 ℃水浴锅内活化30 min。
1.3.4 发酵菌株的筛选
取灭酶后的蓝靛果浆,用蔗糖调整初始糖度为20 °Bx,用10%的NaHCO3溶液调pH值为3.6,分别接入0.2%的安琪高活性酿酒酵母(以下简称酵母GA)和葡萄酒、果酒专用酵母SY(以下简称酵母SY),置于28 ℃恒温箱内进行发酵,测定发酵前及1、2、3、4、5、6、7 d后残糖、总酸和花色苷含量,在发酵结束时测定乙醇体积分数,并进行感官评价。每个处理重复3 次。
1.3.5 碳源种类的筛选
取蓝靛果浆,分别添加葡萄糖、蔗糖、葡萄糖与蔗糖比为1∶1的混合糖,使果浆初始糖度达到20 °Bx,调节pH 3.6,加70 mg/L偏重亚硫酸钠,放置过夜[14]。接入0.2%的酵母SY,置于28 ℃的恒温箱内发酵。发酵7 d后测定发酵液中的残糖、总酸、花色苷含量、乙醇体积分数,并进行感官评价,确定最佳糖种类。每个处理重复3 次。
1.3.6 加糖量的确定
果酒乙醇质量浓度一般为10~12 g/100 mL,若乙醇质量浓度过低则容易发生发酵变质,难以保存。本实验初步拟定乙醇质量浓度为10 g/100 mL。葡萄糖发酵理论产酒率测定:C6H12O6→2C2H5OH+2CO2(分子质量180→92+88),理论产酒率为92/180×100%=51.11%,即1 g糖理论可产0.511 1 g乙醇,但实际发酵率一般在90%左右,即1 g糖实际仅可产生0.46 g乙醇[15]。蓝靛果浆中含糖量较低,经测定蓝靛果汁含糖量为3.31 g/100 mL,需额外加糖。加糖量计算如式(1)所示:
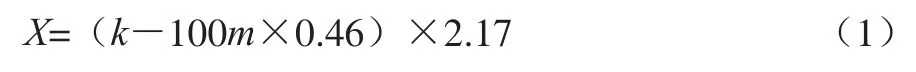
式中:X为需添加糖质量浓度/(g/100 mL);k为拟定发酵酒的乙醇质量浓度/(g/100 mL);m为蓝靛果汁的含糖量/(g/100 mL);2.17为每产生1 g乙醇理论需糖量(经验值1/0.46)。
1.3.7 发酵工艺的单因素试验
1.3.7.1 接种量的影响
取蓝靛果浆,调pH值为3.6,加入总加糖量50%的蔗糖(经计算每100 mL果浆中需加蔗糖总量为18.40 g),分别接入0.1%、0.2%、0.3%、0.4%、0.5%酵母SY,置于28 ℃的恒温箱内发酵,经预实验发现在第4天时发酵液内的总糖质量浓度下降至32 g/L,此时加入剩余总加糖量50%的蔗糖,继续发酵,记录发酵液的质量,根据二氧化碳失重法,待质量基本保持不变时结束发酵,测定发酵液中的残糖、总酸、花色苷含量、乙醇体积分数,并进行感官评价。每个处理重复3 次,取平均值。
1.3.7.2 起始pH值的影响
调蓝靛果浆起始pH值分别为2.9、3.2、3.5、3.8、4.1,加入总加糖量50%的蔗糖,接0.2%酵母菌,置于28 ℃的恒温箱内发酵,在第4天时加入总加糖量50%的蔗糖,记录发酵液质量,待质量基本保持不变时结束发酵,测定发酵液中的残糖、总酸、花色苷含量、乙醇体积分数,并进行感官评价。每个处理重复3 次,取平均值。
1.3.7.3 发酵温度的影响
将调好的蓝靛果浆接种0.2%酵母后,分别置于20、23、26、29、32 ℃发酵,在第4天加入总加糖量50%的蔗糖,记录发酵液质量,待质量基本保持不变时结束发酵,测定发酵液中的残糖、总酸、花色苷含量、乙醇体积分数,并进行感官评价。每个处理重复3 次,取平均值。
1.3.8 正交试验优化
在单因素试验的基础上,以酵母SY接种量(A)、起始pH值(B)、发酵温度(C)为因素,以感官评分为指标,进行3因素3水平正交试验,确定最佳发酵工艺。
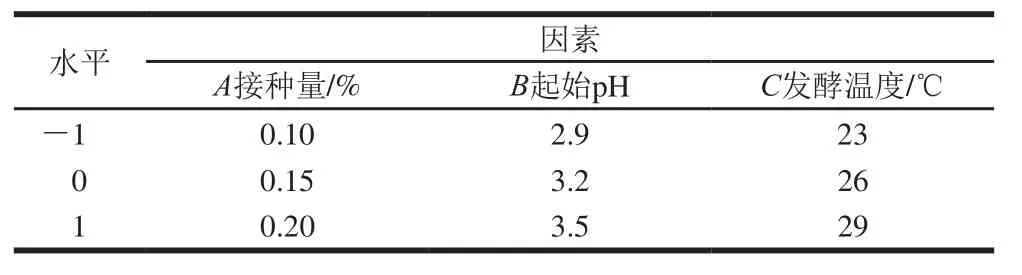
表1 正交试验因素及水平Table1 Factors and their levels used for orthogonal array design
1.3.9 指标测定
1.3.9.1 出汁率计算
出汁率计算如式(2)所示:

1.3.9.2 残糖、总酸含量和乙醇体积分数测定
残糖含量的测定:参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》直接滴定法;总酸含量的测定:参照GB/T 12456—2008《食品中总酸的测定》酸碱滴定法,以酒石酸计;乙醇体积分数的测定:参照GB/T 15038—2006酒精计法。
1.3.9.3 花色苷含量测定
参照Denev等[16]的方法,采用pH值示差法。
1.3.9.4 感官评价
由10 位专业人士,参考葡萄酒、果酒通用分析中的品酒方法,根据表2感官评价标准进行评分。
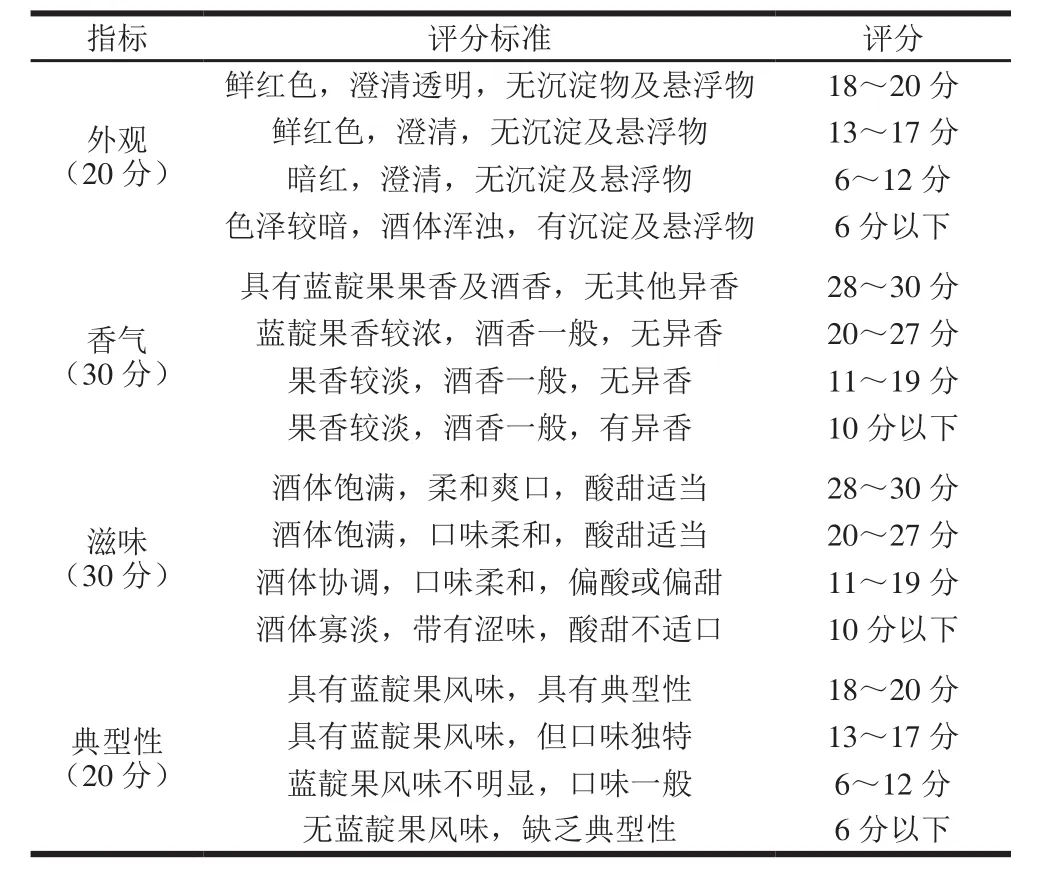
表2 蓝靛果酒感官评价标准Table 2 Criteria for sensory evaluation of Lonicera caerulea berry wine
1.3.9.5 花色苷组成的高效液相色谱-串联质谱分析
测定样品为发酵前经成分调整后的蓝靛果汁及发酵后的蓝靛果酒。样品在6 000 r/min离心15 min,取上清液经0.45 μm的滤膜过滤,于-4 ℃保存备用。
色谱条件:色谱柱:UHPAQ C18(2.1 mm×50 mm,1.9 μm)。柱温27 ℃,进样体积5 μL。流动相:0.1%甲酸溶液(A)和甲醇(B),梯度洗脱条件:0 min,85% A;1~2 min,50% A;4~6 min,20% A;7 min,85% A。流速:0.30 mL/min。
质谱条件:采用正离子采集模式。扫描范围m/z 400~1 000;毛细管温度300 ℃;毛细管电压4 kV;干燥气压力15 psi;流速11 L/min。
1.4 数据统计分析
应用Origin 8和Minitab 16进行数据处理及正交试验优化,并采用SPSS 22进行显著性差异分析,所有实验重复3 次,表示为 ±s。
2 结果与分析
2.1 发酵菌株的确定
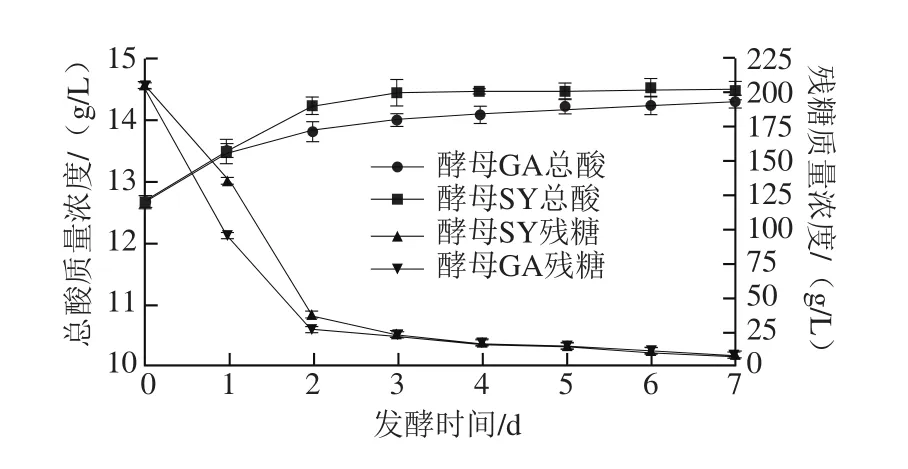
图1 发酵过程中不同酵母对总酸和残糖含量的影响Fig. 1 Effects of different yeasts on total acid and residual sugar concentration during fermentation process
总酸对于发酵类型产品的香味和风味具有决定性的影响,且其水平可用作保质期的指标[17]。由图1可知,两种酵母在残糖和总酸含量方面具有相似的发酵特性。蓝靛果汁发酵前的初始总酸质量浓度为(12.66±0.11)g/L,在发酵前3 d,总酸含量增加较快,4~7 d有所波动,但基本保持不变。发酵液中残糖含量逐渐降低,在发酵前2 d时,残糖含量下降迅速,在3~7 d时仍处于下降趋势,但下降速度缓慢,在发酵7 d时,酵母GA和酵母SY的残糖质量浓度分别为(7.69±0.17)g/L和(7.45±0.17)g/L。发酵液的总酸含量逐渐升高,这可能是由于在酿酒过程中,特别是在乙醇发酵开始时,甘油丙酮酸发酵途径中产生了α-酮戊二酸和琥珀酸[18]。

图2 发酵过程中不同酵母对花色苷含量的影响Fig. 2 Effects of different yeasts on anthocyanin concentration during fermentation process
如图2所示,两种酵母的发酵液中的花色苷含量随着发酵时间的延长而呈现下降趋势。这与Wang Lihua等[19]在桑葚酒发酵过程中的趋势相似。在发酵第1天,花色苷含量迅速降低,在之后的2~7 d内花色苷含量下降速度减缓。在发酵7 d时,酵母SY和酵母GA发酵液中的花色苷质量浓度分别为(98.56±2.89)mg/L和(99.89±3.01)mg/L。发酵过程中花色苷降解且两种发酵液中花色苷含量不同可能的原因有3 个:一是不同的酵母对花色苷的吸附作用不同,吸附能力与其自身的细胞壁结构和成分、带电量、电量分配和可接触面积有关;二是花色苷不稳定,在发酵过程中酵母释放的次级代谢产物如丙酮酸、乙醛会与部分花色苷发生反应,转变为一些大分子衍生物[17,20-21];三是酵母产生的酶也会使花色苷发生降解,导致其溶解性降低而沉淀下来[22-23]。
在发酵7 d时,酵母GA和酵母SY发酵液的乙醇体积分数分别为(9.3±0.2)%和(8.9±0.3)%,二者差异不显著;感官评分分别为68.78±0.86和73.25±1.23,差异显著(P<0.05)。可以看出由酵母SY酿得的蓝靛果酒总酸含量较低,花色苷含量与酵母GA所得果酒差异不显著,且香气更浓,评分更高。因此,选择酵母SY进行下一步研究。
2.2 碳源种类的确定
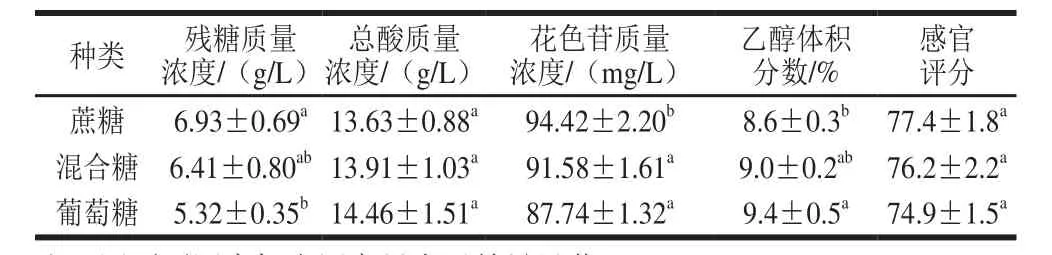
表3 不同糖对蓝靛果酒指标的影响Table 3 Effects of different sugars on indices of L. caerulea berry wine
由表3可知,所使用的糖不同,所得到的蓝靛果酒的各指标存在差异。酵母SY对葡萄糖的利用度更高,产生的乙醇更多。但是,发酵结束时采用蔗糖酿造的果酒中花色苷含量稍高于葡萄糖酿造的果酒,且生产的蓝靛果酒的感官评分稍高于采用葡萄糖酿造的果酒,综合考虑,选择蔗糖进行下一步实验。
2.3 发酵工艺单因素试验结果
2.3.1 接种量的确定
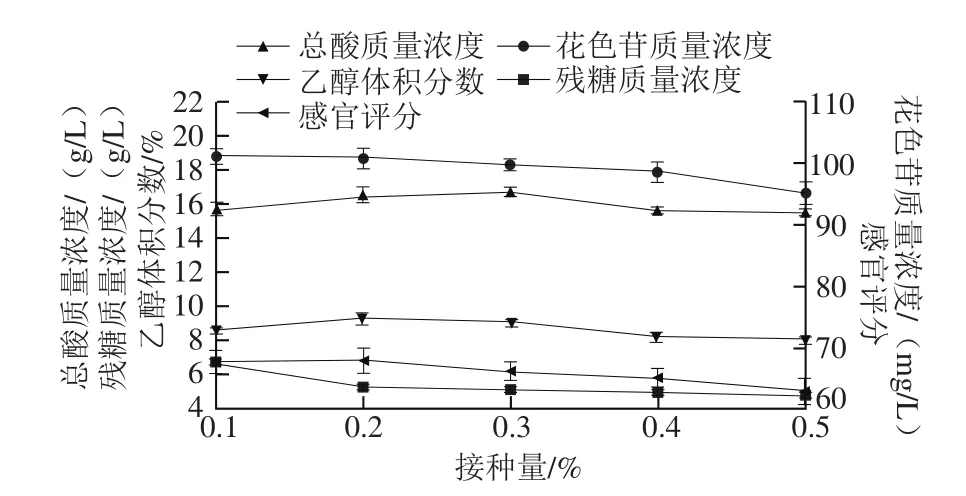
图3 接种量对蓝靛果酒的影响Fig. 3 Effect of inoculum amount on quality attributes of L. caerulea berry wine
由图3可知,随着酵母SY接种量的增大,总酸含量和乙醇体积分数呈现先升高后降低的趋势,残糖逐渐降低,在接种量为0.2%时,乙醇体积分数达到最大9.3%,残糖含量在此之后逐渐保持平缓。这是因为当酵母接种量偏低时,酵母繁殖速度缓慢,发酵周期延长,乙醇体积分数低,香气不足;当接种量较大时,发酵液中的营养物质不能满足酵母的快速生长繁殖代谢,且大部分的营养物质被用于酵母的生长繁殖使得乙醇体积分数低,香气不足,此外,酵母菌的残体还会导致果酒澄清度降低,感官和口感会严重下降[9,14],只有在酵母接种量适度时,才能产生乙醇体积分数高,酒体丰满的果酒。
随着接种量的增大,发酵液中花色苷含量在逐渐降低,酒体的颜色也逐渐变浅,这可能是因为酵母菌对花色苷具有吸附作用,酵母菌越多对花色苷的吸附量就越多。在接种量为0.1%和0.2%时,感官评分基本相同,之后随酵母接种量升高,感官评分逐渐降低,综合考虑,选择0.1%、0.15%和0.20%进行后续的优化试验。
2.3.2 起始pH值的确定

图4 起始pH值对蓝靛果酒的影响Fig. 4 Effects of initial pH on quality attributes of L. caerulea berry wine
由图4可知,随着发酵液起始pH值的升高,总酸含量逐渐降低,残糖含量整体呈现降低趋势,乙醇体积分数和感官评分先增加后降低,在起始pH值为3.2时,感官评分最高,在pH 3.8时,乙醇体积分数最高。随着pH值的升高,发酵液中花色苷含量显著降低,这是因为花色苷在较高pH值下性质不稳定。
由于发酵液pH值过低会抑制了酵母SY的生长,不利于果酒的发酵,且味道酸涩;pH值过高时不仅会阻碍酵母菌的生长繁殖,还会使发酵液中的花色苷降解加速,从而使得果酒的颜色变淡,影响蓝靛果酒的感官品质。综合考虑,在pH 3.2时,蓝靛果酒的色泽、感官评分和乙醇体积分数都较高。
2.3.3 发酵温度的确定
由图5可以看出,不同发酵温度酿造蓝靛果酒的乙醇体积分数、总酸含量、残糖含量、感官评分及花色苷含量差异较大。发酵温度在20~24 ℃时,发酵温度较低,酿酒酵母生长比较缓慢,蓝靛果酒中残糖含量较高而乙醇体积分数较低,若要发酵完成需要延长发酵时间;发酵温度为26 ℃时,果酒的乙醇体积分数达到最大,发酵完全,且酒体饱满;当发酵温度大于26 ℃时,酵母细胞生长代谢迅速,易衰老,且在高温条件下容易产生杂菌,不利于果酒风味物质的形成,且产生的乙醇体积分数较低,酒体不饱满。此外,还可以发现随着发酵温度的升高,蓝靛果酒花色苷含量逐渐降低,而花色苷含量会影响蓝靛果酒的色泽,从而影响其感官品质。

图5 发酵温度对蓝靛果酒的影响Fig. 5 Effects of fermentation temperature on quality attributes of L. caerulea berry wine
2.4 蓝靛果酒发酵工艺正交试验结果
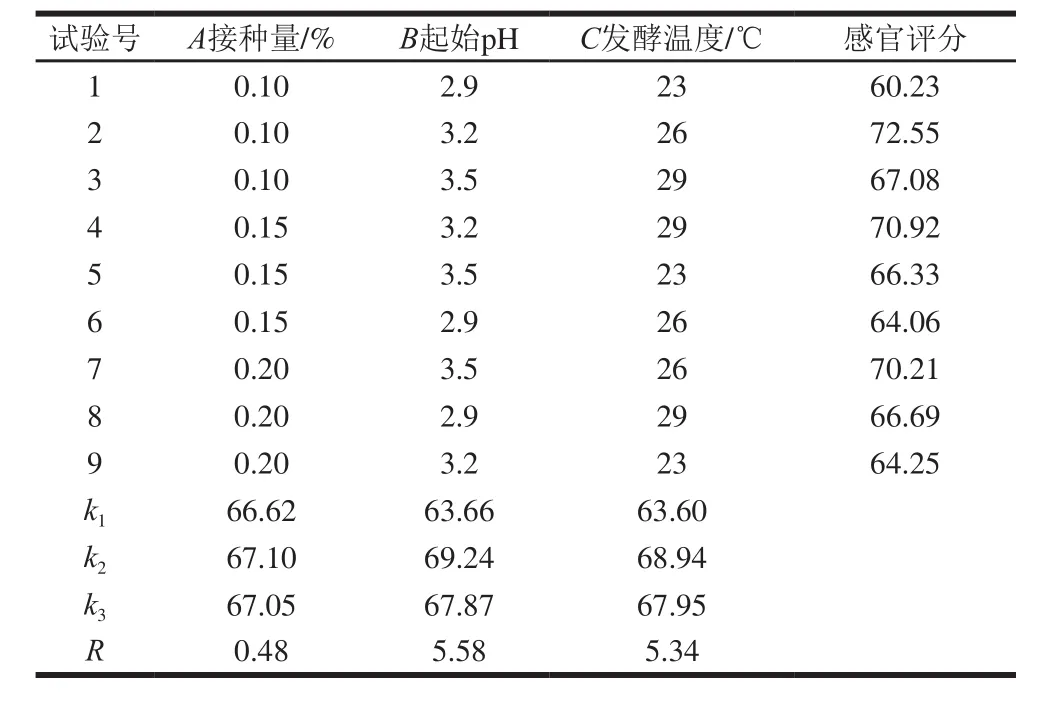
表4 正交试验设计与结果Table 4 Orthogonal array design with experimental results
感官品质是评价食物的重要指标,其包括食物的色泽、滋味、香气等。由表4可以看出,影响蓝靛果酒感官品质的因素依次为:起始pH值(B)>发酵温度(C)>酵母接种量(A),其中起始pH值的影响最大,而接种量影响最小。最佳发酵工艺为A2B2C2,即接种量0.15%、起始pH 3.2、发酵温度26 ℃。在此最佳发酵条件下发酵12 d,蓝靛果酒乙醇体积分数为9.33%,感官评分为75.15,花色苷质量浓度为80.49 mg/L,为初始花色苷质量浓度(211.0 mg/L)的38.13%。
2.5 发酵对蓝靛果花色苷组成的影响
经液相色谱柱洗脱后,采用质谱进行检测,花色苷的总离子流色谱图见图6。采用高效液相色谱-串联质谱分析蓝靛果酒发酵前后花色苷组成一级质谱图分别见图7、8。
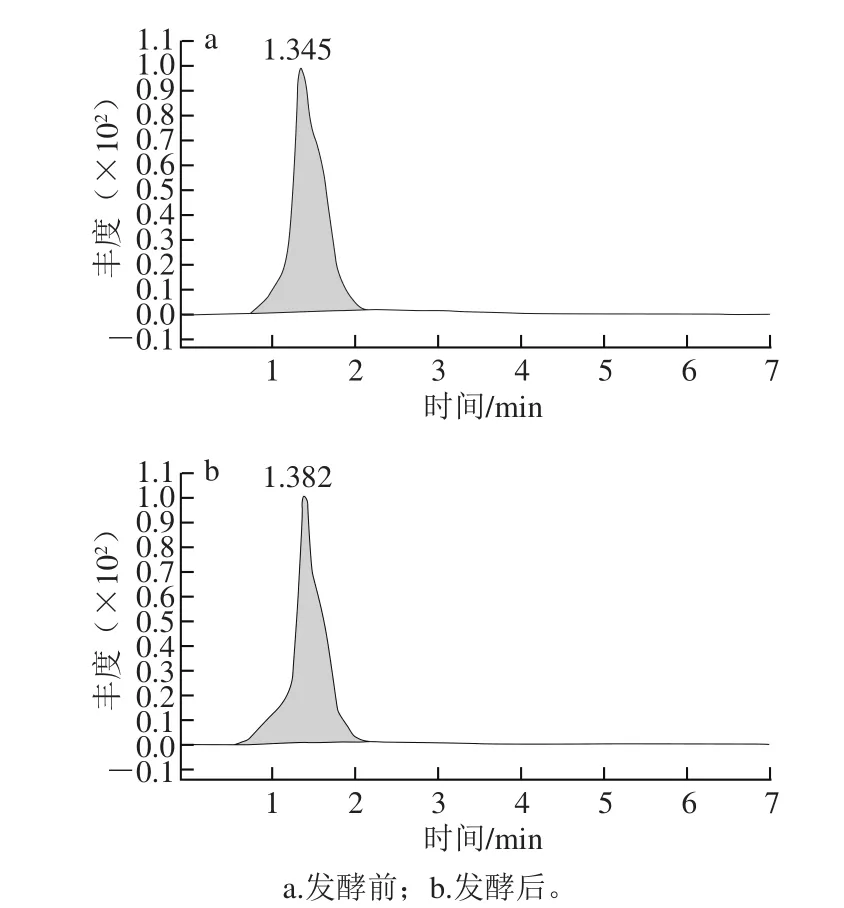
图6 花色苷的总离子流色谱图Fig. 6 Total ion current chromatogram of anthocyanins

图7 发酵前花色苷组成一级质谱图Fig. 7 Mass spectra of anthocyanins in juice
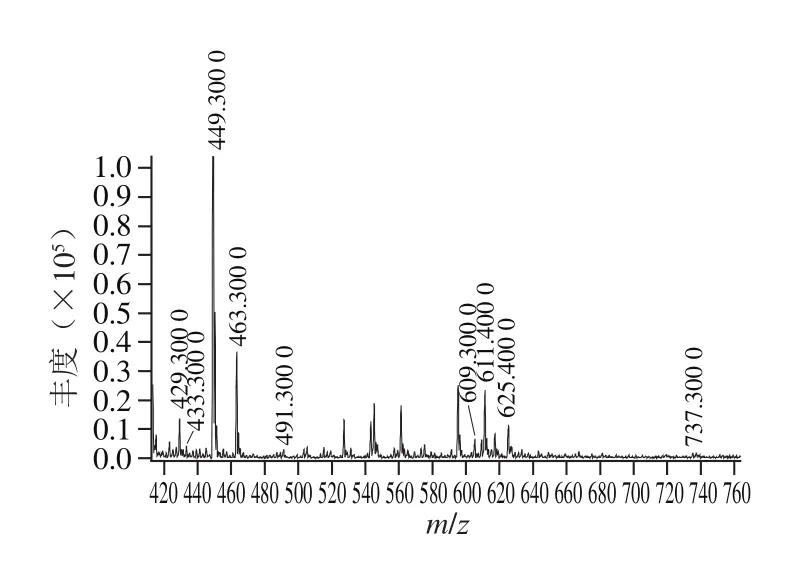
图8 蓝靛果酒花色苷组成一级质谱图Fig. 8 Mass spectra of anthocyanin components of L. caerulea berry wine
由图7、8可以看出,蓝靛果发酵前后的样品中均含有分子质量为433、449、463、491、609、611、625、737的花色苷,并通过对各母离子的二级质谱碎片离子进行分析,可以推断出花色苷的种类,结果如表5所示。
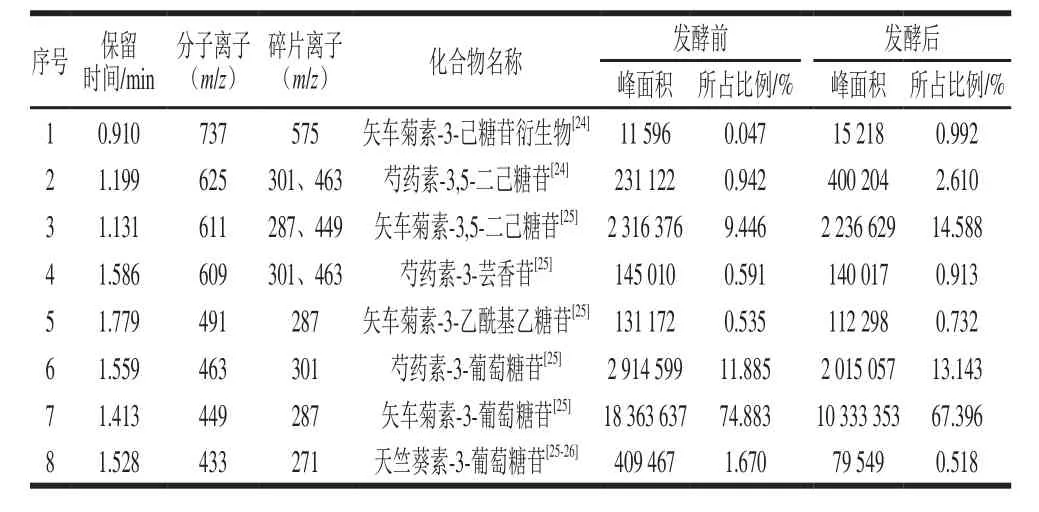
表5 蓝靛果酒发酵前后花色苷组成及对应的峰面积比例Table 5 Anthocyanin compositions and corresponding peak area ratios of L. caerulea berry juice and wine
由表5可以看出,蓝靛果发酵前后的样品中含有8 种花色苷,即矢车菊素-3-己糖苷衍生物、芍药素-3,5-二己糖苷、矢车菊素-3,5-二己糖苷、芍药素-3-芸香苷、矢车菊素-3-乙酰基乙糖苷、芍药素-3-葡萄糖苷、矢车菊素-3-葡萄糖苷和天竺葵素-3-葡萄糖苷。通过计算这8 种花色苷的总峰面积,可以发现发酵过程中这8 种花色苷的总峰面积降低了9 190 654,这可能是因为花色苷性质不稳定,在发酵过程中温度[27-28]、pH值的变化[29]、添加的蔗糖及其代谢产物[30]等会使花色苷降解或生成较稳定的衍生物,且研究表明接入的酵母菌对花色苷具有一定的吸附作用[20-23]。在质谱扫描过程中未检测到矢车菊素-3-己糖苷聚合物和矢车菊素-己糖苷聚合物。
此外,由表5可知,发酵后矢车菊素-3-己糖苷衍生物、芍药素-3,5-二己糖苷、矢车菊素-3,5-二己糖苷、芍药素-3-芸香苷、矢车菊素-3-乙酰基乙糖苷、芍药素-3-葡萄糖苷的峰面积所占比例均有所增加,而天竺葵素-3-葡萄糖苷和矢车菊素-3-葡萄糖苷的峰面积所占比例有所降低。可以看出二糖苷及花色苷的衍生物有所增加,而单糖苷花色苷含量降低,这可能是因为单糖苷的花色苷性质不稳定,在发酵过程中逐渐形成了更稳定的花色苷衍生物。研究表明,花色苷的稳定性与其结构存在很大关系,如花色苷糖苷配基的甲氧化程度增强可以使花色苷的稳定性增加[31],因此与矢车菊素-3-葡萄糖苷和天竺葵素-3-葡萄糖苷相比,芍药素-3-葡萄糖苷更稳定,这与本实验结果吻合。
3 结 论
以蓝靛果为原料,选择酵母SY作为发酵菌,蔗糖作为菌株的碳源,研究酵母接种量、起始pH值和发酵温度对蓝靛果酒理化性质及感官的影响,经单因素试验和正交试验优化,得到蓝靛果酒发酵的最佳工艺为:接种量0.15%、起始pH 3.2、发酵温度26 ℃。在此最佳发酵条件下发酵12 d时,所得蓝靛果酒乙醇体积分数为9.33%,感官评分为75.15,此时,发酵液中保留的花色苷质量浓度为80.49 mg/L,占初始花色苷质量浓度(211.0 mg/L)的38.13%。
采用高效液相色谱-串联质谱测定发酵对花色苷组成及各组成所占比例的影响,结果显示发酵前后的样品中均含有所测的8 种花色苷,但是,两个样品在质谱扫描过程中均未检测到矢车菊素-3-己糖苷聚合物和矢车菊素-己糖苷聚合物。此外,可以看出发酵后的样品中矢车菊素-3-二己糖苷、芍药素-3,5-二己糖苷、矢车菊素-3,5-二己糖苷、芍药素-3-芸香苷、矢车菊素-3-乙酰基乙糖苷及芍药素-3-葡萄糖苷所占峰面积均有所增加,而矢车菊素-3-葡萄糖苷和天竺葵素-3-葡萄糖苷所占峰面积降低,表明发酵过程中不稳定的花色苷逐渐转变为较稳定的花色苷衍生物。
参考文献:
[1]WU S S, HE X, WU X S, et al. Inhibitory effects of blue honeysuckle(Lonicera caerulea L) on adjuvant-induced arthritis in rats: crosstalk of anti-inflammatory and antioxidant effects[J]. Journal of Functional Foods, 2015, 17: 514-523. DOI:10.1016/j.jff.2015.06.007.
[2]吕闻明. 蓝靛果忍冬酚类物质提取及抗氧化性研究[D]. 长春: 吉林大学, 2012: 9-10.
[3]赵桂红. 蓝靛果天然色素提取、精制条件及稳定性研究[D]. 哈尔滨: 东北农业大学, 2003: 21-25.
[4]RAUDSEPP P, ANTON D, ROASTO M, et al. The antioxidative and antimicrobial properties of the blue honeysuckle (Lonicera caerulea L.),siberian rhubarb (Rheum rhaponticum L.) and some other plants,compared to ascorbic acid and sodium nitrite[J]. Food Control, 2013,31(1): 129-135. DOI:10.1016/j.foodcont.2012.10.007.
[5]杨恩月, 金光, 金海英, 等. 蓝靛果乙酸乙酯萃取物对小鼠S_(180)实体瘤的抑制作用[J]. 延边大学医学学报, 2005, 28(3): 19-21.DOI:10.16068/j.1000-1824.2005.03.005.
[6]王恩福, 包怡红. 蓝靛果提取物调节血脂功能特性的研究[J]. 食品与机械, 2010, 26(1): 81-82. DOI:10.13652/j.issn.1003-5788.2010.01.046.
[7]包怡红, 于阳阳, 彭冬香, 等. 提取条件对蓝靛果花色苷抑菌作用的影响[J]. 食品科技, 2011, 36(10): 178-182. DOI:10.13684/j.cnki.spkj.2011.10.030.
[8]WANG W, JUNG J, ZHAO Y. Chitosan-cellulose nanocrystal microencapsulation to improve encapsulation efficiency and stability of entrapped fruit anthocyanins[J]. Carbohydrate Polymers, 2017, 157:1246-1253. DOI:10.1016/j.carbpol.2016.11.005.
[9]党翠红. 低度海红果酒酿造工艺研究[D]. 西安: 陕西科技大学,2015: 14-16.
[10]罗启荣, 何文丹. 中国酒文化大观[M]. 南宁: 广西民族出版社, 2002:33.
[11]杜恣闲, 郑建莉. 果酒的营养成分及其发展分析研究[J]. 江西化工,2011(2): 23-26. DOI:10.14127/j.cnki.jiangxihuagong.2011.02.062.
[12]何晓蒙. 南国梨多酚氧化酶性质及果酒的酿造研究[D]. 大连: 大连工业大学, 2016: 40.
[13]董华强, 邓煜, 上官国莲, 等. 杨桃果酒酿造工艺研究[J]. 食品科学,1999, 20(9): 44-46.
[14]王芳. 蓝莓果酒酿造工艺及对其品质影响的研究[D]. 哈尔滨: 东北林业大学, 2015: 20-35.
[15]RANKINE B. 酿造优质葡萄酒[M]. 马会勤, 译. 北京: 中国农业大学出版社, 2008: 89-91.
[16]DENEV P, KEATCHANOVA M, CIZ M, et al. Biological activities of selected polyphenol-rich fruits related to immunity and gastrointestinal health[J]. Food Chemistry, 2014, 157: 37-44. DOI:10.1016/j.foodchem.2014.02.022.
[17]BERENGUER M, VEGARA S, BARRAJON E, et al. Physicochemical characterization of pomegranate wines fermented with three different Saccharomyces cerevisiae yeast strains[J]. Food Chemistry, 2016, 190:848-855. DOI:10.1016/j.foodchem.2015.06.027.
[18]RIBEREAU-GAYO P, DUBOURDIEU D, DONECHE B, et al.Handbook of enology, volume 1, the microbiology of wine and vinifications[M]. 2nd ed. John Wiley & Sons Ltd., 2006: 62-63.
[19]WANG L H, SUN X Y, LI F, et al. Dynamic changes in phenolic compounds, colour and antioxidant activity of mulberry wine during alcoholic fermentation[J]. Journal of Functional Foods, 2015, 18: 254-265. DOI:10.1016/j.jff.2015.07.013.
[20]MEDINA K, BOIDO E, DELLACASSA E, et al. Yeast interactions with anthocyanins during red wine fermentation[J]. Journal of Enology and Viticulture, 2005, 56: 104-109.
[21]CARRIDI A. New perspectives in safety and quality enhancement of wine through selection of yeasts based on the parietal adsorption activity[J]. International Journal of Food Microbiology, 2007,120(1/2): 167-172. DOI:10.1016/j.ijfood micro.2007.08.032.
[22]张晓松, 孙艳梅, 胡振生, 等. 都柿果酒在酿制过程中总酚和花色苷含量和抗氧化活性[J]. 东北农业大学学报, 2010, 14(3): 120-124.
[23]胡冀太, 杜金华, 何桂芬. 果酒酵母对发酵山楂酒品质及抗氧化性的影响[J]. 酿酒, 2012, 39(5): 52-56.
[24]MYJAVCOVÁ R, MARHOL P, KŘEN V, et al. Analysis of anthocyanin pigments in Lonicera (caerulea) extracts using chromatographic fractionation followed by microcolumn liquid chromatography-mass spectrometry[J]. Journal of Chromatography A ,2010, 1217(51): 7932-7941. DOI:10.1016/j.chroma.2010.05.058.
[25]VEBERIC R, SLATNAR A, BIZJAK J, et al. Anthocyanin composition of different wild and cultivated berryspecies[J]. LWTFood Science and Technology, 2015, 60(1): 509-517. DOI:10.1016/j.lwt.2014.08.033.
[26]WANG Y H, ZHU J Y, MENG X J, et al. Comparison of polyphenol,anthocyanin and antioxidant capacity in four varieties of Lonicera caerulea berry extracts[J]. Food Chemistry, 2016, 197: 522-529.DOI:10.1016/j.foodchem.2015.11.006.
[27]李颖畅. 蓝莓花色苷的提取纯化及生理功能研究[D]. 沈阳: 沈阳农业大学, 2008.
[28]邹波, 徐玉娟, 吴继军, 等. 贮藏温度对蓝莓汁单个花色苷降解的影响[J]. 现代食品科技, 2015, 31(12): 256-262; 276. DOI:10.13982/j.mfst.1673-9078.2015.12.038.
[29]凌文华, 国红辉. 植物花色苷[M]. 北京: 科学出版社, 2009: 60-66.
[30]DARAVINGAS G, CAIN R F. Thermal degradation of black raspberry anthocyanin pigments in model systems[J]. Journal of Food Science, 1968, 33(2): 138-142.
[31]李颖畅. 植物花色苷[M]. 北京: 化学工业出版社, 2013: 130-143.
