刺参ACE抑制肽制备及降压功效分析
2018-05-23孙乐常万楚君刘光明曹敏杰
华 鑫,孙乐常,2,万楚君,唐 逸,翁 凌,2,刘光明,2,曹敏杰,2,*
(1.集美大学食品与生物工程学院,福建 厦门 361021;2.水产品深加工技术国家地方联合工程研究中心,福建 厦门 361021)
刺参(Stichopus japonicus)属棘皮动物门(Echinodermata)、海参纲(Holothuroidea),是我国最重要的养殖品种。刺参不仅含有各种人体所需的氨基酸、维生素、必需脂肪酸还含有三萜苷[1]、脑苷脂[2]、多糖[3]和皂苷[4]等多种生物活性物质。体壁作为刺参的主要食用部位,主要是由胶原纤维、蛋白聚糖和其他成分组成[5]。干燥刺参体壁中蛋白质含量高达90%[6],是典型的高蛋白、低脂肪、低胆固醇的优质食品。
另一方面,由高血压所引起的心血管疾病发病率在我国仍居高不下,高血压患者常伴有以下并发症:脑出血、冠心病、脑梗塞等[7]。研究发现,血管紧张素转化酶(angiotensin I-converting enzyme,ACE)是调节血压的关键性蛋白酶。ACE是一种含锌离子的二羧肽酶,可以将不具有活性的血管紧张素I转化为强力血管收缩剂——血管紧张素II,同时钝化舒缓激肽,从而使血压升高[8]。一些通过化学合成法制备的降压类药物,如卡托普利、依那普利和赖诺普利,虽然具有良好的降压功效,但同时会产生发热、皮疹、咳嗽等药物副作用[9]。因此,近年来人们将研究目标转向更加安全的食源性ACE抑制肽。迄今为止,国内外已有很多文献报道了利用水产动物蛋白制备ACE抑制肽。Lassoued等[10]利用碱性蛋白酶对棘背鳐鱼鱼皮明胶进行酶解,制备了高活性ACE抑制肽;Wu Qiang等[11]从鲍鱼性腺酶解产物中纯化得到1 个可抑制ACE活性的三肽;Balti等[12]从墨鱼肌肉蛋白酶解产物中,分离得到了9 种新型ACE抑制肽。这些利用水产动物蛋白制备的小肽有望开发成为具有降血压功效的功能性食品。
刺参肽是指以新鲜的刺参为原料,经过蛋白酶酶解,分离得到的具有一定功能特性的生物活性物质。研究发现,刺参蛋白肽具有良好的抗氧化活性[13],能够明显升高大鼠血清高密度脂蛋白含量并降低血清甘油三酯的水平[14],可以降低运动后小鼠的血尿素氮含量,提高其肝糖原含量,且抗疲劳功效随灌胃量的提高而增强[15]。除此之外,它还具有抗肿瘤[16]、促进生殖细胞形成[17]等生物活性。本研究利用复合蛋白酶对刺参体壁进行酶解,并结合膜超滤技术对酶解产物进行分离,以期获得高活性、低分子质量ACE抑制肽,旨在为刺参的深加工提供理论参考。
1 材料与方法
1.1 材料与试剂
鲜活刺参购自厦门高崎水产市场,去除内脏洗净备用。
碱性蛋白酶、木瓜蛋白酶、中性蛋白酶、复合蛋白酶、风味蛋白酶 丹麦Novozymes公司;卡托普利、Hip-His-Leu(HHL)、猪胰蛋白酶、牛胰凝乳蛋白酶美国Sigma公司;猪ACE、猪胃蛋白酶由本实验室制备;其他试剂均为国产分析纯。
1.2 仪器与设备
PT-2100组织捣碎机 瑞士Kinematica公司;pH计德国Sartorius公司;恒温水浴锅 德国Memmert公司;Lambda 35紫外分光光度计 美国Perkin Elmer公司;膜超滤装置 美国Millipore公司;FD-1D-50真空冷冻干燥机 北京博医康科技公司;BP-98AL动物无创血压测试系统 日本Softron公司。
1.3 方法
1.3.1 刺参ACE抑制肽的制备
1.3.1.1 蛋白酶的筛选
以新鲜刺参体壁作为酶解原料,分别用复合蛋白酶、风味蛋白酶、碱性蛋白酶、中性蛋白酶和木瓜蛋白酶对原料进行酶解。固定酶解条件为料液比1∶8(g/mL)、加酶量1.0%(质量分数)、酶解时间5 h,在各酶的最适温度和pH值下进行(表1)。酶解结束后于95 ℃加热10 min终止反应,将酶解液进行离心(10 000×g,10 min),测定上清液的ACE抑制活性,筛选出酶解效果最佳的蛋白酶。

表1 5 种蛋白酶降解刺参的酶解条件Table 1 Hydrolysis conditions for sea cucumber by five proteinases
1.3.1.2 复合蛋白酶酶解条件的优化
选用复合蛋白酶作为刺参体壁水解蛋白酶,利用单因素试验优化最佳酶解条件。1)料液比的影响:在加酶量1.0%、pH 6.5、酶解5 h条件下,考察料液比(1∶2、1∶4、1∶6、1∶8、1∶10(g/mL))对刺参体壁酶解产物ACE抑制率的影响。2)加酶量的影响:在料液比1∶6(g/mL)、pH 6.5、酶解5 h条件下,考察复合蛋白酶添加量(0.1%、0.3%、0.5%、0.8%、1.0%、2.0%)对刺参体壁酶解产物ACE抑制率的影响。3)pH值的影响:在料液比1∶6(g/mL)、加酶量0.8%、酶解时间5 h条件下,考察反应pH值(6.0、6.5、7.0、8.0)对刺参体壁酶解产物ACE抑制率的影响。4)酶解时间的影响:在料液比1∶6(g/mL)、加酶量0.8%、pH 7.0条件下,考察酶解时间(0、2、4、6、8、10 h)对刺参体壁酶解产物ACE抑制率的影响。
1.3.2 ACE抑制率的测定
ACE抑制率的测定参照邱娟等[18]的方法并稍作修改,方法简述如下:取浓度6.5 mmol/L的HHL溶液(含0.3 mol/L NaCl的硼酸盐缓冲液,pH 8.3)50 μL与20 μL样品混匀,37 ℃孵育5 min后加入20 μL ACE,37 ℃反应1 h后加入50 μL 1 mol/L HCl溶液终止反应。然后加入600 μL乙酸乙酯振荡萃取,1 000×g离心5 min后吸取200 μL酯层,晾干后获得萃取物,加入600 μL蒸馏水充分溶解该萃取物,在228 nm波长处测定其吸光度。对照组中样品用硼酸盐缓冲液代替,空白组则预先加入HCl终止反应。ACE抑制率计算如下所示:

式中:A样为样品组吸光度;A样空为样品空白组吸光度;A对为对照组吸光度;A对空为对照空白组吸光度。
IC50为样品的ACE抑制率达到50%时所对应的蛋白质量浓度,其测定方法为:称取一定质量样品配制成不同质量浓度溶液,以样品质量浓度为横坐标,对ACE的抑制率为纵坐标绘制曲线,根据曲线计算IC50。
1.3.3 ACE抑制肽的分离及活性分析
刺参体壁酶解产物中多糖的去除,参照Forghani等[19]的方法并稍作修改,酶解液离心取上清液,然后向其中加入体积分数60%乙醇溶液,于4 ℃静置24 h,离心(10 000×g,15 min),收集上清液,置于旋转蒸发仪中旋转蒸发去除酶解液中的乙醇。选取截留分子质量为3 kDa的超滤膜对样品进行超滤,得到不同分子质量范围的刺参肽(大于3 kDa和不大于3 kDa)。收集超滤外液(不大于3 kDa)用于性质分析。
1.3.4 刺参ACE抑制肽的稳定性分析
1.3.4.1 热稳定性
将样品溶液分别在60、70、80、90、100 ℃水浴中孵育2 h,冷却至室温后测定样品的ACE抑制活性。
1.3.4.2 pH值稳定性
将样品溶液的pH值分别调至2.0、4.0、6.0、8.0和10.0,37 ℃孵育2 h,待到达反应时间后,调节溶液pH值至中性测定其ACE抑制活性。
1.3.4.3 消化稳定性
模拟胃肠液消化实验参照Liang Qiufang等[20]方法,略作修改。取5 mL样品溶液调节其pH值至2.0,加入0.5%胃蛋白酶,37 ℃反应60 min,待到达反应时间后,立即用0.1 mol/L NaOH溶液调节溶液pH值至7.5,随后加入0.5%胰蛋白酶和0.5%胰凝乳蛋白酶,37 ℃反应90 min,反应结束后于95 ℃水浴中放置10 min使酶失活,即得该样品的胃肠液消化产物。
1.3.5 抑制动力学分析
抑制动力学实验参照Barbana等[21]报道的方法,并稍作修改。将ACE与不同质量浓度(0、0.5、1.0、1.5、3.0 mg/mL)的刺参肽孵育,在不同HHL底物浓度下(0.5、1.0、2.5、6.5 mmol/L),测定ACE抑制活性,利用Lineweaver-Burk双倒数作图法对刺参ACE抑制肽的抑制模式进行研究。
1.3.6 刺参ACE抑制肽的体内降血压活性分析
选用北京维通利华实验动物技术有限公司提供的9~11 周、尾部收缩压超过180 mm Hg的雄性自发性高血压大鼠(spontaneously hypertensive rat,SHR)。饲养于24 ℃恒温12 h光照-12 h黑暗的房间,食物与水自由采食,适应性饲养1 周。SHR随机分为4 组,每组4 只,以卡托普利作为阳性对照(10 mg/kg),刺参ACE抑制肽(小于3 kDa)通过口服灌胃的方式进行给药,灌胃量为100 mg/kg和300 mg/kg,阴性对照组灌胃同等剂量生理盐水。按照上述剂量一次性给药,测定大鼠给药后0、2、4、6、12、24 h的收缩压,每只大鼠血压值为测定4 次的平均值。
2 结果与分析
2.1 蛋白酶的筛选

图1 5 种蛋白酶酶解刺参体壁蛋白的Tricine-SDS-PAGEFig. 1 Tricine-SDS-PAGE analysis of hydrolysates produced with five proteinases
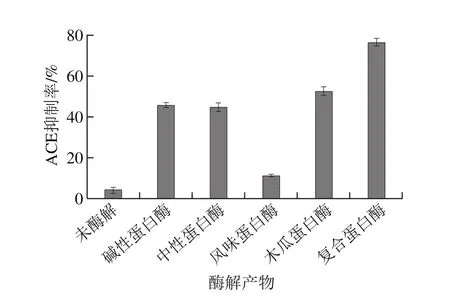
图2 不同蛋白酶酶解产物的ACE抑制率Fig. 2 ACE inhibitory activity of hydrolysates produced with different proteinases
以刺参体壁作为酶解原料,分别用复合蛋白酶、风味蛋白酶、碱性蛋白酶、中性蛋白酶和木瓜蛋白酶对原料进行酶解,以N-三(羟甲基)甲基甘氨酸十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(Tricine sodium dodecyl sulphate-polyacrylamide gel electrophoresis,Tricine SDSPAGE)分析及酶解产物ACE抑制活性为考察指标,筛选出最佳蛋白酶。小分子肽段更容易被机体消化吸收[12]。碱性蛋白酶、中性蛋白酶、木瓜蛋白酶虽然对刺参体壁具有一定的酶解效果,但酶解产物中仍存在较多大分子质量的蛋白,而风味蛋白酶和复合蛋白酶酶解产物的泳道下方未发现明显的电泳条带(图1)。说明风味蛋白酶和复合蛋白酶可以将刺参体壁降解成分子质量更小的多肽,其中,复合蛋白酶酶解产物具有较高的ACE抑制活性,抑制率为76.2%(图2)。因此,选用复合蛋白酶进行后续的酶解实验。
2.2 复合蛋白酶单因素试验结果

图3 各因素对酶解产物ACE抑制活性的影响Fig. 3 Effects of various factors on the ACE inhibitory activity of enzymatic hydrolysates
选用复合蛋白酶对刺参体壁进行定向酶解,以ACE抑制率为考察指标,对其制备工艺参数进行单因素优化,探究料液比、加酶量、反应pH值和酶解时间对刺参体壁酶解产物ACE抑制率的影响。由图3a可知,随着溶剂用量的增加,酶解产物ACE抑制率逐渐增大,当料液比为1∶6时酶解液活性最高,故选择料液比为1∶6。随着加酶量的增大,酶解液ACE抑制率呈现先升高后逐渐平缓的趋势(图3b),当加酶量为0.8%时,酶解产物ACE抑制率为74.7%,继续增大加酶量,酶解产物对ACE抑制活性没有明显增加,因此选择0.8%作为最适加酶量。同时,综合考虑ACE抑制活性和生产成本,最佳酶解时间6 h(图3c),pH 7.0(图3d)。
2.3 ACE抑制肽的分离及活性分析

图4 刺参ACE抑制肽活性分析Fig. 4 ACE inhibitory activity of sea cucumber-derived peptides
为了排除多糖对ACE的影响,以60%乙醇溶液对酶解液进行沉淀,以去除刺参体壁中的多糖。酶解液醇沉后经离心,取上清液进行3 kDa膜超滤,比较膜内外组分的ACE抑制活性。同时,对刺参ACE抑制肽的活性IC50进行测定,结果如图4所示。当ACE抑制肽质量浓度为0~1.5 mg/mL时,ACE抑制活性持续上升,抑制率接近60%。当质量浓度大于1.5 mg/mL时,随着ACE抑制肽质量浓度的增加,ACE抑制率仍有上升,但增加幅度逐渐趋于平缓。经计算,刺参ACE抑制肽的IC50为1.3 mg/mL。张艳萍等[22]利用贻贝为原料降解获得的酶解产物ACE抑制活性IC50为34.6 mg/mL;Bernardini等[23]制备的牛胸肉酶解产物在蛋白质质量浓度为1.48 mg/mL时ACE抑制率为40.6%;周丽杰等[24]采用酶解法和Plastein反应修饰法获得牡蛎ACE抑制肽,在酶解液蛋白质质量浓度5 mg/mL时ACE抑制率为63.30%。以上结果表明,以刺参体壁为原料制备的ACE抑制肽具有较好的活性。此外,经3 kDa膜超滤,超滤外液具有较高的ACE抑制活性,IC50为0.8 mg/mL,而分子质量大于3 kDa组分IC50为3.2 mg/mL,说明分子质量较小的肽类其ACE抑制活性更高。
2.4 刺参ACE抑制肽的稳定性分析


图5 温度(a)、pH值(b)对刺参ACE抑制肽活性的影响Fig. 5 Effects of temperature and pH value on the activity of ACE inhibitory peptides
开发ACE抑制肽时,除需具有较高的ACE抑制活性外,还要在生产、贮藏及体内消化吸收过程中具有较强的稳定性,因此对刺参体壁ACE抑制肽的热稳定性、pH值稳定性及消化稳定性进行了研究。
刺参多肽具有较好的热稳定性(图5a),其ACE抑制活性不随温度的升高而发生降低;从图5b可以看出,刺参多肽同样具有较强的pH值稳定性,经酸碱处理并没有对其抑制活性产生明显影响,这与已报道的墨鱼ACE抑制肽的热稳定性、pH值稳定性[12]基本一致。由于小分子肽段在高温、酸性和碱性条件下不易发生肽链的断裂[25],复合蛋白酶可以将刺参体壁降解成小分子多肽,因此在高温、酸性和碱性条件下刺参ACE抑制肽仍具有较强的ACE抑制活性。

表2 胃肠道蛋白酶消化对刺参ACE抑制肽活性的影响Table 2 Effects of gastrointestinal enzymatic digestion on the activity of ACE inhibitory peptides
从表2可以看出,刺参ACE抑制肽经胃肠液蛋白酶消化后,其活性未降低。这可能是由于:1)刺参ACE抑制肽具有较强的抵抗胃肠道蛋白酶消化的能力;2)胃肠道蛋白酶将刺参ACE抑制肽降解成了分子质量更小的刺参肽,而这些多肽同样具有ACE抑制活性。该现象在油菜籽ACE抑制肽的体外消化实验中也被发现[26]。
2.5 抑制动力学分析
利用Lineweaver-Burk双倒数作图法对刺参ACE抑制肽的抑制模式进行研究。从图6可以看出,当刺参ACE抑制肽的质量浓度分别为0、0.5、1.0、1.5、3.0 mg/mL时,它们的Lineweaver-Burk双倒数曲线相交于X轴,随着刺参ACE抑制肽质量浓度的增加,Km未发生明显变化,而最大速率Vmax逐渐降低,说明刺参ACE抑制肽能结合在ACE的非活性部位,且不影响底物与ACE催化区域的结合,并通过与酶-底物形成的三元复合物抑制其进行进一步分解而实现对ACE的抑制,属于非竞争性抑制类型。这与报道的酵母ACE抑制肽[27]和扁豆蛋白ACE抑制肽[21]具有相同的抑制模式。

图6 刺参ACE抑制肽对ACE抑制的动力学分析Fig. 6 Kinetic study of the inhibitory activity of sea cucumber-derived peptides against ACE
2.6 刺参ACE抑制肽对SHR血压的影响

图7 口服刺参ACE抑制肽对SHR收缩压的影响Fig. 7 Changes in SBP of SHR after oral administration of sea cucumber-derived peptides
动物收缩压是指动物心室收缩时血管内壁的压力(亦称高压),是高血压动物实验常用的测定指标[28-29]。本研究中,以SHR为对象,一次性灌胃刺参ACE抑制肽,并在给药后0、2、4、6、12、24 h测定大鼠尾动脉收缩压,结果如图7所示。灌胃前SHR的平均血压为(189±0.83)mm Hg,灌胃后24 h内对照组大鼠血压无显著变化。刺参ACE抑制肽实验组SHR在灌胃后,血压均有所降低,且降幅随着灌胃量的增加而增大。其中100 mg/kg实验组的大鼠血压降幅不明显,而300 mg/kg实验组对SHR表现出良好的降压效果,灌胃后2 h,SHR的血压显著降低,在给药后4 h 收缩压降幅达到最高,为26 mm Hg,尽管与阳性对照卡托普利(10 mg/kg)的35 mm Hg存在一定的差距,但刺参肽是食源性ACE抑制肽,具有降压效果温和、安全性高、无药物副作用等优点。给药4 h后刺参ACE抑制肽实验组及卡托普利组大鼠血压逐渐回升,24 h后各组大鼠血压与空白组无显著差异(P<0.05)。Gao Mingrong等[29]从星虫中纯化得到一种ACE抑制肽,以5 mg/kg剂量一次性灌胃SHR,发现SHR在灌胃后2 h出现明显的收缩压下降,且能在4 h内持续保持较低水平。相比之下,本研究所用的是酶解多肽组分,在得率上远高于纯化肽,具有更好的应用前景。实验期间,SHR未出现咳嗽、过敏等不良反应。前期研究中以刺参性腺为原料分离了ACE抑制肽NAPHMR,其IC50为(260.22±3.71)μmol/L[30]。可见,刺参是制备ACE抑制肽的良好原料。
3 结 论
利用复合蛋白酶对刺参体壁进行酶解,通过单因素法优化获得酶解的最佳工艺参数为:料液比1∶6(g/mL)、加酶量0.8%、酶解时间6 h、pH 7.0。酶解产物经膜超滤,分子质量小于3 kDa的组分具有较高ACE抑制活性,IC50为0.8 mg/mL,对ACE表现为非竞争性抑制。此外,刺参ACE抑制肽不仅具有较好的热稳定性和pH值稳定性,同时具有较强的抵抗胃肠道蛋白酶消化的能力。口服刺参ACE抑制肽能够显著性降低SHR血压,说明其在机体内具有良好的降压功效,具有潜在的开发价值和应用前景。
参考文献:
[1]HAN H, YI Y H, LI L, et al. Triterpene glycosides from sea cucumber holothuria leucospilota[J]. Chinese Journal of Natural Medicines,2009, 7(5): 346-350. DOI:10.3724/SP.J.1009.2009.00346.
[2]郭盈莹, 丁燕, 徐飞飞, 等. 海参中主要生物活性成分研究进展[J]. 食品科学, 2014, 35(15): 335-344. DOI:10.7506/spkx1002-6630-201415066.
[3]WANG Y C, SU W, ZHANG C Y, et al. Protective effect of sea cucumber (Acaudina molpadioides) fucoidan against ethanol-induced gastric damage[J]. Food Chemistry, 2012, 133(4): 1414-1419.DOI:10.1016/j.foodchem.2012.02.028.
[4]SU X R, XU C Y, LI Y Y, et al. Antitumor activity of polysaccharides and saponin extracted from sea cucubber[J]. Journal of Clinical &Cellular Immunology, 2011, 2(1): 1-5. DOI:10.4172/2155-9899.1000105.[5]THURMOND F, TROTTER J. Morphology and biomechanics of the microfibrillar network of sea cucumber dermis[J]. Journal of Experimental Biology, 1996, 199(8): 1817-1828.
[6]SAITO M, KUNISAKI N, URANO N, et al. Collagen as the major edible component of sea cucumber (Stichopus japonicus)[J]. Journal of Food Science, 2002, 67(4): 1319-1322. DOI:10.1111/j.1365-2621.2002.tb10281.x.
[7]PERK J G, BACKER H D, GOHLKE I, et al. The fifth joint task force of the European society of cardiology and other societies on cardiovascular disease prevention in clinical practice (constituted by representatives of nine societies and by invited experts)[J]. European Heart Journal, 2012, 33(13): 1635-1701. DOI:10.1714/1264.13964.
[8]CONNOLLY A, O’KEEFFE M B, PIGGOTT C O, et al. Generation and identification of angiotensin converting enzyme (ACE) inhibitory peptides from a brewers’ spent grain protein isolate[J]. Food Chemistry,2015, 176(2): 64-71. DOI:10.1016/j.foodchem.2014.12.027.
[9]ANUGERAH D P, ROBERT J D, CHI-I C, et al. Screening, discovery,and characterization of angiotensin-I converting enzyme inhibitory peptides derived from proteolytic hydrolysate of bitter melon seed protein[J]. Journal of Proteomic, 2015, 128: 424-435. DOI:10.1016/j.jprot.2015.08.018.
[10]LASSOUED I, MORA L, NASRI R, et al. Characterization,antioxidative and ACE inhibitory properties of hydrolysates obtained from thornback ray (Raja clavata) muscle[J]. Journal of Proteomics,2015, 128(2): 458-468. DOI:10.1016/j.jprot.2015.05.007.
[11]WU Q, CAI Q F, TAO Z P, et al. Purification and characterization of a novel angiotensin I-converting enzyme inhibitory peptide derived from abalone (Haliotis discus hannai Ino) gonads[J]. European Food Research and Technology, 2015, 240(1): 137-145. DOI:10.1007/s00217-014-2315-8.
[12]BALTI R, BOUGATEF A, SILA A, et al. Nine novel angiotensin I-converting enzyme (ACE) inhibitory peptides from cuttlefish (Sepia officinalis) muscle protein hydrolysates and antihypertensive effect of the potent active peptide in spontaneously hypertensive rats[J]. Food Chemistry, 2015, 170: 519-525. DOI:10.1016/j.foodchem.2013.03.091.
[13]HAWA I, IULAIKAH M, IAMALUDIN M, et al. The potential of the coelomic fluid in sea cucumber as an antioxidant[J]. Malaysian Journal of Nutrition, 1999, 5(1): 55-59.
[14]RODRÍGUEZ E, GONZÁLEZ M, CARIDE B, et al. Nutritional value of Holothuria forskali protein and effects on serum lipid profile in rats[J]. Journal of Physiology & Biochemistry, 2000, 56(1): 39-43.DOI:10.1007/BF03179775.
[15]王洪涛. 海参肽的酶法制备工艺及抗疲劳活性研究[D]. 烟台: 烟台大学, 2007: 46-55. DOI:10.7666/d.d041565.
[16]王奕. 日本刺参胶原蛋白多肽和鱿鱼皮胶原蛋白多肽护肤活性的研究[D]. 青岛: 中国海洋大学, 2007: 20-28. DOI:10.7666/d.y1112117.
[17]KATO S, TSURUMARU S, TAGE M, et al. Neuronal peptides induce oocyte maturation and gamete spawning of sea cucumber,Apostichopus japonicus[J]. Developmental Biology, 2009, 326(1):169-176. DOI:10.1016/j.ydbio.2008.11.003.
[18]邱娟, 沈建东, 翁凌, 等. 利用牡蛎制备ACE抑制肽的工艺优化[J].食品科学, 2017, 38(16): 165-172. DOI:10.7506/spkx1002-6630-201716026.
[19]FORGHANI B, ZAREI M, EBRAHIMPOUR A, et al. Purification and characterization of angiotensin converting enzyme-inhibitory peptides derived from Stichopus horrens: stability study against the ACE and inhibition kinetics[J]. Journal of Functional Foods, 2016, 20: 276-290.DOI:10.1016/j.jff.2015.10.025.
[20]LIANG Q, WANG L, HE Y, et al. Hydrolysis kinetics and antioxidant activity of collagen under simulated gastrointestinal digestion[J].Journal of Functional Foods, 2014, 11: 493-499. DOI:10.1016/j.jff.2014.08.004.
[21]BARBANA C, BOYE J I. Angiotensin I-converting enzyme inhibitory properties of lentil protein hydrolysates: determination of the kinetics of inhibition[J]. Food Chemistry, 2011, 127(1): 94-101. DOI:10.1016/j.foodchem.2010.12.093.
[22]张艳萍, 戴志远, 张虹. 贻贝中ACE抑制活性肽的酶解制备及表征[J]. 中国食品学报, 2011, 11(1): 51-59. DOI:10.3969/j.issn.1009-7848.2011.01.009.
[23]BERNARDINI R D, MULLEN A M, BOLTON D, et al. Assessment of the angiotensin-I-converting enzyme (ACE-I) inhibitory and antioxidant activities of hydrolysates of bovine brisket sarcoplasmic proteins produced by papain and characterisation of associated bioactive peptidic fractions[J]. Meat Science, 2012, 90(1): 226-235.DOI:10.1016/j.meatsci.2011.07.008.
[24]韩青, 周丽杰, 李智博, 等. 酶法制备联合Plastein反应修饰牡蛎ACE抑制肽工艺优化[J]. 食品科学, 2017, 38(6): 104-110. DOI:10.7506/spkx1002-6630-201706016.
[25]HWANG J S. Impact of processing on stability of angiotensin I-converting enzyme (ACE) inhibitory peptides obtained from tuna cooking juice[J]. Food Research International, 2010, 43(3): 902-906.DOI:10.1016/j.foodres.2009.12.012.
[26]MÄKINEN S, JOHANNSON T, GERD E V, et al. Angiotensin I-converting enzyme inhibitory and antioxidant properties of rapeseed hydrolysates[J]. Journal of Functional Foods, 2012, 4(3): 575-583.DOI:10.1016/j.jff.2012.03.003.
[27]NI H, LI L, LIU G, et al. Inhibition mechanism and model of an angiotensin I-converting enzyme (ACE)-inhibitory hexapeptide from yeast (Saccharomyces cerevisiae)[J]. PLoS ONE, 2012, 7(5): 1529-1536. DOI:10.1371/journal.pone.0037077.
[28]XIE J, CHEN X, WU J, et al. Antihypertensive effects, molecular docking study, and isothermal titration calorimetry assay of angiotensin I-converting enzyme inhibitory peptides from Chlorella vulgaris[J]. Journal of Agricultural and Food Chemistry, 2018, 66(6):1359-1368. DOI:10.1021/acs.jafc.7b04294.
[29]GUO M R, CHEN X J, WU Y L, et al. Angiotensin I-converting enzyme inhibitory peptides from sipuncula (Phascolosoma esculenta):purification, identification, molecular docking and antihypertensive effects on spontaneously hypertensive rats[J]. Process Biochemistry,2017, 63: 84-95. DOI:10.1016/j.procbio.2017.08.009.
[30]ZHONG C, SUN L C, YAN L J, et al. Production, optimization and characterization of angiotensin converting enzyme inhibitory peptides from sea cucumber (Stichopus japonicus) gonad[J]. Food & Function,2018, 9(1): 594-603. DOI:10.1039/c7fo01388d.
