安卡红曲霉酸性蛋白酶分离纯化及部分酶学性质分析
2018-05-23袁江兰何首春黄亚明陈晓敏
袁江兰,何首春,康 旭,黄亚明,陈晓敏
(湖北工业大学生物工程与食品学院,湖北 武汉 430068)
红曲霉是亚洲地区最重要的工业发酵微生物之一,在食品发酵、红曲色素生产、次级代谢产物获取等方面应用广泛[1-2]。红曲霉在发酵过程中可形成丰富的酶系,包括蛋白酶、淀粉酶等,但产酶类型及产量因菌株种类不同而表现出较大的差异[3],有些红曲霉菌株可产生活性较高的蛋白酶,在蛋白类发酵的食品中可显著增强食品口感和营养价值,如利用于发酵鱼、肉、豆腐、酱油等高蛋白食品[4]。红曲霉一直是食品微生物领域的研究热点,但主要集中于红曲色素,虽然红曲霉蛋白酶对于高蛋白食品具有重要意义,但对红曲霉蛋白酶的研究报道却很少,已有的报道包括高粱红曲霉酸性蛋白酶[5-6]、紫色红曲霉CCRC 31499的一种胞外蛋白酶[7]、丛毛红曲霉的酸性蛋白酶等[8]。有些红曲霉常用于红腐乳发酵,如安卡红曲霉(Monascus anka)、红色红曲霉,在腐乳发酵过程中产生大量的游离氨基酸,这与红曲霉蛋白酶对大豆蛋白的水解密切相关[9]。虽然关于红曲霉酸性蛋白酶的研究报道较少,但可见关于其他属曲霉菌酸性蛋白酶的研究报道,如臭曲霉[10]、米曲霉[11]、黑曲霉[12]等。M. anka CICC 40806产红色素,来源于发酵腐乳,能制作风味良好的红腐乳,这与微生物对蛋白的降解具有密切相关性,但关于M. anka蛋白酶鲜见研究报道。本研究在利用M. anka CICC 40806发酵米渣蛋白酱油的研究过程中,发现它能产生较高活力的胞外酸性蛋白酶,因此对其进行分离纯化,并对其部分酶学性质进行初步研究,将其用于米渣蛋白的发酵降解,以评价其对这种难溶解、难降解的大米浓缩蛋白的降解效率,为红曲霉在米渣蛋白中的应用提供理论指导。
1 材料与方法
1.1 材料与试剂
M. anka CICC 40806 中国工业微生物菌种保藏管理中心;米渣 湖北德安府糖业有限责任公司。
干酪素(分析纯)、福林-酚试剂(生化纯) 国药集团化学试剂有限公司;牛血清蛋白(生化纯)Biosharp生物科技公司;CM sepharose Fast Flow 美国GE Healthcare公司。
1.2 仪器与设备
LHS-150SC恒温恒湿培养箱 上海齐欣科学仪器有限公司;FD-1真空冷冻干燥机 杭州汇尔有限公司;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)仪美国伯乐公司;Sorvall Lynx6000高速离心机 美国Thermo Fisher公司;DBS-100全自动部分收集器 上海沪西分析仪器厂。
1.3 方法
1.3.1 M. anka CICC 40806的培养
实验中共用到3 种红曲霉培养基,分别为用于红曲霉菌种保藏和活化的固体斜面PDA培养基、液体种子培养基[5]和制曲固体培养基[6]。其中制曲固体培养基按照米渣-面粉-麸皮-水质量比6∶2∶2∶7.8进行配料、蒸料,pH值自然。具体操作:斜面保藏的红曲霉菌种M. anka CICC 40806先用新鲜的固体斜面培养基进行活化培养,然后挑取少量活化菌种接种于液体种子培养基中,32 ℃恒温振荡培养5 d,再接入制曲固体培养基中,32 ℃培养3 d得成曲,期间每隔24 h翻曲1 次。
1.3.2 M. anka酸性蛋白酶的分离纯化
称取80 g成曲,加入20 倍质量的蒸馏水,40 ℃水浴搅拌提取1 h,过滤得粗酶液。然后按照20%、30%、40%、50%、60%、80%、90%硫酸铵饱和度进行分级沉淀,分别测定各饱和度硫酸铵上清液和沉淀的酸性蛋白酶活力,分别以酶活力最高处为100%作图,确定硫酸铵沉淀蛋白酶饱和度范围。硫酸铵分级沉淀所得蛋白酶4 ℃透析脱盐(透析袋截留分子质量为7 kDa),浓缩后冻干。冻干粉溶解于0.05 mol/L的pH 3.0的乳酸-乳酸钠缓冲溶液,上CM-Sepharose FF层析柱,以含0、0.10 mol/L NaCl的乳酸-乳酸钠缓冲溶液(pH 3.0)进行阶梯式梯度洗脱,280 nm波长处检测,收集穿过峰和各洗脱峰,测酸性蛋白酶活性。
1.3.3 蛋白酶活力的测定
采用福林-酚法[7]。蛋白酶活力定义:40 ℃每分钟水解酪蛋白产生1 µg酪氨酸为1 个活力单位(U)。比活力是指每毫克酶蛋白所包含的酶活力单位,在纯化过程中用比活力表示酶活可以更清晰地表示出各步骤纯化的效果和酶的纯度。
1.3.4 SDS-PAGE分析
参考Laemmli等[8]的方法。
1.3.5 酶学性质分析
1.3.5.1 最适pH值和pH值稳定性
乳酸-乳酸钠缓冲溶液(pH 2.0、3.0、4.0、5.0),磷酸缓冲溶液(pH 6.0、7.0、8.0),硼砂-氢氧化钠缓冲溶液(pH 9.0、10.0),于40 ℃进行酶促反应,分别测定酸性蛋白酶活力,其中以最高酶活力为100%,计算其他pH值条件下的相对酶活力,确定酶的最适pH值。
将纯化的酸性蛋白酶用上述缓冲体系分别调节pH值为2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0,并在40 ℃保温60 min,再于最适pH值测定酸性蛋白酶活力。以最高酶活力为100%,计算其他pH值条件下的相对酶活力,确定酶的pH值稳定性。
1.3.5.2 最适温度、温度稳定性和热失活动力学
在最适pH值下,分别于20、30、40、50、60、70 ℃进行酶催化反应,测定酸性蛋白酶活力,以最高酶活力为100%,计算其他温度添加下的相对酶活力,确定酶的最适反应温度。
在最适pH值下,将酸性蛋白酶分别置于40、50、60 ℃水浴保温0、20、40、60、80、100 min,再于40 ℃测定酸性蛋白酶活力,以保温0 min的酶活力为100%,计算其他条件下的相对酶活力,确定酶的温度稳定性。
温度失活动力学参考Li Caihong等[9]方法。将纯化后的蛋白酶液适当稀释,于50 ℃水浴保温,每间隔1 h取样并测定酸性蛋白酶活力,以保温0 h的蛋白酶活力为100%。以相对酶活力-时间作图,然后按式(1)进行指数衰减动力学模型拟合,以此分析蛋白酶的热稳定性。

式中:N0为拟合值;t为时间/h;λ为衰减指数,反映酶活力随时间衰减的速率。
1.3.5.3 耐盐性和盐稳定性
配制NaCl质量分数分别为0%、1.0%、4.0%、7.0%、10.0%、15.0%的酶液,于pH 3.0、40 ℃条件下进行催化反应,测定酸性蛋白酶活力,以NaCl质量分数为0%时的酶活力为100%,计算其余NaCl质量分数下的相对酶活力。
配制NaCl质量分数为15.0%的酶液,4 ℃条件下放置10 d,每2 d测定一次酶活力,并以初始酶活力为100%,计算相对酶活力,考察酶的盐稳定性。
1.3.6 活化能测定
根据Arrhenius方程的反应动力原理测定活化能[10]。蛋白酶在低于最适反应温度时具有较好的热稳定性,在该温度范围内蛋白酶的失活速率很低,可以忽略,其酶促反应的速率符合Arrhenius方程。由于底物过量,因此酶促反应遵循零级化学反应的规律。根据这一理论,以酪蛋白为底物,分别于10、20、30、40、50、60、70 ℃进行酶催化反应,计算反应速率,确定温度与酶促反应速率的相关性。
1.3.7 底物种类的选择性
参考林建城等[11]方法。以pH 3.0的乳酸-乳酸钠缓冲溶液配制底物质量浓度分别为1.0、3.0、6.0、9.0、12.0、15.0、18.0 g/L的酪蛋白、米渣蛋白和牛血清蛋白溶液,测定M. anka酸性蛋白酶对不同种类和质量浓度底物的催化反应速率。采用Lineweaver-Burk双倒数作图法比较M. anka蛋白酶催化不同底物反应的米氏方程中米氏常数和最大反应速率。
2 结果与分析
2.1 硫酸铵饱和度的选择
硫酸铵沉淀法可从大量粗酶中浓缩和部分纯化蛋白质,且不易使蛋白质变性[20]。如图1所示,在硫酸铵饱和度达到20%时有沉淀析出,并且上清液检测到酸性蛋白酶活力。沉淀部分的蛋白酶活力随硫酸铵饱和度的增加而增加,上清液酶活力随着硫酸铵饱和度的增加不断减小。当硫酸铵饱和度达到80%时,沉淀中酶活力接近最大值而上清液中几乎检测不到酶活力,故80%的硫酸铵饱和度可以沉淀目标蛋白[21]。因此,采用20%~80%饱和度硫酸铵分级沉淀M. anka酸性蛋白酶,硫酸铵分级区间过大会造成杂蛋白去除有限。
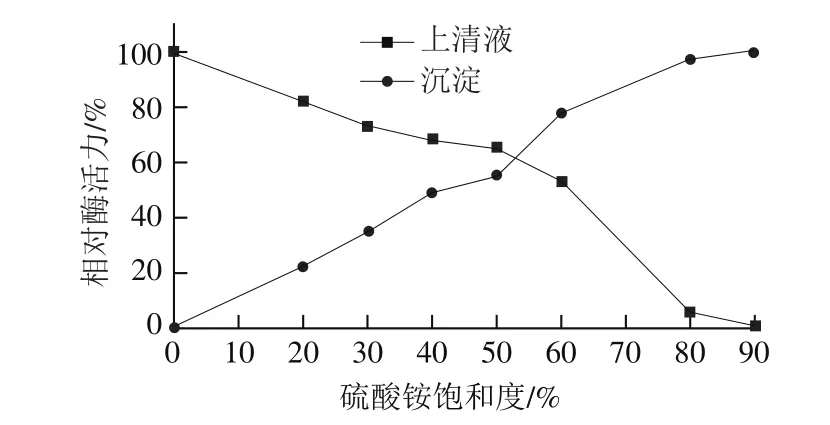
图1 不同硫酸铵饱和度对上清液及沉淀蛋白酶活力的影响Fig. 1 Effect of saturation degree of ammonium sulfate on the protease activity of supernatant fluid and precipitate
2.2 M. anka酸性蛋白酶的纯化
收集20%~80%饱和度硫酸铵盐析所得沉淀,透析后制成冻干粉。层析时首先将冻干粉溶解于0.05 mol/L的乳酸-乳酸钠缓冲溶液(pH 3.0)中,离心并经微孔滤膜过滤,然后上样于平衡好的CM-Sepharose Fast Flow层析柱,使流速控制在2 mL/min,每2 mL收集1 管,待洗脱两个柱体积后,利用含0.1 mol/L NaCl的缓冲液进行阶梯式梯度洗脱,收集并测定各管酸性蛋白酶活力,洗脱曲线如图2所示。检测到第43管酶活力最高,合并酶活力最高部分并透析、浓缩。
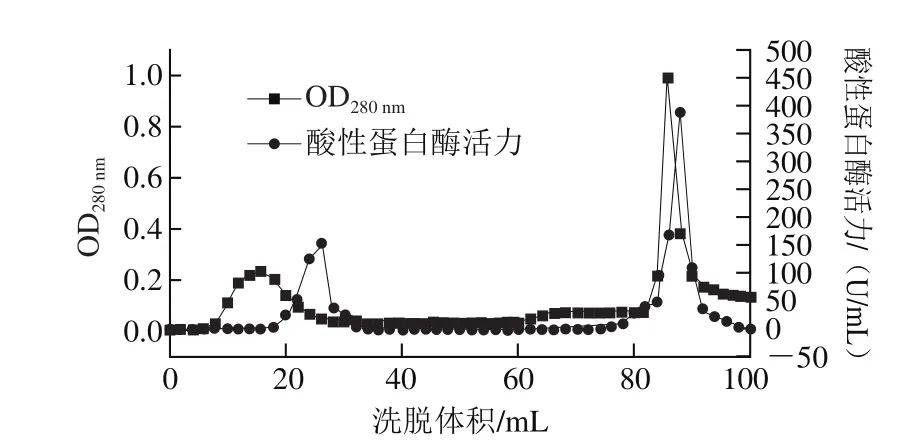
图2 M. anka酸性蛋白酶的CM Sepharose Fast Flow洗脱曲线Fig. 2 Purification of proteases from M. anka with CM Sepharose Fast Flow
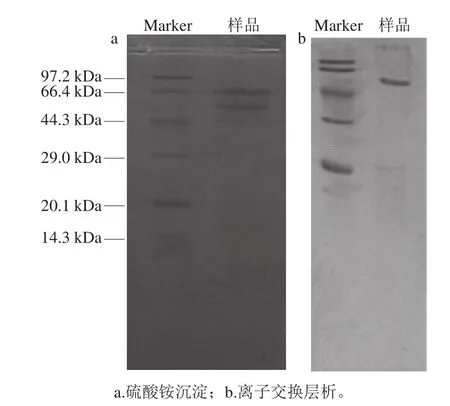
图3 M. anka酸性蛋白酶的SDS-PAGEFig. 3 SDS-PAGE of the protease from M. anka
纯化过程的样品进行SDS-PAGE,结果见图3,经硫酸铵盐析后的样品中含有2 个主要条带,阴离子交换层析收集的高酶活力部分含1 个主要条带,表明酶的纯度较高,酶分子质量介于44.3~66.4 kDa之间,明显高于高粱红曲霉酸性蛋白酶(34 kDa)[6]。M. anka酸性蛋白酶的纯化结果见表1。实验采用0.10 mol/L NaCl溶液进行阶梯式梯度洗脱,因此酸性蛋白酶流出时的NaCl浓度约为0.10 mol/L。在实验设计时,考虑到要在一块板上同时跑原样、硫酸铵分级沉淀样品和离子交换层析样品,以使结果更有可比性,但是由于各部分实验间隔时间较长,因此分别进行各样品电泳,通过Marker比对大致比较两个样品。这是实验中存在的一个缺陷,在以后的研究中要避免。
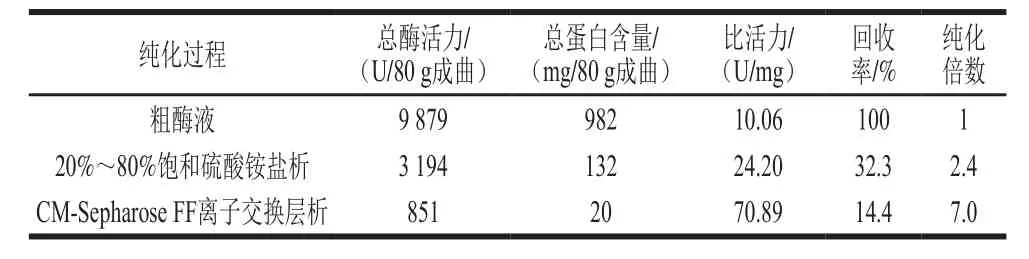
表1 M. anka酸性蛋白酶的纯化Table 1 Purification of acid protease from M. anka
2.3 pH值对M. anka酸性蛋白酶的影响
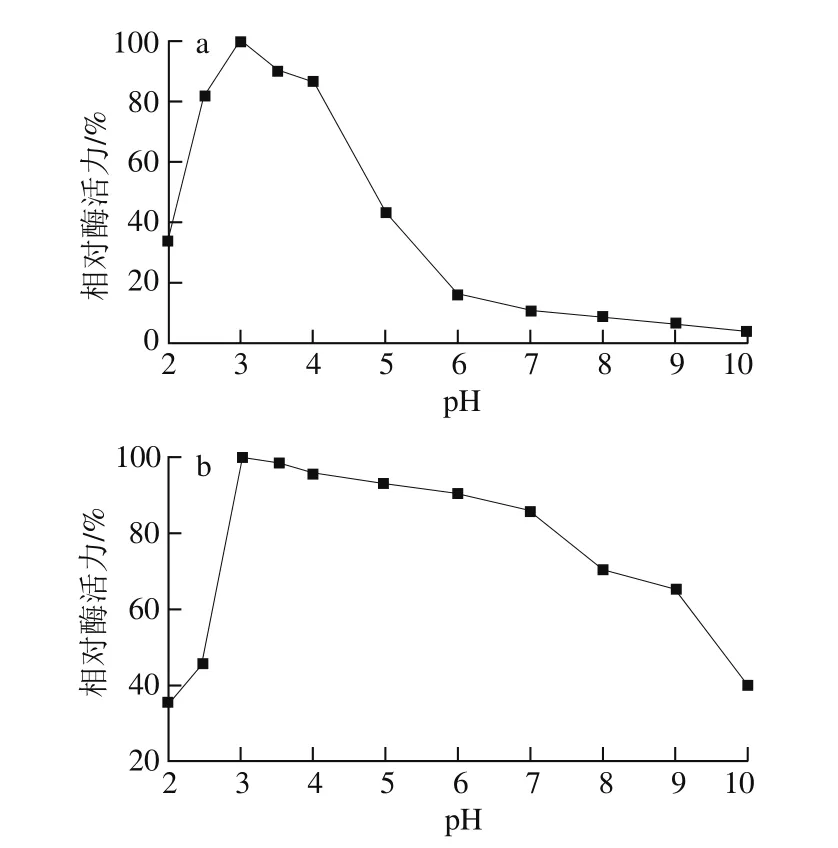
图4 M. anka纯化蛋白酶最适pH值(a)和pH值稳定性(b)Fig. 4 Optimum pH (a) and pH stability (b) of purified protease from M. anka
图4a表明,M. anka酸性蛋白酶的最适反应pH值为3.0,与高粱红曲霉、宇佐美曲霉等酸性蛋白酶相同[6,22],而臭曲霉的最适反应pH值为5.0[10],说明不同来源的酸性蛋白酶结构和性质可能存在较大差别。pH值低于2.5或高于4.0时,酶催化活力迅速下降。由图4b可见,稳定的pH值范围为3.0~7.0,与高粱红曲霉酸性蛋白酶相似(3.0~6.0)[6]。在2.0~3.0的范围内,pH值对M. anka酸性蛋白酶的活力影响非常显著,pH值小幅下降会引起酶活力迅速下降,当pH值为2.0时,酶基本失活。而当pH值大于7.0,随着pH值增加酶活力也迅速降低。这均与酶结构改变有关,与丛毛红曲霉胞外酸性蛋白酶规律相似[8]。pH值改变导致酶蛋白空间构象改变,甚至引起酶变性失活。在最适pH值时,酶的解离状态往往是最有利于该酶与底物结合并发生催化反应,使酶活力达到最大。另外,pH值还会影响到代谢产物的稳定性[23]。
2.4 温度对M. anka酸性蛋白酶的影响
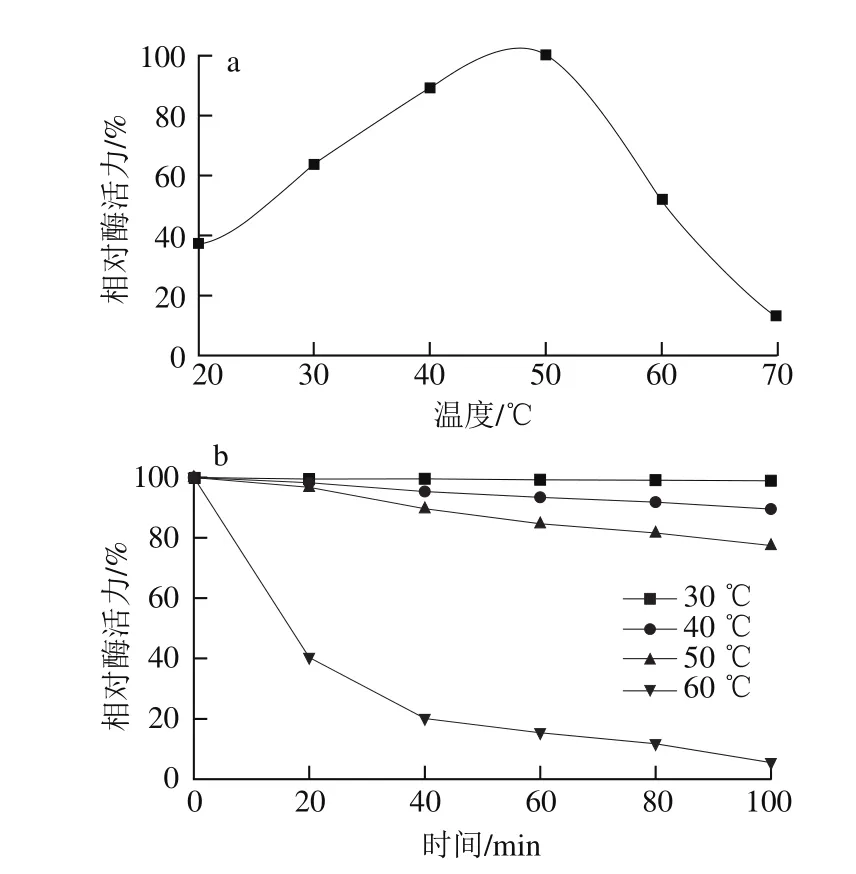
图5 M. anka酸性蛋白酶的最适反应温度(a)和温度稳定性(b)Fig. 5 Optimum temperature (a) and temperature stability (b) of acid protease from M. anka
由图5可知,M. anka酸性蛋白酶的最适温度约为50 ℃,低于50 ℃时较稳定,温度高于50 ℃时,酶活力迅速下降,这与紫色红曲霉白色突变株(M. purpureus mutant W1)酸性蛋白酶相似[23]。较高温度对酶促反应具有促进作用,但温度超过一定范围时酶活力开始下降,反映了酶作为生物催化剂的本质[28]。
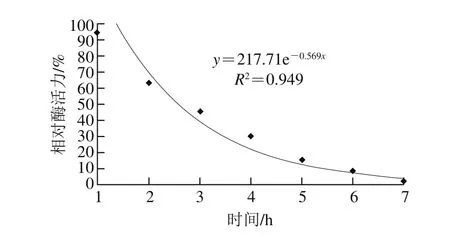
图6 M. anka酸性蛋白酶热失活曲线Fig. 6 Heat inactivation curve of acid protease from M. anka
M. anka酸性蛋白酶的最适反应温度约50 ℃,在50 ℃进行酶的热失活动力学研究,结果见图6。根据一级指数衰减动力学模型方程求酶衰减指数为0.569。黑曲霉CICC2377、米曲霉HN3042衰减常数分别为0.76、0.50[24]。臭曲霉酸性蛋白酶也符合一级动力学模型,但其热稳定性高,温度从55 ℃升高至70 ℃时,失活速率常数由0.018 h-1增加至5.06 h-1,半衰期由37.6 h缩短至0.13 h[10]。衰减指数越大表明酶对温度的耐受性越差,温度稳定性也越差。由此可见,温度对不同来源的真菌酸性蛋白酶的影响有很大差别。
2.5 NaCl对M. anka酸性蛋白酶的影响
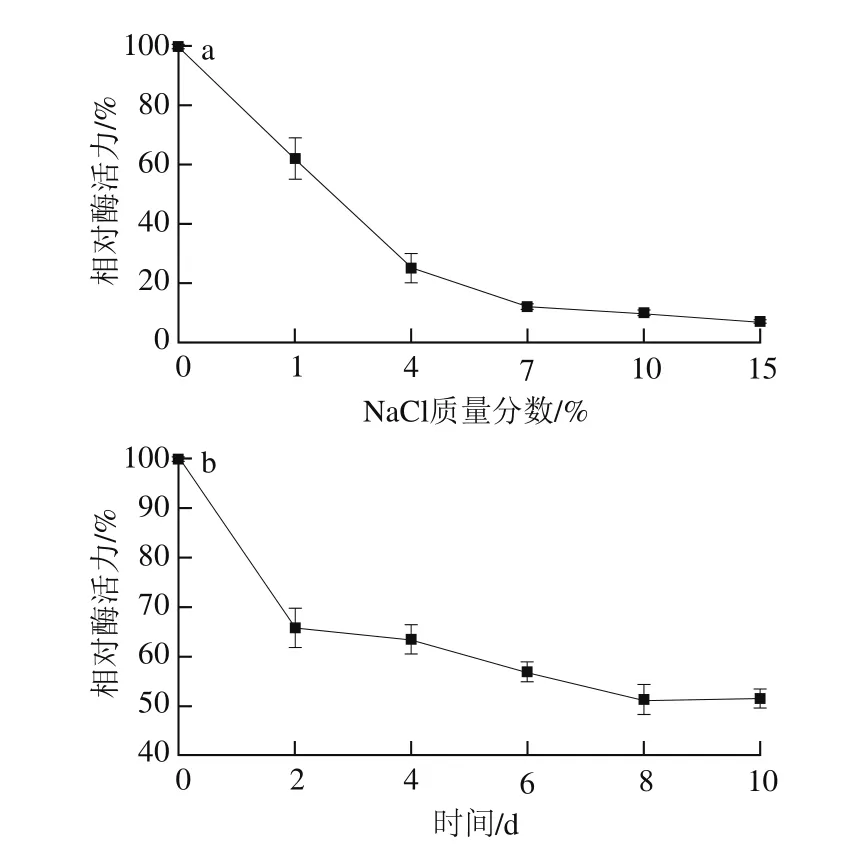
图7 NaCl对蛋白酶活力(a)和稳定性(b)的影响Fig. 7 Effect of NaCl concentration on the activity (a) and stability (b)of purified protease
红曲霉常用于发酵食品中,因此盐对微生物及其酶系的影响非常重要。由图7a可知,NaCl对M. anka酸性蛋白酶具有一定的抑制作用,随着NaCl质量分数的升高,相对酶活力逐渐减小。当质量分数为1%时,相对酶活力为62%,当NaCl质量分数达到7%时,相对酶活力仅为12%。而在8%的NaCl质量分数下,米曲霉CICIM F0899剩余蛋白酶活力为50%[25]。这种耐盐性的明显差异与酶的结构有直接关系。米曲霉耐盐性很好,因此在高盐环境中仍然能保持较高酶活力。由图7b可知,在15% NaCl质量分数条件下进行发酵,2 d后M. anka酸性蛋白酶活力缓慢下降。图7数值上的差异与初始酶液的活力值有关。实验采用相对酶活力来评价耐盐性,图7a是酶液在NaCl溶液中保持1 h后所测结果,由于无盐酶液活性较高,所以含盐酶液活力下降导致相对酶活力下降明显;而图7b是酶液在15% NaCl溶液中保持1 h后再测定计算所得数据,初始酶活力已经明显下降,因此其他所有样品计算所得相对酶活力较高,事实上,15% NaCl溶液中保存的酶液活力已经很低,说明在高盐环境下M. anka酸性蛋白酶活力基本丧失。
2.6 M. anka酸性蛋白酶催化反应的活化能
反应温度每提高10 ℃所增加的反应速率为反应温度系数,各温度反应速率和反应温度系数见表2。在低于50 ℃时反应速率随反应温度的升高而增加,但40~50 ℃之间增加缓慢,高于50 ℃则反应速率迅速降低。在酶促反应中,温度升高,反应速率加快,但同时酶的失活速率也加快,所以酶促反应的速率是由反应速率和失活速率两方面作用叠加的结果。因此,在高于50 ℃条件下,随着温度的升高,蛋白酶的失活速率高于反应速率,而低于50 ℃时,失活速率小于反应速率,甚至可以忽略不计,符合Arrhenius方程。
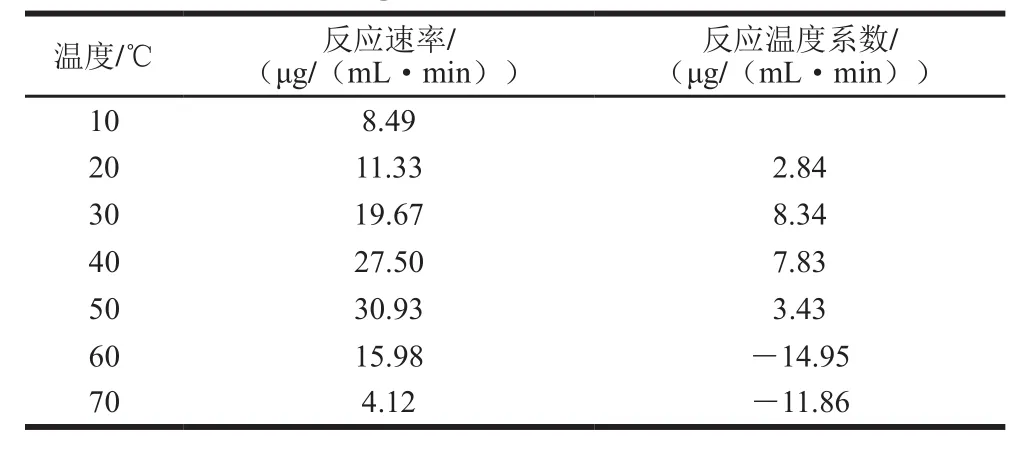
表2 不同温度段的反应温度系数Table 2 Q at different temperature zones
由于设定的底物质量浓度在反应10 min内对反应速率无影响,因此该酶促反应为零级反应[28],符合零级反应公式:

式中:r为反应速率/(μg/(mL·min));Cs为底物质量浓度/(μg/mL);t为反应时间/min;n为常数;k为反应速率常数。
Arrhenius方程:

式中:A为指前因子;Ea为反应活化能/(kJ/mol);R为气体常数(8.31 J/(mol·K));T为绝对温度/K。

图8 酶促反应速率的Arrhenius图Fig. 8 Relationship between reaction rate and temperature according to Arrhenius equation
根据Arrhenius方程,以lnk-1/T作图,因为r=nk,以lnr-1/T作图即可得斜率条件下反应温度与反应速率的关系如图8表示。可得M. anka酸性蛋白酶在10~50 ℃条件下水解酪蛋白的反应活化能Ea为28.85 kJ/mol。米曲霉HN3042和黑曲霉CICC 2377酸性蛋白酶Ea分别为64.61 kJ/mol和63.11 kJ/mol[17]。酶对活化能的影响源自于酶与底物的结合能力,酶与底物结合形成的复合物所含能量较低,从而使反应易于发生,因此酶的结合结构域的构象对反应的活化能有直接影响。酶可以通过降低活化能来促进一些原本很慢的生化反应得以快速进行[29]。已知化学反应速率与其活化能的大小密切相关,活化能越低,反应速率越快,可见M. anka酸性蛋白酶催化反应速率相对较高,因此M. anka用于发酵高蛋白食品对蛋白质快速降解有利[30]。
2.7 M. anka酸性蛋白酶的底物选择性及米氏常数
为消除蛋白酶失活对反应速率的影响,将反应温度设定为40 ℃,反应时间为10 min,以不同质量浓度的酪蛋白、米渣蛋白、牛血清蛋白为底物,用每毫升稀释酶液经阴离子交换层析洗脱后,收集到酸性蛋白酶活力高的部分,合并后透析、浓缩,低温存放。测定时统一取酶样稀释,用毫升计量,以比较对底物的选择性。每分钟水解酪蛋白产生的产物的微克数表示反应速率,测定底物种类和浓度对反应速率的影响。
假定该蛋白酶以酪蛋白为底物水解生成酪氨酸的反应符合米氏方程,即:

式中:r为反应速率/(μg/(mL·min));rmax为最大反应速率/(μg/(mL·min));Km为米氏常数/(μg/mL);Cs为底物质量浓度/(μg/mL)。
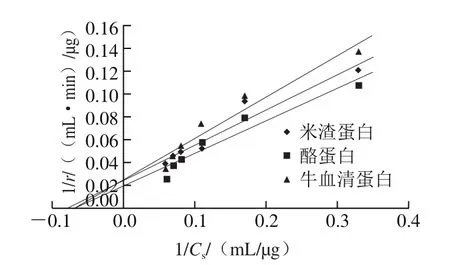
图9 Lineweaver-Burk作图法绘制米氏方程曲线Fig. 9 Lineweaver-Burk double reciprocal plot of Michaelis-Menten equation
如图9所示,Lineweaver-Burk作图法所得米渣蛋白、酪蛋白及牛血清蛋白3 种底物的线性回归方程分别为:y=0.305 8x+0.024 5(R2=0.929 1),y=0.283 6x+0.019 2(R2=0.925 9),y=0.357 0x+0.025 0(R2=0.935 3)。据方程求得米渣蛋白、酪蛋白及牛血清蛋白的Km值分别为14.77、12.48、20.05 mg/mL。Km与底物催化效率有关,Km值越小,反应特异性越高,反应动力、反应速率和产物积累越高。M. anka蛋白酶对于酪蛋白和米渣蛋白具有较好的亲和性,而对牛血清蛋白的亲和性较差,与黑曲霉SL2-111菌株酸性蛋白酶具有结果的相似性[31]。这可能与底物特性和蛋白酶的肽键选择性有密切联系,酪蛋白是典型的疏水性蛋白,含有较高比例的脯氨酸和亮氨酸,而牛血清蛋白是一种亲水性蛋白,其肽链中疏水性氨基酸的比例相对较低。说明这种酸性蛋白酶对疏水氨基酸构成的肽键都有很强的切割能力[32]。
3 讨论与结论
已有研究结果显示,固体制曲培养M. anka CICC 40806,每克成曲酸性蛋白酶活力达到1 300 U。同样实验条件下利用米曲霉HN3.042制曲,每克成曲酸性蛋白酶活力约600 U,而中性和碱性蛋白酶分别约为1400 U和600 U[29],米曲霉HN3.042具有很强的蛋白酶产生能力,但其酸性蛋白酶活力相对较低,比较可知,M. anka CICC 40806具有较强的分泌酸性蛋白酶能力,具有较好的研究和应用价值。另一方面,底物对霉菌的酸性蛋白酶产生能力有明显影响[30],因此从酶的生产角度考虑,应注意优化产酶培养基和培养条件,而产酶培养底物的选择性可能与蛋白酶作用的底物选择性具有相关性。从M. anka CICC 40806的成曲中提取获得粗酶液,再通过硫酸铵沉淀和CM Sepharose Fast Flow柱层析,经两步分离纯化,得到比活力为70.89 U/mg的胞外酸性蛋白酶,SDS-PAGE结果显示为一个主要蛋白质条带,说明酶基本达到电泳纯,但仍然可见少量杂蛋白条带,需要进一步优化纯化步骤。研究表明M. anka酸性蛋白酶适宜的pH值为3.0~4.0,在pH 3.0~7.0范围内较为稳定,酶的适宜反应温度为50 ℃,60 ℃时很快失活。M. anka酸性蛋白酶具有一定的耐盐性,在低于4% NaCl的环境中相对酶活力高于20%。M. anka酸性蛋白酶对米渣蛋白和酪蛋白的催化效率较高,因此可能在米渣蛋白的发酵降解中发挥较好的作用。对M. anka胞外酸性蛋白酶的研究也为红曲霉在高蛋白食品中的应用提供了理论指导,关于其结构和催化特异性等方面还有待于进一步研究。
参考文献:
[1]周文斌, 贾瑞博, 李燕, 等. 红曲色素组分、功效活性及其应用研究进展[J]. 中国酿造, 2016, 35(7): 6-10. DOI:10.11882/j.issn.0254-5071.2016.07.002.
[2]CHENG M J, WU M D, YUAN G F, et al. Secondary metabolites produced by the fungus Monascus pilosus, and their anti-inflammatory activity[J]. Phytochemistry Letters, 2012, 5(3): 567-571. DOI:10.1016/j.phytol.2012.05.015.
[3]HSU W H, PAN T M. Monascus purpureus-fermented products and oral cancer: a review[J]. Applied Microbiology and Biotechnology,2012, 93(5): 1831-1842. DOI:10.1007/s00253-012-3891-9.
[4]RAHAYU Y Y, YOSHIZAKI Y, YAMAGUCHI K, et al. Key volatile compounds in red koji-shochu, a Monascus-fermented product, and their formation steps during fermentation[J]. Food Chemistry, 2017,224: 398-406. DOI:10.1016/j.foodchem.2016.12.005.
[5]HWANG J, HSEU T H. Specificity of the acid protease from Monascus kaoliang towards the B-chain of oxidized insulin[J]. Biochimica Et Biophysica Acta, 1980, 614(2): 607-612. DOI:10.1016/0005-2744(80)90250-8.
[6]TSAI M S, HSEU T H, SHEN Y S. Purification and characterization of an acid protease from Monascus kaoliang[J]. International Journal of Peptide and Protein Research, 1978, 12(5): 293-302. DOI:10.1111/j.1399-3011.1978.tb02900.x.
[7]LIANG T W, LIN J J, YEN Y H, et al. Purification and characterization of a protease extracellularly produced by Monascus purpureus,CCRC31499 in a shrimp and crab shell powder medium[J]. Enzyme &Microbial Technology, 2006, 38(1/2): 74-80. DOI:10.1016/j.enzmictec.2005.04.023.
[8]NILANTHA L P L, YOICHI T, HIROHIDE T, et al. Purification and characterisation of two extracellular acid proteinases from Monascus pilosus[J]. Food Chemistry, 2010, 121(4): 1216-1224. DOI:10.1016/j.foodchem.2010.02.007.
[9]FANG L, TACHIBANA S, TAIRA T. Purification and characterization of a new type of serine carboxypeptidase from Monascus purpureus[J].Journal of Industrial Microbiology & Biotechnology, 2004, 31(1): 23-28.DOI:10.1007/s10295-004-0107-z.
[10]SOUZA P M, ALIAKBARIAN B, FILHO E X, et al. Kinetic and thermodynamic studies of a novel acid protease from Aspergillus foetidus[J]. International Journal of Biological Macromolecules, 2015,81: 17-21. DOI:10.1016/j.ijbiomac.2015.07.043.
[11]VISHWANATHA K S, RAO A G, SINGH S A. Acid protease production by solid-state fermentation using Aspergillus oryzae MTCC 5341: optimization of process parameters[J]. Journal of Industrial Microbiology & Biotechnology, 2010 37(2): 129-138. DOI:10.1007/s10295-009-0654-4.
[12]SIALA R, FRIKHA F, MHAMDI S, et al. Optimization of acid protease production by Aspergillus niger I1 on shrimp peptone using statistical experimental design[J]. Scientific World Journal, 2012(3):564932. DOI:10.1100/2012/564932.
[13]朱振元, 满金浩, 周家萍, 等. 酿酒酵母对红曲霉菌丝体生长的影响[J].食品研究与开发, 2009, 30(4): 25-29.
[14]YUAN J L, ZHONG W X, JIN Y, et al. Fermentation technology and quality of sauce prepared from rice dreg protein[J]. Journal of the Institute of Brewing, 2015, 121: 449-454. DOI:10.1002/jib.241.
[15]上海市酿造科学研究所. 蛋白酶活力测定法: SB/T 10317—1999[S].北京: 中国标准出版社, 1999: 230-232.
[16]LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227: 680-685.DOI:10.1038/227680a0.
[17]LI C, XU D, ZHAO M, et al. Production optimization, purification,and characterization of a novel acid protease from a fusant by Aspergillus oryzae, and Aspergillus niger[J]. European Food Research and Technology, 2014, 238(6): 905-917. DOI:10.1007/s00217-014-2172-5.
[18]HUANG Y G, WU Q, XU Y. Isolation and identification of a black Aspergillums strain and the effect of its novel protease on the aroma of Moutai-flavoured liquor[J]. Journal of the Institute of Brewing, 2014,120: 268-276. DOI:10.1002/jib.135.
[19]林建城, 王国玲, 闵志勇. 日本鳗鲡肠道蛋白酶的分离纯化及其酶学性质研究[J]. 西北农林科技大学学报(自然科学版), 2015, 43(1):45-52. DOI:10.13207/j.cnki.jnwafu.2015.01.032.
[20]黄光荣, 应铁进, 戴德慧, 等. 嗜热芽孢杆菌蛋白酶HS08的分离纯化研究[J]. 食品科学, 2007, 28(4): 179-181. DOI:10.3321/j.issn:1002-6630.2007.04.040.
[21]曾小波, 伍丽瑜, 宋小焱, 等. 酱油曲蛋白酶的分离及催化性质研究[J]. 中国调味品, 2010, 35(1): 50-52. DOI:10.3969/j.issn.1000-9973.2010.01.009.
[22]DENG L L, WANG Z X, YANG S, et al. Improvement of functional properties of wheat gluten using acid protease from Aspergillus usamii[J]. PLoS ONE, 2016, 11(7): e0160101. DOI:10.1371/journal.pone.0160101.
[23]马歌丽, 孙浩, 韩甜甜, 等. 红曲色素液体发酵研究[J]. 郑州轻工业学院学报(自然科学版), 2013, 28(5): 11-15. DOI:10.3969/j.issn.2095-476X.2013.05.003.
[24]杨薇, 赵树欣, 张放. 红曲霉白色突变株固态发酵生产酸性蛋白酶的研究[J]. 现代食品科技, 2008, 24(5): 462-465. DOI:10.3969/j.issn.1673-9078.2008.05.017.
[25]郑宝东. 食品酶学[M]. 南京: 东南大学出版社, 2006: 88-89.
[26]徐德峰. 高活力酸性蛋白酶曲霉融合子的选育及其在酱油发酵中的初步应用[D]. 广州: 华南理工大学, 2010.
[27]WANG D, ZHENG Z Y, FENG J, et al. A high salt tolerant neutral protease from Aspergillus oryzae: purification, characterization and kinetic properties[J]. Applied Biochemistry and Microbiology, 2013,49(4): 378-385. DOI:10.1134/S0003683813040170.
[28]张青, 许学书, 谢静莉, 等. 米曲霉蛋白酶动力学特性的研究[J]. 食品科学, 2007, 28(6): 213-217. DOI:10.3321/j.issn:1002-6630.2007.06.048.
[29]笪久香, 胡亚云, 栾广忠, 等. 无机盐对酶促大豆蛋白胶凝特性的影响[J]. 中国粮油学报, 2015(6): 15-21. DOI:10.3969/j.issn.1003-0174.2015.06.004.
[30]YASUDA M, TACHIBANA S, KUBA-MIYARA M. Biochemical aspects of red koji and tofuyo prepared using Monascus, fungi[J].Applied Microbiology and Biotechnology, 2012, 96(1): 49-60.DOI:10.1007/s00253-012-4300-0.
[31]曹治云. 黑曲霉产酸性蛋白酶催化机制和稳定剂研究[D]. 福州: 福建师范大学, 2005. DOI:10.7666/d.y768963.
[32]马俊阳, 诸葛斌, 方慧英, 等. 米曲霉蛋白酶的分离纯化及酶学性质研究[J]. 微生物学通报, 2014, 41(1): 83-89. DOI:10.13344/j.microbiol.china.130068.
[33]邓冲, 钟文秀, 李传雯, 等. 米渣酱油与传统大豆酱油酿造过程的动态研究[J]. 中国调味品, 2016, 41(4): 1-6; 28. DOI:10.3969/j.issn.1000-9973.2016.04.001.
[34]SETHI B K, JANA A, NANDA P K, et al. Thermostable acidic protease production in Aspergillus terreus NCFT 4269.10 using chickling vetch peels[J]. Journal of Taibah University for Science,2016, 10: 571-583. DOI:10.1016/j.jtusci.2015.11.001.
