青稞β-葡聚糖对淀粉体外消化性的影响
2018-05-23马小涵赵天天易继武
邓 婧,马小涵,赵天天,易继武,刘 雄,,*
(1.西南大学食品科学学院,重庆 400715;2.昌都市君亲农业科技开发有限公司,西藏 昌都 854000)
青稞即裸大麦,主产于我国青海、青藏高原等地,具有高蛋白质、高膳食纤维、低脂、低糖等特点[1]。青稞含有丰富的β-葡聚糖(β-glucan,BG),平均含量为5%,远高于其他谷类作物[2]。BG是一类高分子黏性多糖,也是一种水溶性膳食纤维[3]。有研究指出,BG在肠道内形成黏性溶液能阻碍淀粉分解和糖类吸收,从而延缓淀粉消化和血糖浓度升高,具有降低餐后血糖和胰岛素水平的效果[4-9]。青稞相对大多数谷物具有较低的血糖生成指数和淀粉消化率,更有益于人体健康,这与其中的BG密切相关[10]。
目前关于青稞BG的研究多集中在提取工艺的改进和理化性质的研究[11-17],关于青稞BG对淀粉体外消化性影响的研究鲜见报道。因此,本实验选择日常主食中重要的粮食品种小麦粉作为对照,在对比青稞全粉和小麦粉体外消化性基础上,进一步研究青稞BG质量浓度和分子质量对青稞淀粉体外消化性的影响,从青稞BG流变学特性及其与α-淀粉酶的相互作用方面,研究青稞BG抑制淀粉消化机理,旨在为青稞降血糖机理提供理论参考。
1 材料与方法
1.1 材料与试剂
青稞全粉由昌都市君亲农业科技开发有限公司提供,将青稞去壳后粉碎过80 目筛得到青稞全粉;普通小麦粉 五得利集团;耐高温α-淀粉酶 阿拉丁试剂有限公司;α-淀粉酶(A3403,酶活力500 U/mg)、胃蛋白酶(P7000,酶活力250 U/mg)、胰酶(P7545,酶活力8 U/mg)、Dextran系列葡聚糖 美国Sigma公司;交联BG测定试剂盒 爱尔兰Megazyme公司;透析袋(1 000 u) 北京索莱宝科技有限公司;凝胶色谱仪、TSK gel G6000PWXL色谱柱 日本Tosoh公司;其他化学试剂均为国产分析纯。
1.2 仪器与设备
HH-4恒温水浴锅 上海青浦沪西仪器厂;JJ-1电动搅拌器 金坛市科析仪器公司;PHS-3C型酸度计 上海三信仪表厂;4K15型高速离心机 美国Sigma公司;LGJ-10真空冷冻干燥机 北京松源华兴科技公司;纳米粒度及Zeta电位分析仪 英国马尔文公司;UV-2450型紫外分光光度计、LC-20A型液相色谱仪 日本岛津公司;F-2500型荧光分光光度计 日本日立公司;DHR-1型流变仪 美国TA仪器公司。
1.3 方法
1.3.1 青稞BG的分离纯化
青稞BG的分离纯化在文献方法[18-20]基础上进行一些改进。青稞全粉中按照料液比1∶8(g/mL)加入75%乙醇溶液,80 ℃回流2 h,冷却后弃上清液,再加入无水乙醇浸没湿粉15 min,去除乙醇,70 ℃烘干待用,以脱脂和除内源酶。称取一定量脱脂、灭酶后的青稞全粉,按照料液比1∶15(g/mL)加入蒸馏水,调pH 8.0并于80 ℃搅拌提取2 h,6 000 r/min离心20 min,收集上清液;调pH 6.4,按照2 U/mL加酶量加入耐高温α-淀粉酶,于90 ℃恒温水浴40 min;待溶液冷却后,调pH 8.0,按体积比50∶1加入1%胰蛋白酶溶液,于37 ℃恒温水浴30 min后灭酶,待溶液冷却后,调pH 4.5,4 ℃静置过夜;6 000 r/min离心20 min,收集上清液,上清液减压浓缩至原体积1/2,加入溶液4 倍体积的95%乙醇溶液,4 ℃静置过夜,6 000 r/min离心20 min,收集沉淀并以蒸馏水复溶,再于1 000 u透析袋透析72 h,将透析液减压浓缩后加入溶液4 倍体积95%乙醇溶液,6 000 r/min离心20 min,收集沉淀并冷冻干燥,即得青稞BG。
1.3.2 青稞淀粉的提取
青稞淀粉的提取在文献方法[21-23]基础上进行一些改进。青稞全粉中按照料液比1∶5(g/mL)加入0.5%的NaOH溶液,于40 ℃搅拌提取4 h,调溶液pH 7.0,5 000 r/min离心10 min,弃上层浓稠液体,刮去上层褐色沉淀,取下层沉淀加水制浆,过200 目筛,5 000 r/min离心10 min,弃上清液,刮去上层灰色沉淀,收集下层白色沉淀,分别用95%乙醇和蒸馏水各洗涤3 次,离心收集沉淀并冷冻干燥,即得青稞淀粉。
1.3.3 不同分子质量青稞BG的制备
采用酸水解法[5]制备不同分子质量青稞BG。分别配制2%青稞BG溶液,用5 mol/L磷酸作为酸解液并调节溶液pH 2.0,于80 ℃恒温水浴中水解不同时间(15、30、60 min和120 min)。调pH 7.0,加入溶液4 倍体积95%乙醇溶液,6 000 r/min离心20 min,收集沉淀并以蒸馏水复溶,再于1 000 U透析袋透析72 h,将透析液减压浓缩后加入溶液4 倍体积95%乙醇溶液,6 000 r/min离心20 min,收集沉淀并冷冻干燥,即得不同分子质量青稞-BG。
1.3.4 基本组分测定
脂肪含量测定:GB 5009.6—2016《食品中脂肪的测定》;蛋白质含量测定:GB 5009.5—2016《食品中蛋白质的测定》;淀粉含量测定:GB 5009.9—2016《食品中淀粉的测定》;粗纤维含量测定:GB/T 5515—2008《粮食中粗纤维素含量测定 介质过滤法》;BG含量测定:NY/T 2006—2011《谷物及其制品中β-葡聚糖含量的测定》;还原糖含量测定:3,5-二硝基水杨酸比色法。
1.3.5 青稞BG分子质量的测定
采用高效凝胶色谱法,分析条件为:LC-20A型液相色谱系统,TSK gel G6000PWXL凝胶色谱柱,示差折光检测器,流动相超纯水,柱温30 ℃,流速0.7 mL/min,进样量20 μL。
1.3.6 青稞BG粒径分析
使用纳米粒度及Zeta电位仪分析不同分子质量1 mg/mL青稞BG溶液粒度分布,测定前溶液需超声分散1 min。
1.3.7 青稞BG流变学性质研究
静态剪切速率与黏度关系扫描,测定条件为:夹具40 mm,2 °椎板,温度37 ℃,应变力为1.0%,剪切速率0.1~100 s-1,采集变量点数目为60 个。然后用牛顿幂律方程进行拟合。拟合公式如下:

式中:δ为剪切应力/Pa;γ为剪切速率/s-1;K为稠度系数/(Pa·s-n);n为流体行为指数,其大小表示液体偏离牛顿指数的程度,n小于1时样品溶液为剪切变稀的假塑性,n为1时,溶液为牛顿流体,n大于1时,为胀塑性流体。
动态黏弹性扫描,测定条件为:夹具40 mm,2 °椎板,温度37 ℃,应变力为1.0%,角频率0.1~100 rad/s,采集变量点数目为20 个。然后用牛顿幂律方程进行拟合。拟合公式如下:

式中:ω为角频率;G’为弹性模量;G”为黏性模量;K’、K”、n’、n”均为拟合参数。
1.3.8 青稞BG对α-淀粉酶的荧光淬灭作用[24-26]
采用10 mm光径的四面通光石英比色皿,设置固定激发波长为280 nm,发射与激发狭缝宽度为5 nm,分别扫描不含青稞BG、含有不同质量浓度青稞BG和不同分子质量青稞BG的0.5 mg/mL α-淀粉酶在300~400 nm波长范围的荧光光谱。
1.3.9 青稞全粉体外模拟消化实验[27]
分别取10 g青稞全粉和小麦粉,加入一定量蒸馏水于沸水浴中糊化5 min,均质处理后加入模拟人工唾液1.6 mL(α-淀粉酶质量浓度为1.3 mg/mL),于37 ℃恒温振荡摇床中振荡10 min;调消化液pH 1.2,加入模拟人工胃液20 mL(胃蛋白酶质量浓度为3.2 mg/mL),于37 ℃恒温振荡摇床中振荡2 h(120 r/min);调消化液pH 6.8,加入模拟人工肠液2 mL(胰酶质量浓度为10 mg/mL),于37 ℃恒温振荡摇床中振荡2 h(120 r/min),冰浴中冷却终止反应,调消化液pH值中性;消化液于6 000 r/min离心20 min,收集上清液并定容,采用DNS法测定消化液中还原糖含量,以淀粉水解率表示对淀粉消化的程度,以小麦粉作对照。淀粉水解率公式如下:

1.3.10 青稞BG质量浓度和分子质量对青稞淀粉消化性影响实验
分别取2 g青稞淀粉,加入一定量蒸馏水于沸水浴中糊化5 min,分别加入50 mL同分子质量不同质量浓度(5、10、15、20 mg/mL)和同质量浓度(10 mg/mL)不同分子质量的青稞BG溶液,后续操作同1.3.9节。
1.4 数据分析
采用Microsoft Excel和SPSS分析软件对数据进行整理与分析,结果均以 ±s表示,实验重复次数n=3。
2 结果与分析
2.1 青稞全粉与普通小麦粉基本成分和体外消化性比较
选择具有代表性的小麦粉作为对照,比较青稞全粉和小麦粉基本成分和体外消化性。由表1可知,青稞全粉中淀粉含量显著低于小麦粉(P<0.05),膳食纤维和BG含量显著高于小麦粉(P<0.05)。
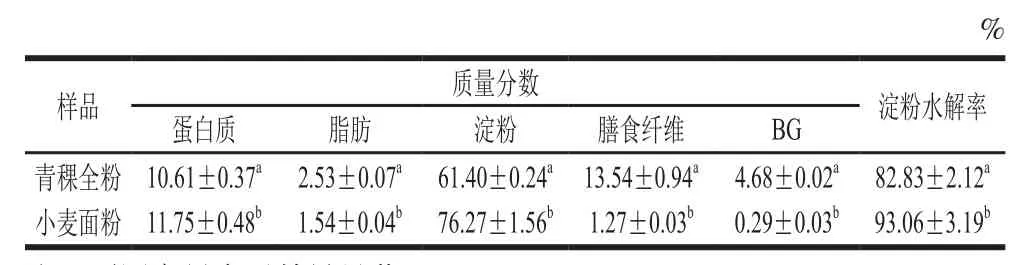
表1 青稞全粉、小麦粉基本成分和体外淀粉水解率比较Table 1 Comparison of main components and starch digestibility in vitro of highland barley and wheat flour
以小麦粉作为对照,连续模拟青稞全粉在口腔、胃和小肠中的消化过程。青稞全粉中淀粉水解率(82.83±2.12)%显著低于普通小麦粉中淀粉水解率(93.06±3.19)%(P<0.05),表明青稞全粉中淀粉体外消化率低于小麦粉中淀粉体外消化率。谷物在唾液淀粉酶、胰酶的作用下,谷物中的淀粉被水解,不同谷物由于成分上的差异造成其消化程度不同。同一条件下,青稞全粉中淀粉水解率显著低于普通小麦粉中淀粉水解率,这可能是由于青稞全粉中较高含量的膳食纤维(BG等非淀粉多糖)影响淀粉的消化性所致。为探究这一可能性,分别提取青稞BG和青稞淀粉进行体外模拟消化实验,验证这一猜想。
2.2 青稞BG质量浓度对青稞淀粉体外消化性的影响
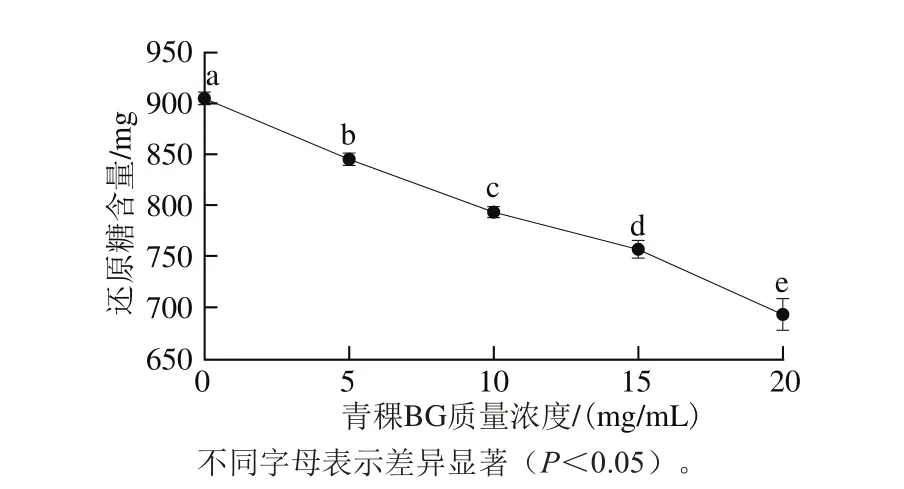
图1 青稞BG质量浓度对青稞淀粉体外消化性的影响Fig. 1 Effect of highland barley β-glucan at different concentrations on starch digestibility in vitro
如图1所示,青稞淀粉消化分解生成的还原糖含量(单位为mg)按从大到小排序为:904.98±5.44(空白组)>845.05±5.04(5 mg/mL BG)>792.38±3.14(10 mg/mL BG)>756.06±8.32(15 mg/mL BG)>692.49±14.41(20 mg/mL BG)。随青稞BG质量浓度增加,青稞淀粉消化分解生成的还原糖逐渐降低,且显著低于空白对照组(P<0.05),这表明青稞BG质量浓度越大,青稞淀粉消化越慢,青稞BG能够部分抑制青稞淀粉消化程度,提高青稞淀粉的抗消化性。这可能是由于随青稞BG质量浓度增加,消化液黏度增大,流动性降低,青稞BG易形成凝胶部分覆盖在淀粉颗粒表面,阻碍α-淀粉酶与淀粉颗粒接触,增加淀粉酶酶解阻力,使青稞淀粉分解速率变慢。
2.3 青稞BG分子质量对青稞淀粉体外消化性的影响
如表2所示,青稞BG的分子质量和粒径均随着水解时间延长而降低。不同分子质量青稞BG对青稞淀粉体外消化性的影响情况如图2所示,加入相同质量浓度(10 mg/mL)不同分子质量的青稞BG,青稞淀粉消化分解生成的还原糖含量(单位:mg)按从大到小排序为:888.63±18.11(空白组)>785.11±14.44(BG-120)>752.42±5.44(BG-60)>736.08±5.45(BG-30)>725.18±8.29(BG-15)>687.04±13(BG-0)。青稞BG分子质量越大,青稞淀粉消化分解生成的还原糖越少,且显著低于空白对照组(P<0.05)。这可能是由于青稞BG分子质量越大,溶液黏度越大,分子质量降低会导致青稞BG溶液黏度降低。同一质量浓度下,青稞BG分子质量越大的溶液黏度越高,溶液黏滞阻力越大,对消化酶的屏障作用越强,抑制淀粉消化程度越显著。
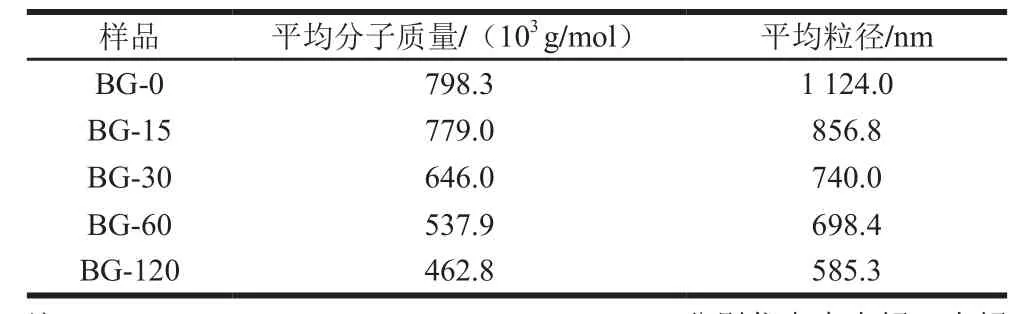
表2 不同分子质量青稞BG的平均分子质量和平均粒径Table 2 Average molecular mass and particle size of different highland barley β-glucans
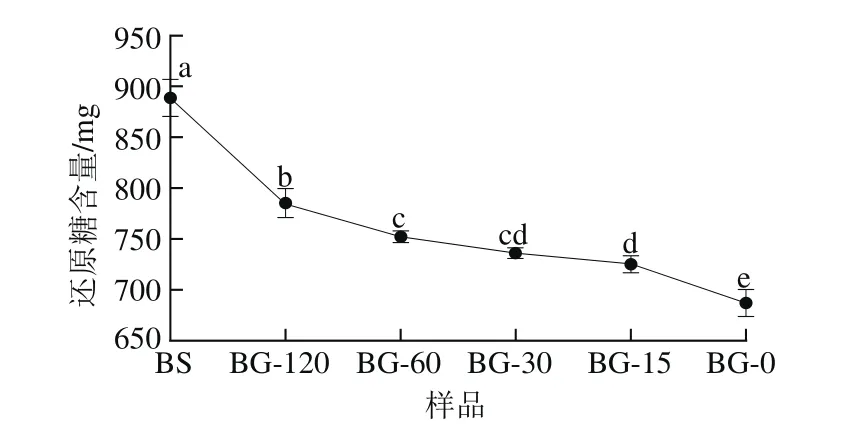
图2 青稞BG分子质量对青稞淀粉体外消化性的影响Fig. 2 Effect of highland barley β-glucans with different molecular masses on starch digestibility in vitro
2.4 青稞BG流变学性质
不同质量浓度、分子质量青稞BG溶液的剪切流动性和黏弹性及流变曲线牛顿幂律拟合参数分别见图3、表3。由图3A、B可知,不同质量浓度、分子质量的青稞BG溶液表观黏度均随剪切速率的增加而降低,流体指数n小于1,表现为典型的非牛顿假塑性流体行为。同一剪切速率下,青稞BG质量浓度和分子质量越大,溶液表观黏度越大。由表3可知,稠度系数与青稞BG质量浓度和分子质量均呈正相关。
由图3C、4D可知,不同质量浓度、分子质量的青稞BG的G’和G”均随角频率增加而增加,且青稞BG质量浓度越高,分子质量越大,溶液G’和G”越大。由表3可知,稠度系数K’和K”与青稞BG质量浓度和分子质量均呈正相关,这说明高质量浓度、高分子质量的青稞BG溶液具有更强的黏弹性表现,这可能是因为高质量浓度、高分子质量的青稞BG分子间相互作用更强。不同质量浓度青稞BG溶液G′拟合的幂律方程斜率(n’=0.85~1.26)大于G”拟合后的斜率(n”=0.55~0.84),不同分子质量青稞BG溶液G’拟合的幂律方程斜率(n’=0.62~1.21)大于G”拟合后的斜率(n”=0.56~1.06),这说明青稞BG弹性贡献随角速率的增大而增大的程度强于黏性贡献,表明青稞BG凝胶具备较强韧的凝胶结构。综上,青稞BG质量浓度和分子质量变化对溶液黏弹性有显著影响,从而在2.2节和2.3节中表现出对青稞淀粉体外消化影响不同的差异。
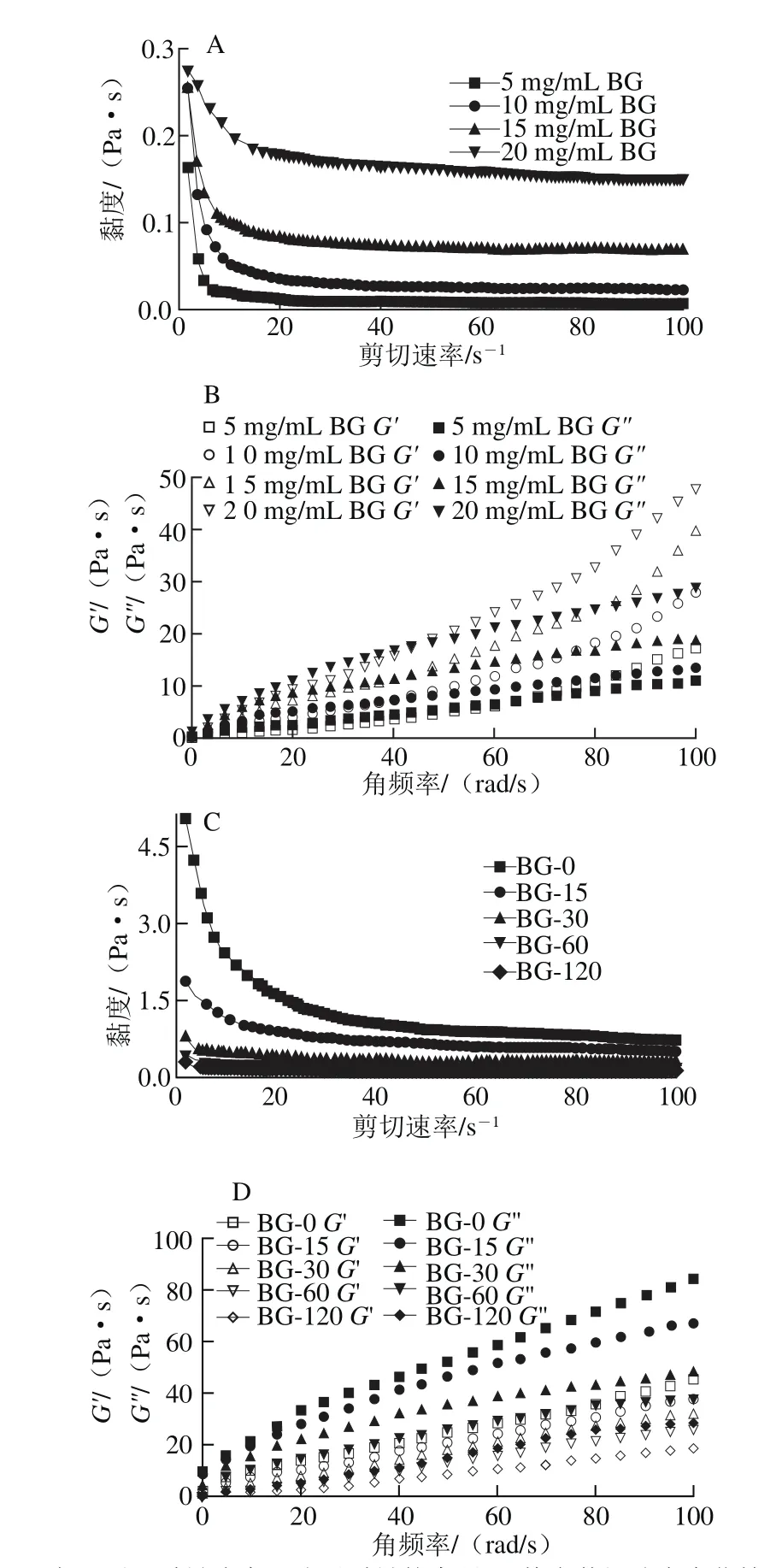
图3 不同质量浓度、不同分子质量青稞BG溶液的剪切流动性和黏弹性Fig. 3 Flowability and viscoelasticity of highland barley β-glucan solutions at different concentrations and molecular masses
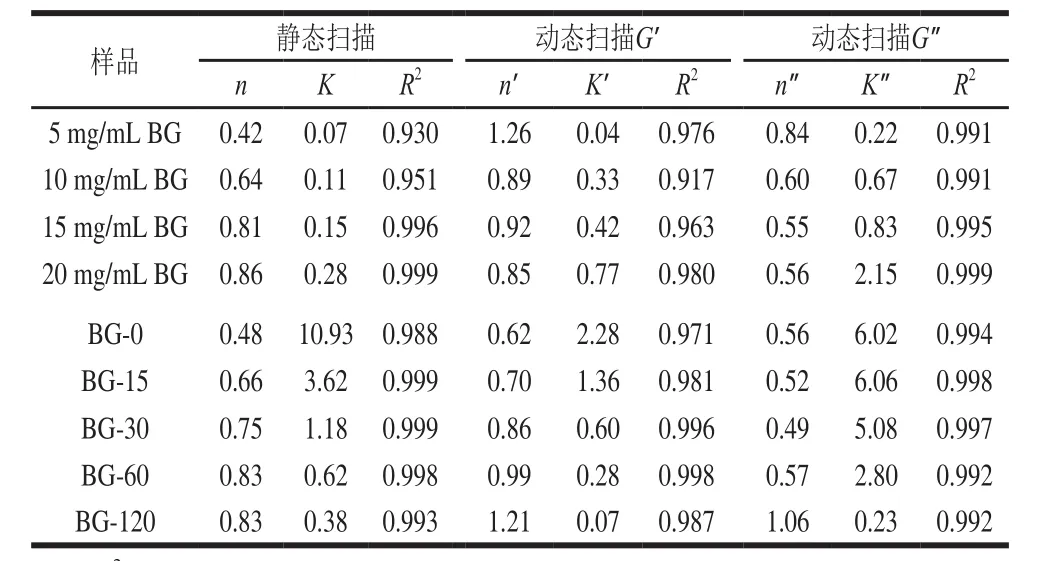
表3 不同质量浓度、不同分子质量BG溶液流变曲线牛顿幂律拟合参数Table 3 Power law fitting parameters for highland barley β-glucan solutions at different concentrations and molecular masses
2.5 青稞BG对α-淀粉酶的荧光淬灭作用
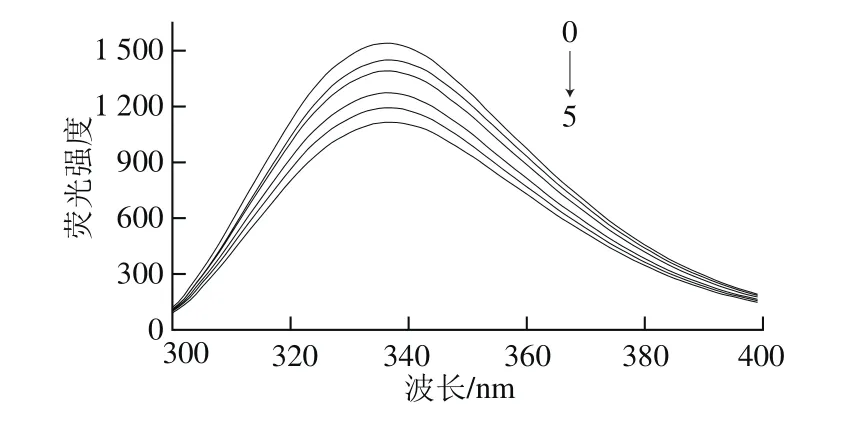
图4 不同质量浓度青稞BG与α-淀粉酶相互作用的荧光光谱Fig. 4 Effect of highland barley β-glucan at different concentrations on fluorescence spectra of α-amylase
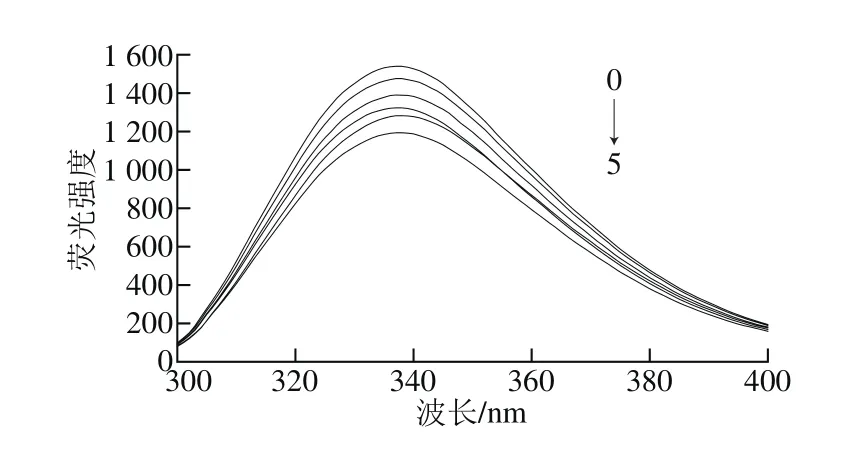
图5 不同分子质量青稞BG与α-淀粉酶相互作用的荧光光谱Fig. 5 Effect of highland barley β-glucan with different molecular masses on fluorescence spectra of α-amylase
蛋白质中色氨酸的存在使其具有内源荧光[28],而α-淀粉酶分子含有至少16 个色氨酸残基[29],因此α-淀粉酶色氨酸残基的天然荧光及其变化值可直接反映蛋白质本身和周围环境的变化。由图4可知,在280 nm激发波长下,α-淀粉酶在337 nm波长处有最大荧光发射峰,且随着青稞BG质量浓度的不断增大,α-淀粉酶荧光发射峰强度逐渐减弱。由此可见,青稞BG对α-淀粉酶有荧光猝灭作用,可能是由于青稞BG与蛋白质分子中色氨酸残基发生静电和氢键相互作用,微扰α-淀粉酶的构象,使色氨酸残基所处的疏水微环境发生明显变化[28]。此外,由图5可知,同一质量浓度下,随青稞BG分子质量增加,α-淀粉酶在337 nm波长处荧光发射峰强度逐渐降低,淬灭作用程度增加。可能是由于青稞BG分子质量大小影响α-淀粉酶微结构和抑制作用,青稞BG分子质量降低,对α-淀粉酶荧光淬灭作用降低,抑制α-淀粉酶效果下降[30]。
3 结 论
本研究结果表明:青稞全粉中淀粉消化率显著低于小麦粉中淀粉消化率,具有低血糖功效,这与其中的BG密切相关。青稞BG质量浓度和分子质量越大,溶液黏度和弹性越大,延缓青稞淀粉消化效果越显著。高质量浓度、高分子质量的青稞BG溶液易形成凝胶覆盖在淀粉颗粒表面,阻碍淀粉酶与淀粉颗粒接触,从而抑制淀粉的消化。此外,青稞BG形成的高黏性溶液环境对α-淀粉酶构象和所处的微环境有一定影响,使α-淀粉酶活性部分被抑制,且青稞BG质量浓度越高、分子质量越大,抑制效果越明显。青稞BG能抑制淀粉消化、降低餐后血糖,青稞BG可作为功能性成分,应用于降血糖和保健食品等领域。
参考文献:
[1]扎桑拉姆. 浅析青稞原料主要营养成分与青稞产业的发展[J]. 西藏科技, 2006(10): 6-7. DOI:10.3969/j.issn.1004-3403.2006.10.002.
[2]张峰, 杨勇, 赵国华, 等. 青稞β-葡聚糖研究进展[J]. 粮食与油脂,2003(12): 3-5. DOI:10.3969/j.issn.1008-9578.2003.12.001.
[3]LIMBERGER-BAYER V M, DE FRANCISCO A, CHAN A, et al.Barley β-glucans extraction and partial characterization[J]. Food Chemistry, 2014, 154: 84-89. DOI:10.1016/j.foodchem.2013.12.104.
[4]汪海波, 刘大川, 汪海婴, 等. 燕麦β-葡聚糖对小肠蠕动及淀粉酶活性的影响研究[J]. 营养学报, 2006, 28(2): 148-151. DOI:10.3321/j.issn:0512-7955.2006.02.023.
[5]张宇. 燕麦β-葡聚糖对淀粉消化吸收和血糖的影响[D]. 无锡: 江南大学, 2015.
[6]申瑞玲, 王志瑞, 董吉林, 等. 燕麦β-葡聚糖对高脂血症大鼠空腹和餐后脂代谢的影响[J]. 食品科学, 2009, 30(1): 258-260.DOI:10.3321/j.issn:1002-6630.2009.01.062.
[7]汪海波, 刘大川, 汪海婴, 等. 燕麦β-葡聚糖对糖尿病大鼠的血糖及糖代谢功能的影响研究[J]. 食品科学, 2005, 26(8): 387-391.DOI:10.3321/j.issn:1002-6630.2005.08.102.
[8]宋江南, 田明杰, 苏立宏, 等. 青稞β-葡聚糖对高脂诱导的C57小鼠胆固醇代谢的影响[J]. 中华疾病控制杂志, 2013(2): 93-98.
[9]李莎莎, 贾冬英, 姚开. 青稞β-葡聚糖对胆固醇的吸附作用研究[J]. 氨基酸和生物资源, 2012, 34(2): 29-33. DOI:10.3969/j.issn.1006-8376.2012.02.008.
[10]王艳丽, 刘凌, 孙慧, 等. 几种不同来源β-葡聚糖的体外功能特性[J].食品与发酵工业, 2013, 39(11): 68-72.
[11]臧靖巍, 阚建全, 陈宗道, 等. 青稞的成分研究及其应用现状[J]. 中国食品添加剂, 2004(4): 43-46. DOI:10.3969/j.issn.1006-2513.2004.04.010.
[12]徐菲, 党斌, 迟德钊. 超声波辅助提取青稞β-葡聚糖工艺优化[J].食品科技, 2014, 39(12): 217-221.
[13]王谦, 董海丽. 超高压提取青稞β-葡聚糖工艺优化[J]. 粮食与油脂,2016, 29(5): 79-81. DOI:10.3969/j.issn.1008-9578.2016.05.023.
[14]王谦, 董海丽. 超滤纯化青稞β-葡聚糖的研究[J]. 湖北农业科学, 2016,55(6): 1530-1531. DOI:10.14088/j.cnki.issn0439-8114.2016.06.042.
[15]罗燕平, 李家林, 张雪飞. 微波辅助提取青稞β-葡聚糖工艺优化[J].农产品加工: 下, 2016(7): 35-38. DOI:10.16693/j.cnki.1671-9646(X).2016.07.039.
[16]邵舒, 董吉林, 申瑞玲, 等. 青稞β-葡聚糖凝胶热特性、动态粘弹性及微观结构研究[J]. 食品工业科技, 2016, 37(3): 54-57.DOI:10.13386/j.issn1002-0306.2016.03.002.
[17]申瑞玲, 曹高山, 常广双, 等. 青稞β-葡聚糖凝胶形成及其特性研究[J].中国粮油学报, 2009(7): 55-58.
[18]贾莹. 青稞麸皮水溶性β-葡聚糖的提取、分离纯化和性质研究[D].上海: 华东理工大学, 2013.
[19]谢昊宇, 何思宇, 贾冬英, 等. 青稞β-葡聚糖的分离纯化及理化特性研究[J]. 食品科技, 2016, 41(1): 142-146.
[20]马栋, 邹妍, 龚倩云, 等. 响应面法优化青稞β-葡聚糖提取条件的研究[J]. 食品工业科技, 2012, 33(1): 204-206.
[21]刘新兴, 李建颖, 赵彦巧, 等. 青稞淀粉的提取工艺优化研究[J]. 食品研究与开发, 2014, 35(5): 34-37. DOI:10.3969/j.issn.1005-6521.2014.05.010.
[22]郑学玲, 张玉玉, 张杰. 青稞淀粉理化特性的研究[J]. 中国粮油学报,2011, 26(4): 30-36.
[23]张慧娟, 王静, 刘英丽, 等. 碱法提取青稞淀粉的理化性质研究[J].中国食品学报, 2016, 16(3): 75-80. DOI:10.16429/j.1009-7848.2016.03.010.
[24]苏波, 贾旭, 冷晓莲, 等. 喜树碱对胰α-淀粉酶部分性质的影响[J].天然产物研究与开发, 2007, 19(3): 452-454. DOI:10.3969/j.issn.1001-6880.2007.03.023.
[25]王峰, 梁力曼, 顾正彪, 等. 聚乙烯醇、聚乙烯胺与淀粉酶相互作用荧光光谱[J]. 应用化学, 2010, 27(1): 96-101. DOI:10.3969/j.issn.1000-0518.2010.01.019.
[26]李琼, 陈磊, 韦庆益, 等. 柚皮素与α-淀粉酶相互作用的研究[J]. 现代食品科技, 2014, 30(2): 58-61.
[27]龚凌霄. 青稞全谷物及其防治代谢综合征的作用研究[D]. 杭州:浙江大学, 2013.
[28]GAWLIK-DZIKI U, DZIKI D, BARANIAK B, et al. The effect of simulated digestion in vitro on bioactivity of wheat bread with Tartary buckwheat flavones addition[J]. LWT-Food Science and Technology,2009, 42(1): 137-143. DOI:10.1016/j.lwt.2008.06.009.
[29]郑芸, 雷芳, 刘芯韵, 等. 咖啡因对胰α-淀粉酶部分理化性质的影响[J].天然产物研究与开发, 2007, 19(6): 1016-1019. DOI:10.3969/j.issn.1001-6880.2007.06.024.
[30]FITTER J, HERRMANN R, DENCHER N A, et al. Activity and stability of a thermostable α-amylase compared to its mesophilic homologue: mechanisms of thermal adaptation[J]. Biochemistry, 2001,40(35): 10723-10731. DOI:10.1021/bi010808b.
