香榧不同部位提取物的抗氧化和酶抑制活性比较分析
2018-05-23刘鹏飞涂宗财张恕雅沙小梅戴花剑
张 露,刘鹏飞,涂宗财,,*,谢 星,张恕雅,沙小梅,王 辉,戴花剑
(1.江西师范大学生命科学学院,江西 南昌 330022)2.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
香榧(Torreya grandis cv. Merrillii)为红豆杉科榧属常绿乔木,又称细榧、榧子、玉榧,是我国特有、世界稀有的经济树种。香榧除了加工成坚果类食品作为美食佳品外,还是名贵中药材,入药具有延缓衰老、清肺润肠、止渴化痰、消积通便等功效[1],但关于香榧的生物活性及其化学组成的研究比较少。药理学研究显示,香榧仁提取物及其萃取组分具有较好的抗氧化[2]、预防动脉粥样硬化[3]功能;香榧叶具有抗炎和镇痛作用[4];香榧假种皮提取物具有抗肿瘤、抑制艾滋病病毒生长和抗氧化的作用[5-6]。Saeed等[4]报道,香榧叶中含有生物碱、黄酮、单宁、萜类和皂苷类化合物。何关福等[7]从香榧叶中鉴定出了榧属植物的特征成分榧黄素;于勇杰等[8]发现二萜类物质为香榧假种皮提取物的主要成分,其次为倍半萜类和单萜类物质;周大铮[5]从香榧假种皮中分离鉴定了8 种二萜类化合物和8 种木质素类化合物。但目前还鲜见报道对香榧叶、茎、假种皮、种壳和种仁中活性成分的含量进行比较,也鲜见关于香榧降血糖和抗痛风活性方面的报道。
本实验以香榧叶、香榧茎、香榧假种皮、香榧壳和香榧仁为原料,分别分析90%乙醇溶液提取物中总酚、总黄酮和缩合单宁的含量,通过1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基和2,2’-联氮-双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)自由基清除能力2 个体外抗氧化模型,以及α-葡萄糖苷酶活性抑制能力和黄嘌呤氧化酶(xanthine oxidase,XOD)活性抑制能力评价香榧不同部位活性成分含量,及其提取物的抗氧化、降血糖和抗痛风能力,为香榧资源的高效利用提供参考。
1 材料与方法
1.1 材料与试剂
新鲜的香榧叶、茎和种子于2016年9月29日采集于江西省抚州市黎川县香榧种植基地,采后的原料用自来水冲洗后,将种子的假种皮、种壳和种仁分开,冷冻干燥,粉碎,最后于4 ℃保存。
Folin-Ciocalteu试剂、Na2CO3、AlCl3、没食子酸、槲皮素 上海晶纯生化科技股份有限公司;ABTS、DPPH、阿卡波糖、α-葡萄糖苷酶(来源于酵母,EC 3.2.1.20)、XOD(来源于牛奶)、黄嘌呤、别嘌呤醇和p-硝基苯基-α-D-吡喃葡萄糖苷(p-nitrophenyl-α-D-glucopyranoside,PNPG) 西格玛奥德里奇(上海)贸易有限公司。所有试剂均为分析纯。
1.2 仪器与设备
SynergyH1酶标分析仪 美国BioTek公司;T6新世纪紫外-可见分光光度计 北京普析通用仪器有限公司;TGL-10C高速台式离心机 上海安亭科学仪器厂;ML104电子天平 梅特勒-托利多仪器(上海)有限公司。
1.3 方法
1.3.1 样品制备
准确称取1.5 g香榧叶、茎、假种皮、种壳和香榧仁粉末,以90%乙醇溶液为溶剂按1∶20(g/mL)的固液比,500 W、50 ℃超声处理1.0 h,4 000 r/min离心10 min,收集上清液,残渣再在相同条件下提取2 次,合并上清液,旋转浓缩后用90%甲醇溶液定容至25 mL,4 ℃冰箱保存用于后续分析。
1.3.2 总酚含量测定
采用Folin-Ciocalteu法测定提取液中总酚的含量[9]。分别取200 µL稀释后的样品溶液和0.1 mL Folin-Ciocalteu试剂于试管中,摇匀,5 min后加入0.3 mL 20% Na2CO3溶液和1.0 mL蒸馏水,室温避光反应25 min后4 000 r/min离心5 min,然后取200 µL于96 孔酶标板中用酶标仪测反应体系在波长765 nm处的吸光度Ai,以加样品不加20% Na2CO3溶液的反应体系为样品空白Aj,样品的吸光度为ΔA=Ai-Aj。以没食子酸(40~120 µg/mL)为标准品绘制标准曲线,结果表示为毫克没食子酸当量(gallic acid equivalent,GAE)每克干原料(mg GAE/g)。实验重复3 次。
1.3.3 总黄酮含量测定
采用AlCl3法测定样品中的总黄酮含量[10]。分别准确取0.1 mL适宜浓度的样品溶液与0.1 mL 2% AlCl3·6H2O(甲醇配制)于96 孔酶标板中混匀,室温反应15 min后于波长430 nm处测吸光度Ai。以0.1 mL甲醇代替AlCl3·6H2O的体系为样品空白Aj,样品的吸光度为ΔA=Ai-Aj。以槲皮素为标准品(5.0~40.0 µg/mL)绘制标准曲线,结果表示为毫克槲皮素当量(quercetin equivalent,QuE)每克干原料(mg QuE/g)。实验重复3 次。
1.3.4 缩合单宁含量测定
采用香草醛法[11]测样品中缩合单宁的含量。取0.5 mL稀释到适宜浓度的样品与3.5 mL新鲜配制的1%香草醛溶液(7 mol/L H2SO4配制)混合,避光反应15 min后用紫外-可见分光光度计测体系在波长500 nm处的吸光度Ai。以3.5 mL 7 mol/L H2SO4代替香草醛溶液的体系为样品空白Aj,样品的吸光度为ΔA=Ai-Aj。以儿茶素(50~250 µg/mL)为标准品绘制标准曲线,样品中缩合单宁含量表示为毫克儿茶素当量(catechin equivalent,CE)每克干原料(mg CE/g)。实验重复3 次。
1.3.5 DPPH自由基清除能力测定
参照前期研究方法,采用DPPH自由基清除能力实验比较不同样品的自由基清除能力[12]。以槲皮素为阳性对照,结果用抑制率表示。样品清除50%的DPPH自由基所需要的样品质量浓度用IC50值表示(mg/mL),以干基计。所有实验重复3 次。
1.3.6 ABTS+·清除能力
采用ABTS+·清除能力实验评价样品的总抗氧化能力[13]。首先将38.4 mg ABTS和6.623 mg过硫酸钾混合定容至10 mL配制成ABTS母液,室温避光反应12~16 h后用甲醇稀释至溶液在波长734 nm处的吸光度为7.0±0.2左右。分别取30 µL稀释到适宜浓度的样品与220 µL ABTS溶液于96孔酶标板中混合,避光反应6 min后于波长734 nm测吸光度,以槲皮素为阳性对照,结果用抑制率表示。清除50%的自由基所需要的样品质量浓度用IC50值表示(mg/mL),以干基计。所有实验重复3 次。
1.3.7 α-葡萄糖苷酶活性抑制能力
参照费群勤等[14]的方法测定样品对α-葡萄糖苷酶活性的抑制能力。50 μL不同浓度的样品或阿卡波糖和50 μL 0.1 U α-葡萄糖苷酶(用0.1 mol/L,pH 6.9磷酸盐缓冲溶液(phosphate buffer saline,PBS)配制)于96 孔酶标板中混匀,25 ℃反应10 min后分别加入50 μL 5 mmol/L PNPG溶液(用0.1 mol/L,pH 6.9的PBS配制),室温反应30 min后加100 μL 0.2 mol/L Na2CO3溶液终止反应,最后于波长405 nm处测吸光度Ai。以90%乙醇溶液代替样品的反应体系为控制组(Ac),以PBS代替酶液的反应体系为样品空白组(Aj),以90%乙醇溶液和PBS分别代替样品和酶液的体系为空白(Ab)。所有测定平行3 次,抑制50%的酶活所需要的样品质量浓度用IC50值表示(mg/mL),以干基计,酶活性抑制能力按公式(1)计算:

1.3.8 XOD活性抑制能力
参照El Euch等[15]的方法评价样品对XOD活性的抑制能力。先后将60 μL 70 mmol/L,pH 7.5的PBS与50 μL适宜浓度的样品溶液和50 μL 0.1 U/mL的XOD加在96 孔酶标板中,25 ℃反应15 min后加入60 μL 150 μmol/L的黄嘌呤,25 ℃反应5 min后于波长295 nm处测吸光度Ai,以90%乙醇溶液代替样品的反应体系为控制组(Ac),以PBS代替酶液的反应体系为样品空白组(Aj),以90%乙醇溶液和PBS分别代替样品和酶液的体系为空白(Ab)。以别嘌呤为标准品,所有实验重复3 次,抑制50%的酶活所需要的样品质量浓度用IC50值表示(mg/mL),以干基计。酶活性抑制能力的计算同公式(1)。
1.4 数据处理
采用Origin 8.0软件计算样品清除自由基或抑制酶活性的IC50值,采用SPSS 19.0中的单因素方差分析(ANOVA)分析数据间的显著性差异(P<0.05),所有结果用 ±s表示。采用皮尔森相关性分析方法评价总酚、总黄酮和缩合单宁含量与抗氧化和酶抑制活性之间的相关性。
2 结果与分析
2.1 总酚、总黄酮和缩合单宁含量分析
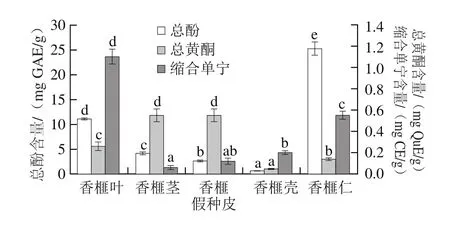
图1 香榧不同部位样品中总酚、总黄酮和缩合单宁含量Fig. 1 Contents of total phenolics, total flavonoids and total tannins of samples from different parts of Chinese torreya
由图1可知,香榧不同部位提取物中的总酚含量差别很大,其含量顺序为:香榧仁(25.28 mg GAE/g)>香榧叶(11.1 mg GAE/g)>香榧茎(4.23 mg GAE/g)>香榧假种皮(2.62 mg GAE/g)>香榧壳(0.65 mg GAE/g)。香榧仁提取液中的总酚含量最高,香榧壳提取液中的总酚含量最低,只有香榧仁的2.57%。由此可知,多酚类物质主要存在于香榧的果仁之中。
如图1所示,不同香榧样品中总黄酮含量的变化趋势与总酚含量不同,香榧假种皮和香榧茎提取液中的黄酮含量最高,为0.55~0.56 mg QuE/g,且两者间不存在显著性差异(P>0.05),香榧叶中的总黄酮含量次之,为0.26 mg QuE/g,香榧壳中的总黄酮含量最低,仅为香榧假种皮的8.93%。由此可知,香榧中的黄酮类物质主要存在于香榧假种皮和香榧茎之中。这可能是因为香榧假种皮、香榧茎和香榧叶长期暴露于外部环境,氧化应激、光合作用等条件促使这些部位合成更多的黄酮类化合物。Carvalhoa等[16]表明长的光照周期有利于促进甘薯叶中黄酮类化合物的合成。Azuma等[17]发现,低温和光照条件处理均可大大提高葡萄果肉中黄酮类化合物合成相关基因的表达。
由图1可知,不同香榧部位样品中的缩合单宁含量的差异很大,其变化范围为0.06~1.10 mg CE/g。香榧叶提取液具有最高的缩合单宁含量,为1.10 mg CE/g,其次为香榧仁0.55 mg CE/g ,香榧茎中的缩合单宁含量最低(0.06 mg CE/g),只有香榧叶的5.45%。因此,香榧中的缩合单宁类物质主要存在于香榧叶中。
2.2 抗氧化活性评价
活性氧自由基(reactive oxide species,ROS)是生物新陈代谢的正常产物,但是机体中过多的ROS会导致活细胞中蛋白质、DNA和其他生物大分子的损伤,从而产生一系列退化性疾病,如癌症、心血管疾病、中风、糖尿病、代谢紊乱、脑功能障碍和免疫功能下降等[18-19]。研究证明,抗氧化剂是降低机体中活性氧自由基过多的一种有效方法,但合成性抗氧化剂如二丁基羟基甲苯、没食子酸丙酯,对机体具有致癌和致诱变的副作用[20-21]。植物中的抗氧化活性成分——多酚类化合物是天然的抗氧化剂资源,且具有绿色、高效和无毒副作用的特点[22-23]。因此研究植物的抗氧化活性成分及其能力对预防糖尿病及其并发症具有重要意义。
2.2.1 DPPH自由基清除能力测定结果

图2 香榧不同部位样品的DPPH自由基清除能力Fig. 2 DPPH radical scavenging ability of samples from different parts of Chinese torreya

表1 香榧不同部位DPPH自由基清除能力、ABTS+ ·清除能力、α-葡萄糖苷酶和XOD活性抑制能力的IC50值Table 1 IC50 values for DPPH radical scavenging ability, ABTS+·scavenging ability, and α-glucosidase and XOD inhibitory activity of different parts of Chinese torreya mg/mL
采用DPPH自由基清除能力体外模型比较香榧不同部位的抗氧化能力,如图2所示,其IC50值如表1所示。在测试质量浓度范围内(0.05~30 mg/mL),所有样品均具有较好的DPPH自由基清除能力,且其清除能力随样品质量浓度的增加逐渐增加。香榧仁具有最高的DPPH自由基清除能力,其IC50值为0.48 mg/mL,其次为香榧叶(1.19 mg/mL),香榧壳的DPPH自由基清除能力最低,其值约为香榧叶的16 倍,这可能是与香榧仁中最高的总酚含量和较高的缩合单宁含量有关。相关性分析表明,香榧不同部位提取物的DPPH自由基清除能力与总酚、总黄酮和缩合单宁含量的相关系数分别为0.817、0.041和0.667,表明酚类化合物对样品的DPPH自由基清除能力的贡献最大,其次为缩合单宁类化合物,由此初步推断酚类化合物为香榧中主要的自由基清除剂。Shi Haiming等[2]也发现香榧仁具有较好的抗氧化能力,酚类化合物为其主要活性成分。
2.2.2 ABTS+·清除能力测定结果
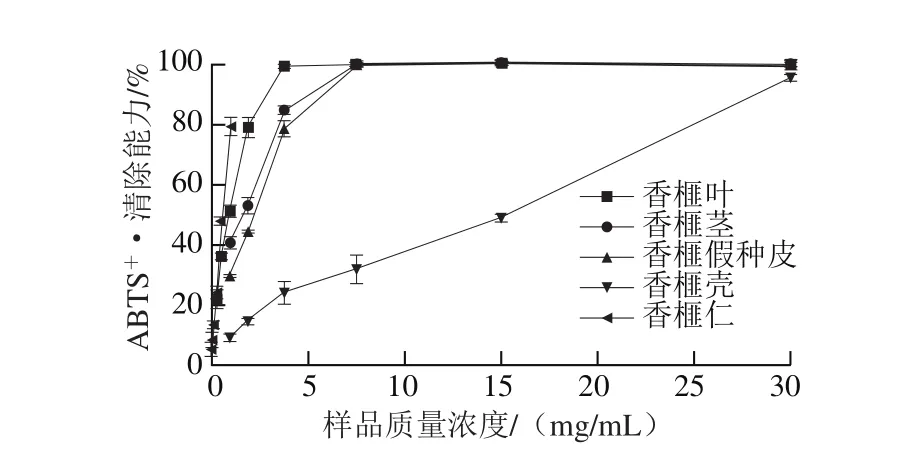
图3 香榧不同部位样品的ABTS+·清除能力Fig. 3 ABTS+· scavenging ability of samples from different parts of Chinese torreya
为验证DPPH自由基清除能力实验得到的结果,进一步采用ABTS+·清除能力实验比较香榧不同部位提取物的抗氧化活性,如图3所示。当样品质量浓度低于3.75 mg/mL时,所有样品对ABTS+·的清除能力呈明显的量效关系,且其变化趋势总体上与DPPH自由基清除能力相似。香榧不同部位样品清除ABTS+·的IC50值的变化趋势为:香榧仁(0.53 mg/mL)<香榧叶(0.90 mg/mL)<香榧茎(1.65 mg/mL)<香榧假种皮(2.24 mg/mL)<香榧壳(15.35 mg/mL)。因此,香榧仁具有最高的ABTS+·清除能力,香榧壳的ABTS+·清除能力最低。但按照干原料的质量计算时,香榧样品的自由基清除能力均低于阳性对照品槲皮素。相关性分析表明,ABTS+·清除能力与样品中总酚和缩合单宁的含量具有较高的相关性系数,相关系数分别为0.534和0.536,而黄酮含量与ABTS+·的清除能力呈弱相关(r=0.337),表明酚酸和缩合单宁类化合物为香榧中清除ABTS+·的主要作用成分。
2.3 降血糖潜力评价
α-葡萄糖苷酶是位于人小肠上皮细胞膜表面的碳水化合物水解酶,它通过将低聚糖或二糖水解为人体可吸收的单糖来促进人体对碳水化合物的吸收,当其活性被抑制时,能有效降低碳水化合物的消化速率,从而降低餐后和空腹血糖水平[24]。天然、高效、无毒副作用的α-葡萄糖苷酶抑制剂被称为糖尿病学上“未开发的钻石”[25],被推荐为糖尿病一线治疗药物[26]。因此,采用α-葡萄糖苷酶活性抑制能力实验评价香榧不同部位的降血糖潜力,如图4所示。

图4 香榧不同部位样品的α-葡萄糖苷酶活性抑制能力Fig. 4 α-Glucosidase inhibitory activity of samples from different parts of Chinese torreya
由图4可知,当α-葡萄糖苷酶活性的抑制率低于90%时,香榧仁和香榧壳提取物的α-葡萄糖苷酶活性抑制能力随着样品质量浓度的增加而增加,但香榧茎和香榧假种皮提取物抑制α-葡萄糖苷酶活性的能力随样品质量浓度的升高增加较缓慢,且在测试样品质量浓度范围内(0.94~30 mg/mL)两者之间的α-葡萄糖苷酶活性抑制能力相差不大,而香榧叶提取物不存在α-葡萄糖苷酶活性抑制能力。香榧仁提取物抑制α-葡萄糖苷酶活性的IC50值最低,仅为0.14 mg/mL,远低于糖尿病临床治疗药物阿卡波糖的1.29 mg/mL,因此,香榧仁具有最高的α-葡萄糖苷酶活性抑制能力,可作为一种潜在的天然降血糖活性成分资源。相关性分析表明,样品的α-葡萄糖苷酶活性抑制能力与总酚、总黄酮、缩合单宁含量的相关系数分别为0.568、0.895和0.733,表明黄酮类化合物对香榧仁抑制α-葡萄糖苷酶活性的贡献最大,其次为单宁类化合物。
2.4 XOD活性抑制能力
XOD是核酸代谢过程中一种重要的复合性黄素蛋白酶,它能催化体内的次黄嘌呤和黄嘌呤产生尿酸和过氧化物自由基。当机体中XOD的活性较高时,就会导致尿酸的大量生成,最终导致高尿酸血症及痛风[27]。机体长期高尿酸水平会增加糖尿病、高血脂、肥胖、肾结石、高血压和心脏病等多种疾病发病率[28-29]。降低尿酸水平的有效方法之一是利用XOD抑制剂降低XOD的活性,从而降低黄嘌呤、次黄嘌呤转化为尿酸的反应速率[30]。因此采用XOD活性抑制实验评价香榧不同部位提取物在痛风和高尿酸血症预防和治疗方面的应用前景。

图5 香榧不同部位样品的XOD活性抑制能力Fig. 5 Xanthine oxidase inhibitory activity of samples from different parts of Chinese torreya
由图5可知,香榧仁提取物具有相对较强的XOD活性抑制能力,当样品质量浓度为0.94~15.00 mg/mL时,其活性随样品质量浓度的增加逐渐增加,IC50值为3.07 mg/mL,但该值远高于阳性对照物别嘌呤醇(IC50值为9.15 μg/mL)。香榧假种皮提取物的XOD活性抑制能力较弱,其IC50值均大于15 mg/mL,而香榧叶、香榧茎和香榧壳提取物没有XOD活性抑制能力。这可能取决于香榧仁中高的总酚和缩合单宁含量。以质量浓度为7.5 mg/mL时样品的XOD活性抑制能力进行相关性分析发现,总酚、总黄酮和缩合单宁含量与XOD活性抑制能力的相关系数分别为0.745、0.032和0.562,表明酚酸和单宁类化合物为香榧仁中主要的抑制XOD活性的作用成分。
3 结 论
本实验比较了香榧的叶、茎、假种皮、种壳和种仁提取物中总酚、总黄酮和缩合单宁含量以及体外抗氧化活性的差异,并首次分析了香榧不同部位提取物对α-葡萄糖苷酶和XOD活性的抑制能力。结果表明,香榧仁提取物是优于香榧叶、茎、假种皮和种壳的天然抗氧化剂、α-葡萄糖苷酶和XOD抑制剂资源。香榧仁中的主要活性成分为酚类化合物,其次为缩合单宁类;香榧叶中的主要活性成分为缩合单宁类化合物,其次为酚类;香榧茎和香榧假种皮中的活性成分主要为黄酮类化合物。香榧仁具有较好的DPPH自由基和ABTS+·清除能力,及α-葡萄糖苷酶活性和XOD活性抑制能力,且活性高于香榧的叶、茎、假种皮和种壳。同时,香榧仁对α-葡萄糖苷酶活性的抑制能力约为糖尿病临床治疗药物阿卡波糖的9.21 倍,但自由基清除能力和XOD抑制能力低于阳性对照品。酚酸和缩合单宁类化合物对香榧的抗氧化和XOD抑制活性起主要作用,黄酮和缩合单宁类化合物对样品的α-葡萄糖苷酶抑制活性起主要作用。但香榧仁中的具体作用成分需要进一步深入研究。
参考文献:
[1]肖庆来, 曾松伟, 黎章矩, 等. 香榧研究现状与展望[J]. 浙江林业科技, 2014, 34(3): 93-97. DOI:1001-3776(2014) 03-0093-06.
[2]SHI H M, WANG H, WANG M, et al. Antioxidant activity and chemical composition of Torreya grandis cv. Merrillii seed[J]. Natural Product Communications, 2009, 4(11): 1565-1570.
[3]CHEN Z, CHEN Z, HOU L, et al. The preventive effect of the oil from the seed of Torreya grandis cv. Merrillii on experimental atherosclerosis in rats[J]. Journal of Chinese Medicinal Materials,2000, 23(9): 551-553.
[4]SAEED M K, DENG Y, DAI R, et al. Appraisal of antinociceptive and anti-inflammatory potential of extract and fractions from the leaves of Torreya grandis Fort Ex. Lindl[J]. Journal of Ethnopharmacology,2010, 127(2): 414-418. DOI:10.1016/j.jep.2009.10.024.
[5]周大铮. 香榧中抗艾滋病病毒先导化合物的研究和结构修饰[D].北京: 第二军医大学, 2004.
[6]何宛燕, 陈雨欣, 于勇杰, 等. 香榧假种皮提取物的体外抗氧化活性研究[J]. 中国野生植物资源, 2015, 34(6): 1-4. DOI:10.3969/j.issn.1006-9690.2015.06.001.
[7]何关福, 马忠武, 印万芬. 长叶榧双黄酮及其在分类上的意义[J].中国科学院大学学报, 1983, 21(4): 433-435.
[8]于勇杰, 吴帆, 李彪, 等. 香榧假种皮提取物的提取工艺及其主要成分分析[J]. 中国食品学报, 2015, 15(3): 97-104. DOI:10.16429/j.1009-7848.2015.03.013.
[9]ZHANG L, TU Z C, YUAN T, et al. Antioxidants and α-glucosidase inhibitors from Ipomoea batatas leaves identified by bioassay-guided approach and structure-activity relationships[J]. Food Chemistry, 2016,208: 61-67. DOI:10.1016/j.foodchem.2016.03.079.
[10]ZHANG L, TU Z C, XIE X, et al. Antihyperglycemic, antioxidant activities of two Acer palmatum cultivars, and identification of phenolics profile by UPLC-QTOF-MS/MS: new natural sources of functional constituents[J]. Industrial Crops and Products, 2016, 89:522-532. DOI:10.1016/j. indcrop.2016.06.005.
[11]BEKIR J, MARS M, SOUCHARD J P, et al. Assessment of antioxidant, anti-inflammatory, anti-cholinesterase and cytotoxic activities of pomegranate (Punica granatum) leaves[J]. Food and Chemical Toxicology, 2013, 55: 470-475. DOI:10.1016/j.fct.2013.01.036.
[12]ZHANG L, TU Z C, XIE X, et al. Jackfruit (Artocarpus heterophyllus Lam.) peel: a better source of antioxidants and a-glucosidase inhibitors than pulp, flake and seed, and phytochemical profile by HPLC-QTOFMS/MS[J]. Food Chemistry, 2017, 234(1): 303-313. DOI:10.1016/j.foodchem.2017.05.003.
[13]王小平, 张广峰, 雷激, 等. 粒径对麸皮多酚及其抗氧化活性的影响[J]. 食品与发酵工业, 2016, 42(9): 160-164. DOI:10.13995/j.cnki.11-1802/ts.201609028.
[14]费群勤, 秦一禾, 杨孟伽, 等. 乌龙茶粗多酚、EGCG和EGCG3''Me体外抑制α-葡萄糖苷酶活性[J]. 食品科学, 2014, 35(21): 10-15.DOI:10.7506/spkx1002-6630-201421003.
[15]EL EUCH S K, BOUAJILA J, BOUZOUIT N A. Chemical composition, biological and cytotoxic activities of Cistus salviifolius flower buds and leaves extracts[J]. Industrial Crops and Products,2015, 76: 1100-1105. DOI:10.1016/j.indcrop.2015.08.033.
[16]CARVALHO I S, CAVACO T, CARVALHO L M, et al. Effect of photoperiod on flavonoid pathway activity in sweet potato (Ipomoea batatas (L.) Lam.) leaves[J]. Food Chemistry, 2010, 118(2): 384-390.DOI:10.1016/j.foodchem.2009.05.005.
[17]AZUMA A, YAKUSHIJI H, KOSHITA Y, et al. Flavonoid biosynthesis-related genes in grape skin are differentially regulated by temperature and light conditions[J]. Planta, 2012, 236(4): 1067-1080.DOI:10.1007/s00425-012-1650-x.
[18]AMES B N, SHIGENAGA M K, HAGEN T M. Oxidants,antioxidants, and the degenerative diseases of aging[J]. Proceedings of the National Academy of Sciences, 1993, 90(17): 7915-7922.
[19]FURUKAWA S, FUJITA T, MICHIO S, et al. Increased oxidative stress in obesity and its impact on metabolic syndrome[J]. The Journal of Clinical Investigation, 2004, 114(12): 1752-1761. DOI:10.1172/JCI21625.
[20]BOTTERWECK A, VERHAGEN H, GOLDBOHM R, et al. Intake of butylated hydroxyanisole and butylated hydroxytoluene and stomach cancer risk: results from analyses in the Netherlands cohort study[J].Food and Chemical Toxicology, 2000, 38(7): 599-605. DOI:10.1016/S0278-6915(00)00042-9.
[21]SAFER A, Al-NUGHAMISH A. Hepatotoxicity induced by the antioxidant food additive, butylated hydroxytoluene BHT, in rats. An electron microscopical study[J]. Histology and Histopathology, 1999,14(2): 391-406.
[22]DUDA-CHODAK A, TARKO T, SATORA P, et al. Interaction of dietary compounds, especially polyphenols, with the intestinal microbiota: a review[J]. European Journal of Nutrition, 2015: 1-17.DOI:10.1007/s00394-015-0852-y.
[23]SANTHAKUMAR A B, BULMER A C, SINGH I. A review of the mechanisms and effectiveness of dietary polyphenols in reducing oxidative stress and thrombotic risk[J]. Journal of Human Nutrition and Dietetics, 2014, 27(1): 1-21. DOI:10.1111/jhn.12177.
[24]KUMAR S, NARWAL S, KUMAR V, et al. a-Glucosidase inhibitors from plants: a natural approach to treat diabetes[J]. Pharmacognosy Reviews, 2011, 5(9): 19-29. DOI:10.4103/0973-7847.79096.
[25]KALRA S. Alpha glucosidase inhibitors[J]. The Journal of the Pakistan Medical Association, 2014, 64(4): 474-476.
[26]GARBER A, ABRAHAMSON M, BARZILAY J, et al. AACE comprehensive diabetes management algorithm 2013[J].Endocrine Practice, 2013, 19(2): 327-336. DOI:10.4158/endp.19.2.a38267720403k242.
[27]刘佳, 李玲. 高尿酸血症的发病机制与药物治疗研究进展[J].国际药学研究杂志, 2010, 37(1): 24-28. DOI:10.13220/j.cnki.jipr.2010.01.004.
[28]LI C, HSIEH M C, CHANG S J. Metabolic syndrome, diabetes, and hyperuricemia[J]. Current Opinion in Rheumatology, 2013, 25(2):210-216. DOI:10.1097/BOR.0b013e32835d951e.
[29]WANG J, QIN T, CHEN J, et al. Hyperuricemia and risk of incident hypertension: a systematic review and meta-analysis of observational studies[J]. PLoS ONE, 2014, 9(12): e114259. DOI:10.1371/journal.pone.0114259.
[30]刘永贵, 赵丽嘉, 崔艳丽, 等. 抗高尿酸血症药物研究进展[J]. 现代药物与临床, 2015(3): 345-350. DOI:10.7501/j.issn.1674-5515.2015.03.026.
